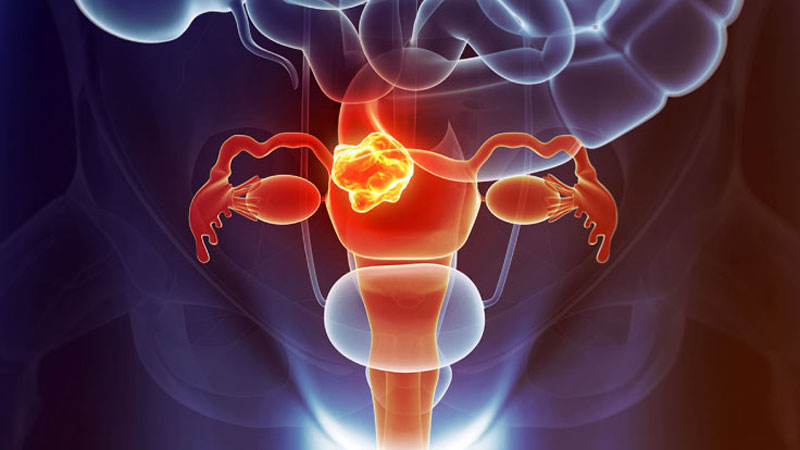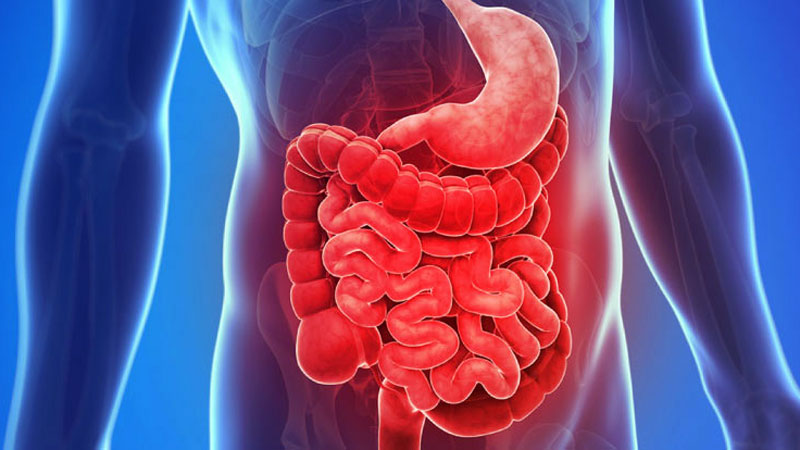
Com formato muito parecido com a de uma borboleta, a glândula tireoide é localizada na parte anterior do pescoço, logo abaixo do Pomo de Adão e é responsável pela produção dos hormônios T3 (triiodotironina) e o T4 (tiroxina) que são essenciais porque interferem em vários controles do organismo, como os batimentos cardíacos, a temperatura, o metabolismo (conjunto de mecanismos químicos necessários ao organismo) que pode ficar mais rápido ou lento, e os movimentos intestinais.
Quais são os tipos de câncer de tireoide?
Carcinoma papilifero – é o mais comum. Pode aparecer em pacientes de qualquer idade, mas é mais freqüente entre 30 e 50 anos. Estima-se que uma a cada mil pessoas tem ou já teve este tipo de câncer. A taxa de cura é alta, chegando a quase 100%.
– Carcinoma folicular – Costuma ocorrer em indivíduos com mais de 40 anos. É mais agressivo do que o papilífero. Em dois terços dos casos, não têm tendência à disseminação. Um tipo de carcinoma folicular mais agressivo é o hurthle, que atinge pessoas com mais de 60 anos.
– Carcinoma medular – Afeta as células parafoliculares, responsáveis pela produção da calcitonia, hormônio que contribui na regulação do nível sanguíneo de cálcio. É de difícil tratamento e, usualmente, se apresenta de moderado a muito agressivo.
– Carcinoma anaplásico ou inmedular – Extremamente raro. Contudo, é do tipo mais agressivo e tem o tratamento mais difícil. É responsável por dois terços dos óbitos de câncer da tireóide.
O que causa o câncer de tireoide e quem está em risco?
A causa exata do câncer de tireoide não é conhecida, mas as pessoas com certos fatores de risco são mais vulneráveis que outras à doença.
Esses fatores de risco incluem:
- tratamentos com radiação para a cabeça, pescoço ou tórax, especialmente na infância ou adolescência
- história familiar de câncer de tireoide
- um grande nódulo ou em rápido crescimento
- idade superior a 40 anos
Ter um fator de risco não significa que você terá câncer de tireoide e algumas pessoas desenvolvem a doença não tem nenhum fator de risco. Ainda assim, ter um nódulo de tireoide com qualquer um desses fatores de risco requer avaliação.
Fonte: ACS
O principal sinal é a aparição de um nódulo indolor na tireoide.
Fonte: ACS
O diagnóstico de câncer na tireoide considera os achados no exame clínico de palpação da glândula e a presença de gânglios linfáticos aumentados. Entretanto, como apenas pequeno número de nódulos é palpável, exames de imagem como a ultrassonografia, a cintilografia e a ressonância magnética são recursos úteis para o diagnóstico. O mais importante, porém, é a biopsia de aspiração com agulha fina para identificar a presença ou não de células tumorais malignas.
Fonte: ACS
Em geral, o tratamento do câncer de tireoide é cirúrgico (tireoidectomia total ou parcial) e leva em conta o tipo e a gravidade da doença. Caso as células malignas tenham comprometido os gânglios cervicais, é necessário retirá-los.
Rouquidão e queda de cálcio são complicações da tireoidectomia associadas a lesões de estruturas como os nervos laríngeos e as glândulas paratireoides respectivamente durante a cirurgia.
Depois de quatro a seis semanas da intervenção, o paciente recebe doses terapêuticas de iodo radioativo em ambiente hospitalar para extinguir qualquer tecido remanescente de células tumorais no corpo e evitar metástases. Quando os carcinomas papilíferos e foliculares não respondem a esse tratamento, é possível recorrer à terapêutica antiangiogênica que consiste em bloquear a formação de novos vasos sanguíneos para impedir que as células tumorais recebam nutrientes e oxigênio através da circulação. O passo seguinte é indicar a reposição hormonal com levotiroxina por via oral para substituir os hormônios que deixaram de ser produzidos pela tireoide. Radioterapia, associada ou não à quimioterapia, é recomendada na ocorrência de tumores mais agressivos, como o carcinoma medular e o carcinoma anaplásico.
Fonte: ACS
É preciso que o médico e o paciente estejam sempre atentos ao estadiamento da doença! Mas, o que é estadiamento? São os estágios que o câncer está no momento, ou seja, o tamanho, a localização e se espalhou para outros órgãos. O estádio de um tumor reflete não apenas a taxa de crescimento e a extensão da doença, mas também o tipo de tumor e sua relação com o hospedeiro. O sistema de estadiamento mais utilizado é o TNM da American Joint Committee on Cancer.
O que é TNM?
É a abreviatura de tumor, linfonodo e metástase. Este sistema utiliza três critérios para avaliar o estágio do câncer:
-
O próprio tumor ( T + um número de 0 a 4 usa-se para descrever o tumor primário);
-
Os linfonodos regionais ao redor do tumor ( N + 0 a 3 usa-se para descrever se a doença disseminou para os gânglios linfáticos)
-
E se o tumor se espalhou para outras partes do corpo (M usa-se para descrever que a doença se espalhou para outros órgãos)
O estadiamento pode ser clínico e patológico. O estadiamento clínico é estabelecido a partir dos dados do exame físico e dos exames complementares. O estadiamento patológico baseia-se nos achados cirúrgicos e no exame anátomopatológico – é estabelecido após tratamento cirúrgico e determina a extensão da doença com maior precisão. Lembrando que o estadiamento patológico pode ou não coincidir com o estadiamento clínico e não é aplicável a todos os tumores.
E o estadiamento do câncer da TIREOIDE, como funciona?
Categorias T para o câncer de tiróide (exceto o câncer anaplásico de tireoide)
TX: O tumor primário não pode ser avaliado.
T0: Nenhuma evidência de tumor primário.
T1: O tumor é de 2 cm (um pouco menos de uma polegada) em toda ou menor e não cresceu fora da tireoide.
-
T1a: O tumor tem 1 cm de diâmetro ou menos e não cresceu fora da tireoide.
-
T1b: O tumor é maior do que 1 cm mas não maior do que 2 cm de diâmetro e não cresceu fora da tireoide.
T2: O tumor tem mais de 2 cm de diâmetro, mas não mais de 4 cm e não cresceu fora da tireoide.
T3: O tumor é maior que 4 cm de diâmetro, ou apenas começou a crescer em tecidos próximos fora da tireoide.
T4a: O tumor é de qualquer tamanho e cresceu extensivamente além da glândula tireoide em tecidos próximos do pescoço, como a laringe, traquéia, esôfago, ou o nervo para a laringe. Isso também é chamado de doença moderadamente avançada .
T4b: O tumor é de qualquer tamanho e cresceu de volta para a espinha ou em grandes vasos sanguíneos próximos. Isso também é chamado de doença muito avançada .
Categorias T para câncer de tireoide anaplásico
Todos os cânceres anaplásicos da tireoide são considerados tumores T4 no momento do diagnóstico.
T4a: O tumor ainda está dentro da tireoide.
T4b: O tumor cresceu fora da tireoide.
Categorias N para o câncer de tireoide
NX: Os gânglios linfáticos regionais (próximos) não podem ser avaliados.
N0: O câncer não se espalhou para os gânglios linfáticos próximos.
N1: O câncer se espalhou para os gânglios linfáticos próximos.
-
N1a: O câncer se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (chamados pré-traqueal , paratraqueal e gânglios linfáticos pré-laríngeos ).
-
N1b: O câncer se espalhou para outros gânglios linfáticos no pescoço (chamado cervical ) ou para os gânglios linfáticos atrás da garganta ( retrofaríngea ) ou no tórax superior ( mediastino superior ).
Categorias M para o câncer de tireoide
MX : A metástase distante não pode ser avaliada.
M0: Não há metástase distante.
M1: O câncer se espalhou para outras partes do corpo, como linfonodos distantes, órgãos internos, ossos, etc.
Agrupamento de estágios
Uma vez que os valores de T, N e M são determinados, eles são combinados em estágios, expressos como um número romano de I a IV. Às vezes as letras são usadas para dividir ainda mais uma fase. Ao contrário da maioria dos outros tipos, os cânceres de tireoide são agrupados em estádios de uma forma que também considera o subtipo de câncer e a idade do paciente.
Câncer de tireoide papilar ou folicular (diferenciado) em pacientes com idade inferior a 45 anos
As pessoas mais jovens têm uma baixa probabilidade de morrer de câncer de tireoide diferenciado (papilar ou folicular). Os agrupamentos de estádio TNM para estes cânceres têm em conta este fato. Assim, todas as pessoas com menos de 45 anos com esses cânceres são estágio I, se eles não têm propagação distante, e estágio II, se eles têm propagação distante.
Estágio I (Qualquer T, Qualquer N, M0): O tumor pode ser de qualquer tamanho (qualquer T) e pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
Estágio II (Qualquer T, Qualquer N, M1): O tumor pode ser de qualquer tamanho (qualquer T) e pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide papilar ou folicular (diferenciado) em pacientes com 45 anos ou mais
Estágio I (T1, N0, M0): O tumor tem 2 cm ou menos e não cresceu fora da tireoide (T1). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio II (T2, N0, M0): O tumor tem mais de 2 cm de diâmetro, mas não tem mais de 4 cm de diâmetro e não cresceu fora da tireoide (T2). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio III: Um dos seguintes se aplica:
T3, N0, M0: O tumor tem mais de 4 cm de diâmetro ou cresceu ligeiramente para fora da tireoide (T3), mas não se espalhou para nódulos linfáticos próximos (N0) ou locais distantes (M0).
T1 a T3, N1a, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da tireoide (T1 a T3). Ele se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (N1a), mas não para outros linfonodos ou para locais distantes (M0).
Estágio IVA: Uma das seguintes opções aplica-se:
T4a, qualquer N, M0: O tumor é de qualquer tamanho e cresceu para além da glândula tireoide e nos tecidos próximos do pescoço (T4a). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
T1 a T3, N1b, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da glândula tireoide (T1 a T3). Ele se espalhou para certos gânglios linfáticos no pescoço (nódulos cervicais) ou para os gânglios linfáticos no tórax superior (nódulos mediastinais superiores) ou atrás da garganta (nódulos retrofaríngeos) (N1b), mas não se espalhou para locais distantes (M0) .
Estágio IVB (T4b, Qualquer N, M0): O tumor tem qualquer tamanho e cresceu de volta para a espinha ou para grandes vasos sanguíneos próximos (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor é de qualquer tamanho e pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide medular
A idade não é um fator no estágio do câncer medular da tireoide.
Estágio I (T1, N0, M0): O tumor tem 2 cm ou menos e não cresceu fora da tireoide (T1). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio II: Uma das seguintes situações aplica-se:
T2, N0, M0: O tumor tem mais de 2 cm mas não tem mais de 4 cm de diâmetro e não cresceu fora da tireoide (T2). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
T3, N0, M0: O tumor é maior que 4 cm ou cresceu ligeiramente fora da tireoide (T3), mas não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio III (T1 a T3, N1a, M0): O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da tireoide (T1 para T3). Ele se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (N1a), mas não para outros linfonodos ou para locais distantes (M0).
Estágio IVA: Uma das seguintes opções aplica-se:
T4a, qualquer N, M0: O tumor é de qualquer tamanho e cresceu para além da glândula da tireoide e nos tecidos próximos do pescoço (T4a). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
T1 a T3, N1b, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da glândula tireoide (T1 a T3). Ele se espalhou para certos gânglios linfáticos no pescoço (nódulos cervicais) ou para os gânglios linfáticos no tórax superior (nódulos mediastinais superiores) ou atrás da garganta (nódulos retrofaríngeos) (N1b), mas não se espalhou para locais distantes (M0) .
Estágio IVB (T4b, Qualquer N, M0): O tumor tem qualquer tamanho e cresceu de volta para a espinha ou para grandes vasos sanguíneos próximos (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor é de qualquer tamanho e pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide anaplásico (indiferenciado)
Todos os cânceres de tireoide anaplásico são considerados estágio IV, refletindo o mau prognóstico deste tipo de câncer.
Estágio IVA (T4a, Qualquer N, M0): O tumor ainda está dentro da tireoide (T4a). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVB (T4b, Qualquer N, M0): O tumor cresceu fora da tiróide (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Recorrente do câncer de tireoide
Esta não é uma etapa real no sistema TNM. O câncer que retorna após o tratamento é chamado de recorrente (ou recaída ). Se o câncer de tireoide retorna, geralmente está no pescoço, mas pode voltar para outra parte do corpo (por exemplo, linfonodos, pulmões ou ossos). Os médicos podem atribuir uma nova fase com base em quão longe o câncer se espalhou, mas isso não é geralmente um processo tão formal como o estadiamento original. A presença de doença recorrente não altera o estadiamento formal original.
Se você tiver alguma dúvida sobre o estágio de seu câncer ou como ele afeta suas opções de tratamento, não se esqueça de perguntar ao seu médico.
Fonte: American Cancer Society
Com formato muito parecido com a de uma borboleta, a glândula tireoide é localizada na parte anterior do pescoço, logo abaixo do Pomo de Adão e é responsável pela produção dos hormônios T3 (triiodotironina) e o T4 (tiroxina) que são essenciais porque interferem em vários controles do organismo, como os batimentos cardíacos, a temperatura, o metabolismo (conjunto de mecanismos químicos necessários ao organismo) que pode ficar mais rápido ou lento, e os movimentos intestinais.
Quais são os tipos de câncer de tireoide?
Carcinoma papilifero – é o mais comum. Pode aparecer em pacientes de qualquer idade, mas é mais freqüente entre 30 e 50 anos. Estima-se que uma a cada mil pessoas tem ou já teve este tipo de câncer. A taxa de cura é alta, chegando a quase 100%.
– Carcinoma folicular – Costuma ocorrer em indivíduos com mais de 40 anos. É mais agressivo do que o papilífero. Em dois terços dos casos, não têm tendência à disseminação. Um tipo de carcinoma folicular mais agressivo é o hurthle, que atinge pessoas com mais de 60 anos.
– Carcinoma medular – Afeta as células parafoliculares, responsáveis pela produção da calcitonia, hormônio que contribui na regulação do nível sanguíneo de cálcio. É de difícil tratamento e, usualmente, se apresenta de moderado a muito agressivo.
– Carcinoma anaplásico ou inmedular – Extremamente raro. Contudo, é do tipo mais agressivo e tem o tratamento mais difícil. É responsável por dois terços dos óbitos de câncer da tireóide.
O que causa o câncer de tireoide e quem está em risco?
A causa exata do câncer de tireoide não é conhecida, mas as pessoas com certos fatores de risco são mais vulneráveis que outras à doença.
Esses fatores de risco incluem:
- tratamentos com radiação para a cabeça, pescoço ou tórax, especialmente na infância ou adolescência
- história familiar de câncer de tireoide
- um grande nódulo ou em rápido crescimento
- idade superior a 40 anos
Ter um fator de risco não significa que você terá câncer de tireoide e algumas pessoas desenvolvem a doença não tem nenhum fator de risco. Ainda assim, ter um nódulo de tireoide com qualquer um desses fatores de risco requer avaliação.
Fonte: ACS
O principal sinal é a aparição de um nódulo indolor na tireoide.
Fonte: ACS
O diagnóstico de câncer na tireoide considera os achados no exame clínico de palpação da glândula e a presença de gânglios linfáticos aumentados. Entretanto, como apenas pequeno número de nódulos é palpável, exames de imagem como a ultrassonografia, a cintilografia e a ressonância magnética são recursos úteis para o diagnóstico. O mais importante, porém, é a biopsia de aspiração com agulha fina para identificar a presença ou não de células tumorais malignas.
Fonte: ACS
Em geral, o tratamento do câncer de tireoide é cirúrgico (tireoidectomia total ou parcial) e leva em conta o tipo e a gravidade da doença. Caso as células malignas tenham comprometido os gânglios cervicais, é necessário retirá-los.
Rouquidão e queda de cálcio são complicações da tireoidectomia associadas a lesões de estruturas como os nervos laríngeos e as glândulas paratireoides respectivamente durante a cirurgia.
Depois de quatro a seis semanas da intervenção, o paciente recebe doses terapêuticas de iodo radioativo em ambiente hospitalar para extinguir qualquer tecido remanescente de células tumorais no corpo e evitar metástases. Quando os carcinomas papilíferos e foliculares não respondem a esse tratamento, é possível recorrer à terapêutica antiangiogênica que consiste em bloquear a formação de novos vasos sanguíneos para impedir que as células tumorais recebam nutrientes e oxigênio através da circulação. O passo seguinte é indicar a reposição hormonal com levotiroxina por via oral para substituir os hormônios que deixaram de ser produzidos pela tireoide. Radioterapia, associada ou não à quimioterapia, é recomendada na ocorrência de tumores mais agressivos, como o carcinoma medular e o carcinoma anaplásico.
Fonte: ACS
É preciso que o médico e o paciente estejam sempre atentos ao estadiamento da doença! Mas, o que é estadiamento? São os estágios que o câncer está no momento, ou seja, o tamanho, a localização e se espalhou para outros órgãos. O estádio de um tumor reflete não apenas a taxa de crescimento e a extensão da doença, mas também o tipo de tumor e sua relação com o hospedeiro. O sistema de estadiamento mais utilizado é o TNM da American Joint Committee on Cancer.
O que é TNM?
É a abreviatura de tumor, linfonodo e metástase. Este sistema utiliza três critérios para avaliar o estágio do câncer:
-
O próprio tumor ( T + um número de 0 a 4 usa-se para descrever o tumor primário);
-
Os linfonodos regionais ao redor do tumor ( N + 0 a 3 usa-se para descrever se a doença disseminou para os gânglios linfáticos)
-
E se o tumor se espalhou para outras partes do corpo (M usa-se para descrever que a doença se espalhou para outros órgãos)
O estadiamento pode ser clínico e patológico. O estadiamento clínico é estabelecido a partir dos dados do exame físico e dos exames complementares. O estadiamento patológico baseia-se nos achados cirúrgicos e no exame anátomopatológico – é estabelecido após tratamento cirúrgico e determina a extensão da doença com maior precisão. Lembrando que o estadiamento patológico pode ou não coincidir com o estadiamento clínico e não é aplicável a todos os tumores.
E o estadiamento do câncer da TIREOIDE, como funciona?
Categorias T para o câncer de tiróide (exceto o câncer anaplásico de tireoide)
TX: O tumor primário não pode ser avaliado.
T0: Nenhuma evidência de tumor primário.
T1: O tumor é de 2 cm (um pouco menos de uma polegada) em toda ou menor e não cresceu fora da tireoide.
-
T1a: O tumor tem 1 cm de diâmetro ou menos e não cresceu fora da tireoide.
-
T1b: O tumor é maior do que 1 cm mas não maior do que 2 cm de diâmetro e não cresceu fora da tireoide.
T2: O tumor tem mais de 2 cm de diâmetro, mas não mais de 4 cm e não cresceu fora da tireoide.
T3: O tumor é maior que 4 cm de diâmetro, ou apenas começou a crescer em tecidos próximos fora da tireoide.
T4a: O tumor é de qualquer tamanho e cresceu extensivamente além da glândula tireoide em tecidos próximos do pescoço, como a laringe, traquéia, esôfago, ou o nervo para a laringe. Isso também é chamado de doença moderadamente avançada .
T4b: O tumor é de qualquer tamanho e cresceu de volta para a espinha ou em grandes vasos sanguíneos próximos. Isso também é chamado de doença muito avançada .
Categorias T para câncer de tireoide anaplásico
Todos os cânceres anaplásicos da tireoide são considerados tumores T4 no momento do diagnóstico.
T4a: O tumor ainda está dentro da tireoide.
T4b: O tumor cresceu fora da tireoide.
Categorias N para o câncer de tireoide
NX: Os gânglios linfáticos regionais (próximos) não podem ser avaliados.
N0: O câncer não se espalhou para os gânglios linfáticos próximos.
N1: O câncer se espalhou para os gânglios linfáticos próximos.
-
N1a: O câncer se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (chamados pré-traqueal , paratraqueal e gânglios linfáticos pré-laríngeos ).
-
N1b: O câncer se espalhou para outros gânglios linfáticos no pescoço (chamado cervical ) ou para os gânglios linfáticos atrás da garganta ( retrofaríngea ) ou no tórax superior ( mediastino superior ).
Categorias M para o câncer de tireoide
MX : A metástase distante não pode ser avaliada.
M0: Não há metástase distante.
M1: O câncer se espalhou para outras partes do corpo, como linfonodos distantes, órgãos internos, ossos, etc.
Agrupamento de estágios
Uma vez que os valores de T, N e M são determinados, eles são combinados em estágios, expressos como um número romano de I a IV. Às vezes as letras são usadas para dividir ainda mais uma fase. Ao contrário da maioria dos outros tipos, os cânceres de tireoide são agrupados em estádios de uma forma que também considera o subtipo de câncer e a idade do paciente.
Câncer de tireoide papilar ou folicular (diferenciado) em pacientes com idade inferior a 45 anos
As pessoas mais jovens têm uma baixa probabilidade de morrer de câncer de tireoide diferenciado (papilar ou folicular). Os agrupamentos de estádio TNM para estes cânceres têm em conta este fato. Assim, todas as pessoas com menos de 45 anos com esses cânceres são estágio I, se eles não têm propagação distante, e estágio II, se eles têm propagação distante.
Estágio I (Qualquer T, Qualquer N, M0): O tumor pode ser de qualquer tamanho (qualquer T) e pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
Estágio II (Qualquer T, Qualquer N, M1): O tumor pode ser de qualquer tamanho (qualquer T) e pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide papilar ou folicular (diferenciado) em pacientes com 45 anos ou mais
Estágio I (T1, N0, M0): O tumor tem 2 cm ou menos e não cresceu fora da tireoide (T1). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio II (T2, N0, M0): O tumor tem mais de 2 cm de diâmetro, mas não tem mais de 4 cm de diâmetro e não cresceu fora da tireoide (T2). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio III: Um dos seguintes se aplica:
T3, N0, M0: O tumor tem mais de 4 cm de diâmetro ou cresceu ligeiramente para fora da tireoide (T3), mas não se espalhou para nódulos linfáticos próximos (N0) ou locais distantes (M0).
T1 a T3, N1a, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da tireoide (T1 a T3). Ele se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (N1a), mas não para outros linfonodos ou para locais distantes (M0).
Estágio IVA: Uma das seguintes opções aplica-se:
T4a, qualquer N, M0: O tumor é de qualquer tamanho e cresceu para além da glândula tireoide e nos tecidos próximos do pescoço (T4a). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
T1 a T3, N1b, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da glândula tireoide (T1 a T3). Ele se espalhou para certos gânglios linfáticos no pescoço (nódulos cervicais) ou para os gânglios linfáticos no tórax superior (nódulos mediastinais superiores) ou atrás da garganta (nódulos retrofaríngeos) (N1b), mas não se espalhou para locais distantes (M0) .
Estágio IVB (T4b, Qualquer N, M0): O tumor tem qualquer tamanho e cresceu de volta para a espinha ou para grandes vasos sanguíneos próximos (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor é de qualquer tamanho e pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide medular
A idade não é um fator no estágio do câncer medular da tireoide.
Estágio I (T1, N0, M0): O tumor tem 2 cm ou menos e não cresceu fora da tireoide (T1). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio II: Uma das seguintes situações aplica-se:
T2, N0, M0: O tumor tem mais de 2 cm mas não tem mais de 4 cm de diâmetro e não cresceu fora da tireoide (T2). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
T3, N0, M0: O tumor é maior que 4 cm ou cresceu ligeiramente fora da tireoide (T3), mas não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio III (T1 a T3, N1a, M0): O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da tireoide (T1 para T3). Ele se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (N1a), mas não para outros linfonodos ou para locais distantes (M0).
Estágio IVA: Uma das seguintes opções aplica-se:
T4a, qualquer N, M0: O tumor é de qualquer tamanho e cresceu para além da glândula da tireoide e nos tecidos próximos do pescoço (T4a). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
T1 a T3, N1b, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da glândula tireoide (T1 a T3). Ele se espalhou para certos gânglios linfáticos no pescoço (nódulos cervicais) ou para os gânglios linfáticos no tórax superior (nódulos mediastinais superiores) ou atrás da garganta (nódulos retrofaríngeos) (N1b), mas não se espalhou para locais distantes (M0) .
Estágio IVB (T4b, Qualquer N, M0): O tumor tem qualquer tamanho e cresceu de volta para a espinha ou para grandes vasos sanguíneos próximos (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor é de qualquer tamanho e pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide anaplásico (indiferenciado)
Todos os cânceres de tireoide anaplásico são considerados estágio IV, refletindo o mau prognóstico deste tipo de câncer.
Estágio IVA (T4a, Qualquer N, M0): O tumor ainda está dentro da tireoide (T4a). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVB (T4b, Qualquer N, M0): O tumor cresceu fora da tiróide (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Recorrente do câncer de tireoide
Esta não é uma etapa real no sistema TNM. O câncer que retorna após o tratamento é chamado de recorrente (ou recaída ). Se o câncer de tireoide retorna, geralmente está no pescoço, mas pode voltar para outra parte do corpo (por exemplo, linfonodos, pulmões ou ossos). Os médicos podem atribuir uma nova fase com base em quão longe o câncer se espalhou, mas isso não é geralmente um processo tão formal como o estadiamento original. A presença de doença recorrente não altera o estadiamento formal original.
Se você tiver alguma dúvida sobre o estágio de seu câncer ou como ele afeta suas opções de tratamento, não se esqueça de perguntar ao seu médico.
Fonte: American Cancer Society
- O que é?
-
Com formato muito parecido com a de uma borboleta, a glândula tireoide é localizada na parte anterior do pescoço, logo abaixo do Pomo de Adão e é responsável pela produção dos hormônios T3 (triiodotironina) e o T4 (tiroxina) que são essenciais porque interferem em vários controles do organismo, como os batimentos cardíacos, a temperatura, o metabolismo (conjunto de mecanismos químicos necessários ao organismo) que pode ficar mais rápido ou lento, e os movimentos intestinais.
Quais são os tipos de câncer de tireoide?
Carcinoma papilifero – é o mais comum. Pode aparecer em pacientes de qualquer idade, mas é mais freqüente entre 30 e 50 anos. Estima-se que uma a cada mil pessoas tem ou já teve este tipo de câncer. A taxa de cura é alta, chegando a quase 100%.
– Carcinoma folicular – Costuma ocorrer em indivíduos com mais de 40 anos. É mais agressivo do que o papilífero. Em dois terços dos casos, não têm tendência à disseminação. Um tipo de carcinoma folicular mais agressivo é o hurthle, que atinge pessoas com mais de 60 anos.
– Carcinoma medular – Afeta as células parafoliculares, responsáveis pela produção da calcitonia, hormônio que contribui na regulação do nível sanguíneo de cálcio. É de difícil tratamento e, usualmente, se apresenta de moderado a muito agressivo.
– Carcinoma anaplásico ou inmedular – Extremamente raro. Contudo, é do tipo mais agressivo e tem o tratamento mais difícil. É responsável por dois terços dos óbitos de câncer da tireóide.
- Fatores de Risco
-
O que causa o câncer de tireoide e quem está em risco?
A causa exata do câncer de tireoide não é conhecida, mas as pessoas com certos fatores de risco são mais vulneráveis que outras à doença.
Esses fatores de risco incluem:
- tratamentos com radiação para a cabeça, pescoço ou tórax, especialmente na infância ou adolescência
- história familiar de câncer de tireoide
- um grande nódulo ou em rápido crescimento
- idade superior a 40 anos
Ter um fator de risco não significa que você terá câncer de tireoide e algumas pessoas desenvolvem a doença não tem nenhum fator de risco. Ainda assim, ter um nódulo de tireoide com qualquer um desses fatores de risco requer avaliação.
Fonte: ACS
- Sintomas
-
O principal sinal é a aparição de um nódulo indolor na tireoide.
Fonte: ACS
- Diagnóstico
-
O diagnóstico de câncer na tireoide considera os achados no exame clínico de palpação da glândula e a presença de gânglios linfáticos aumentados. Entretanto, como apenas pequeno número de nódulos é palpável, exames de imagem como a ultrassonografia, a cintilografia e a ressonância magnética são recursos úteis para o diagnóstico. O mais importante, porém, é a biopsia de aspiração com agulha fina para identificar a presença ou não de células tumorais malignas.
Fonte: ACS
- Tratamento
-
Em geral, o tratamento do câncer de tireoide é cirúrgico (tireoidectomia total ou parcial) e leva em conta o tipo e a gravidade da doença. Caso as células malignas tenham comprometido os gânglios cervicais, é necessário retirá-los.
Rouquidão e queda de cálcio são complicações da tireoidectomia associadas a lesões de estruturas como os nervos laríngeos e as glândulas paratireoides respectivamente durante a cirurgia.
Depois de quatro a seis semanas da intervenção, o paciente recebe doses terapêuticas de iodo radioativo em ambiente hospitalar para extinguir qualquer tecido remanescente de células tumorais no corpo e evitar metástases. Quando os carcinomas papilíferos e foliculares não respondem a esse tratamento, é possível recorrer à terapêutica antiangiogênica que consiste em bloquear a formação de novos vasos sanguíneos para impedir que as células tumorais recebam nutrientes e oxigênio através da circulação. O passo seguinte é indicar a reposição hormonal com levotiroxina por via oral para substituir os hormônios que deixaram de ser produzidos pela tireoide. Radioterapia, associada ou não à quimioterapia, é recomendada na ocorrência de tumores mais agressivos, como o carcinoma medular e o carcinoma anaplásico.
Fonte: ACS
- Estadiamento
-
É preciso que o médico e o paciente estejam sempre atentos ao estadiamento da doença! Mas, o que é estadiamento? São os estágios que o câncer está no momento, ou seja, o tamanho, a localização e se espalhou para outros órgãos. O estádio de um tumor reflete não apenas a taxa de crescimento e a extensão da doença, mas também o tipo de tumor e sua relação com o hospedeiro. O sistema de estadiamento mais utilizado é o TNM da American Joint Committee on Cancer.
O que é TNM?
É a abreviatura de tumor, linfonodo e metástase. Este sistema utiliza três critérios para avaliar o estágio do câncer:
-
O próprio tumor ( T + um número de 0 a 4 usa-se para descrever o tumor primário);
-
Os linfonodos regionais ao redor do tumor ( N + 0 a 3 usa-se para descrever se a doença disseminou para os gânglios linfáticos)
-
E se o tumor se espalhou para outras partes do corpo (M usa-se para descrever que a doença se espalhou para outros órgãos)
O estadiamento pode ser clínico e patológico. O estadiamento clínico é estabelecido a partir dos dados do exame físico e dos exames complementares. O estadiamento patológico baseia-se nos achados cirúrgicos e no exame anátomopatológico – é estabelecido após tratamento cirúrgico e determina a extensão da doença com maior precisão. Lembrando que o estadiamento patológico pode ou não coincidir com o estadiamento clínico e não é aplicável a todos os tumores.
E o estadiamento do câncer da TIREOIDE, como funciona?
Categorias T para o câncer de tiróide (exceto o câncer anaplásico de tireoide)
TX: O tumor primário não pode ser avaliado.
T0: Nenhuma evidência de tumor primário.
T1: O tumor é de 2 cm (um pouco menos de uma polegada) em toda ou menor e não cresceu fora da tireoide.
-
T1a: O tumor tem 1 cm de diâmetro ou menos e não cresceu fora da tireoide.
-
T1b: O tumor é maior do que 1 cm mas não maior do que 2 cm de diâmetro e não cresceu fora da tireoide.
T2: O tumor tem mais de 2 cm de diâmetro, mas não mais de 4 cm e não cresceu fora da tireoide.
T3: O tumor é maior que 4 cm de diâmetro, ou apenas começou a crescer em tecidos próximos fora da tireoide.
T4a: O tumor é de qualquer tamanho e cresceu extensivamente além da glândula tireoide em tecidos próximos do pescoço, como a laringe, traquéia, esôfago, ou o nervo para a laringe. Isso também é chamado de doença moderadamente avançada .
T4b: O tumor é de qualquer tamanho e cresceu de volta para a espinha ou em grandes vasos sanguíneos próximos. Isso também é chamado de doença muito avançada .
Categorias T para câncer de tireoide anaplásico
Todos os cânceres anaplásicos da tireoide são considerados tumores T4 no momento do diagnóstico.
T4a: O tumor ainda está dentro da tireoide.
T4b: O tumor cresceu fora da tireoide.
Categorias N para o câncer de tireoide
NX: Os gânglios linfáticos regionais (próximos) não podem ser avaliados.
N0: O câncer não se espalhou para os gânglios linfáticos próximos.
N1: O câncer se espalhou para os gânglios linfáticos próximos.
-
N1a: O câncer se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (chamados pré-traqueal , paratraqueal e gânglios linfáticos pré-laríngeos ).
-
N1b: O câncer se espalhou para outros gânglios linfáticos no pescoço (chamado cervical ) ou para os gânglios linfáticos atrás da garganta ( retrofaríngea ) ou no tórax superior ( mediastino superior ).
Categorias M para o câncer de tireoide
MX : A metástase distante não pode ser avaliada.
M0: Não há metástase distante.
M1: O câncer se espalhou para outras partes do corpo, como linfonodos distantes, órgãos internos, ossos, etc.
Agrupamento de estágios
Uma vez que os valores de T, N e M são determinados, eles são combinados em estágios, expressos como um número romano de I a IV. Às vezes as letras são usadas para dividir ainda mais uma fase. Ao contrário da maioria dos outros tipos, os cânceres de tireoide são agrupados em estádios de uma forma que também considera o subtipo de câncer e a idade do paciente.
Câncer de tireoide papilar ou folicular (diferenciado) em pacientes com idade inferior a 45 anos
As pessoas mais jovens têm uma baixa probabilidade de morrer de câncer de tireoide diferenciado (papilar ou folicular). Os agrupamentos de estádio TNM para estes cânceres têm em conta este fato. Assim, todas as pessoas com menos de 45 anos com esses cânceres são estágio I, se eles não têm propagação distante, e estágio II, se eles têm propagação distante.
Estágio I (Qualquer T, Qualquer N, M0): O tumor pode ser de qualquer tamanho (qualquer T) e pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
Estágio II (Qualquer T, Qualquer N, M1): O tumor pode ser de qualquer tamanho (qualquer T) e pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide papilar ou folicular (diferenciado) em pacientes com 45 anos ou mais
Estágio I (T1, N0, M0): O tumor tem 2 cm ou menos e não cresceu fora da tireoide (T1). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio II (T2, N0, M0): O tumor tem mais de 2 cm de diâmetro, mas não tem mais de 4 cm de diâmetro e não cresceu fora da tireoide (T2). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio III: Um dos seguintes se aplica:
T3, N0, M0: O tumor tem mais de 4 cm de diâmetro ou cresceu ligeiramente para fora da tireoide (T3), mas não se espalhou para nódulos linfáticos próximos (N0) ou locais distantes (M0).
T1 a T3, N1a, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da tireoide (T1 a T3). Ele se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (N1a), mas não para outros linfonodos ou para locais distantes (M0).
Estágio IVA: Uma das seguintes opções aplica-se:
T4a, qualquer N, M0: O tumor é de qualquer tamanho e cresceu para além da glândula tireoide e nos tecidos próximos do pescoço (T4a). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
T1 a T3, N1b, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da glândula tireoide (T1 a T3). Ele se espalhou para certos gânglios linfáticos no pescoço (nódulos cervicais) ou para os gânglios linfáticos no tórax superior (nódulos mediastinais superiores) ou atrás da garganta (nódulos retrofaríngeos) (N1b), mas não se espalhou para locais distantes (M0) .
Estágio IVB (T4b, Qualquer N, M0): O tumor tem qualquer tamanho e cresceu de volta para a espinha ou para grandes vasos sanguíneos próximos (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor é de qualquer tamanho e pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide medular
A idade não é um fator no estágio do câncer medular da tireoide.
Estágio I (T1, N0, M0): O tumor tem 2 cm ou menos e não cresceu fora da tireoide (T1). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio II: Uma das seguintes situações aplica-se:
T2, N0, M0: O tumor tem mais de 2 cm mas não tem mais de 4 cm de diâmetro e não cresceu fora da tireoide (T2). Não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
T3, N0, M0: O tumor é maior que 4 cm ou cresceu ligeiramente fora da tireoide (T3), mas não se espalhou para os nódulos linfáticos próximos (N0) ou locais distantes (M0).
Estágio III (T1 a T3, N1a, M0): O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da tireoide (T1 para T3). Ele se espalhou para os gânglios linfáticos ao redor da tireoide no pescoço (N1a), mas não para outros linfonodos ou para locais distantes (M0).
Estágio IVA: Uma das seguintes opções aplica-se:
T4a, qualquer N, M0: O tumor é de qualquer tamanho e cresceu para além da glândula da tireoide e nos tecidos próximos do pescoço (T4a). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Não se espalhou para locais distantes (M0).
T1 a T3, N1b, M0: O tumor é de qualquer tamanho e pode ter crescido ligeiramente fora da glândula tireoide (T1 a T3). Ele se espalhou para certos gânglios linfáticos no pescoço (nódulos cervicais) ou para os gânglios linfáticos no tórax superior (nódulos mediastinais superiores) ou atrás da garganta (nódulos retrofaríngeos) (N1b), mas não se espalhou para locais distantes (M0) .
Estágio IVB (T4b, Qualquer N, M0): O tumor tem qualquer tamanho e cresceu de volta para a espinha ou para grandes vasos sanguíneos próximos (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor é de qualquer tamanho e pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Câncer de tireoide anaplásico (indiferenciado)
Todos os cânceres de tireoide anaplásico são considerados estágio IV, refletindo o mau prognóstico deste tipo de câncer.
Estágio IVA (T4a, Qualquer N, M0): O tumor ainda está dentro da tireoide (T4a). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVB (T4b, Qualquer N, M0): O tumor cresceu fora da tiróide (T4b). Pode ou não ter se espalhado para os nódulos linfáticos próximos (qualquer N), mas não se espalhou para locais distantes (M0).
Estágio IVC (Qualquer T, Qualquer N, M1): O tumor pode ou não ter crescido fora da tireoide (qualquer T). Pode ou não ter se espalhado para os gânglios linfáticos próximos (qualquer N). Ele se espalhou para locais distantes (M1).
Recorrente do câncer de tireoide
Esta não é uma etapa real no sistema TNM. O câncer que retorna após o tratamento é chamado de recorrente (ou recaída ). Se o câncer de tireoide retorna, geralmente está no pescoço, mas pode voltar para outra parte do corpo (por exemplo, linfonodos, pulmões ou ossos). Os médicos podem atribuir uma nova fase com base em quão longe o câncer se espalhou, mas isso não é geralmente um processo tão formal como o estadiamento original. A presença de doença recorrente não altera o estadiamento formal original.
Se você tiver alguma dúvida sobre o estágio de seu câncer ou como ele afeta suas opções de tratamento, não se esqueça de perguntar ao seu médico.
Fonte: American Cancer Society
-
O Câncer de Vagina é um tipo raro de câncer que ocorre no sistema reprodutor feminino e, segundo estatísticas, atinge, geralmente, mulheres entre os 45 e 65 anos, ou mulheres que não mantêm relação sexual. . Na maior parte dos casos o câncer de vagina é de origem secundária, ou seja, proveniente de metástases de câncer em órgãos próximos, como o de colo de útero, ovários, endométrio ou até de intestino grosso. O Carcinoma Epidermoide, câncer na vagina causado pelas células da própria vagina, são apenas 1% de cânceres ginecológicos.
Alguns fatores podem aumentar o risco de câncer de vagina como:
- Idade
- Tabagismo
- Alcoolismo
- Adenose Vaginal
- HPV (Vírus do Papiloma Humano)
- HIV (Vírus da Imunodeficiência Humana) – Virus que causa a AIDS
- Câncer de Colo do Útero
- Irritação na vagina
- Não manter relações sexuais (já que alguns sintomas, como dor durante o sexo, por exemplo, podem não ser percebidos)
Grande parte das mulheres com câncer vaginal apresentam sintomas como:
- Corrimento vaginal anormal com cheiro;
- Sangramento vaginal anormal – fora do período menstrual;
- Dor durante as relações sexuais;
- Sangramento após a relação sexual;
- Ardência;
- Ulcerações (feridas) com infecção ou não;
- Urgência em urinar;
- Dor ou ardência ao urinar;
- Dor pélvica;
- Prisão de ventre;
- Massa palpável
Os principais exames para diagnosticar o câncer de vagina são o Papanicolau e a Colposcopia, que permite examinar a olho nu ou com o aparelho colposcópio lesões ou problemas possíveis. Lesões suspeitas poderão passar por biópsia para um diagnóstico mais preciso. Outros exames podem ser usados também como exames de imagem (Radiografia do Torax, Tomografia Computadorizada, Ressonância Magnética e PETscan).
O tratamento varia conforme o estagio da doença e danos causados, mas os principais métodos são:
- Cirurgia – para retirada dos tecidos comprometidos pela doença;
- Radioterapia;
- Quimioterapia
Em atualização.
O Câncer de Vagina é um tipo raro de câncer que ocorre no sistema reprodutor feminino e, segundo estatísticas, atinge, geralmente, mulheres entre os 45 e 65 anos, ou mulheres que não mantêm relação sexual. . Na maior parte dos casos o câncer de vagina é de origem secundária, ou seja, proveniente de metástases de câncer em órgãos próximos, como o de colo de útero, ovários, endométrio ou até de intestino grosso. O Carcinoma Epidermoide, câncer na vagina causado pelas células da própria vagina, são apenas 1% de cânceres ginecológicos.
Alguns fatores podem aumentar o risco de câncer de vagina como:
- Idade
- Tabagismo
- Alcoolismo
- Adenose Vaginal
- HPV (Vírus do Papiloma Humano)
- HIV (Vírus da Imunodeficiência Humana) – Virus que causa a AIDS
- Câncer de Colo do Útero
- Irritação na vagina
- Não manter relações sexuais (já que alguns sintomas, como dor durante o sexo, por exemplo, podem não ser percebidos)
Grande parte das mulheres com câncer vaginal apresentam sintomas como:
- Corrimento vaginal anormal com cheiro;
- Sangramento vaginal anormal – fora do período menstrual;
- Dor durante as relações sexuais;
- Sangramento após a relação sexual;
- Ardência;
- Ulcerações (feridas) com infecção ou não;
- Urgência em urinar;
- Dor ou ardência ao urinar;
- Dor pélvica;
- Prisão de ventre;
- Massa palpável
Os principais exames para diagnosticar o câncer de vagina são o Papanicolau e a Colposcopia, que permite examinar a olho nu ou com o aparelho colposcópio lesões ou problemas possíveis. Lesões suspeitas poderão passar por biópsia para um diagnóstico mais preciso. Outros exames podem ser usados também como exames de imagem (Radiografia do Torax, Tomografia Computadorizada, Ressonância Magnética e PETscan).
O tratamento varia conforme o estagio da doença e danos causados, mas os principais métodos são:
- Cirurgia – para retirada dos tecidos comprometidos pela doença;
- Radioterapia;
- Quimioterapia
Em atualização.
- O que é?
-
O Câncer de Vagina é um tipo raro de câncer que ocorre no sistema reprodutor feminino e, segundo estatísticas, atinge, geralmente, mulheres entre os 45 e 65 anos, ou mulheres que não mantêm relação sexual. . Na maior parte dos casos o câncer de vagina é de origem secundária, ou seja, proveniente de metástases de câncer em órgãos próximos, como o de colo de útero, ovários, endométrio ou até de intestino grosso. O Carcinoma Epidermoide, câncer na vagina causado pelas células da própria vagina, são apenas 1% de cânceres ginecológicos.
- Fatores de Risco
-
Alguns fatores podem aumentar o risco de câncer de vagina como:
- Idade
- Tabagismo
- Alcoolismo
- Adenose Vaginal
- HPV (Vírus do Papiloma Humano)
- HIV (Vírus da Imunodeficiência Humana) – Virus que causa a AIDS
- Câncer de Colo do Útero
- Irritação na vagina
- Não manter relações sexuais (já que alguns sintomas, como dor durante o sexo, por exemplo, podem não ser percebidos)
- Sintomas
-
Grande parte das mulheres com câncer vaginal apresentam sintomas como:
- Corrimento vaginal anormal com cheiro;
- Sangramento vaginal anormal – fora do período menstrual;
- Dor durante as relações sexuais;
- Sangramento após a relação sexual;
- Ardência;
- Ulcerações (feridas) com infecção ou não;
- Urgência em urinar;
- Dor ou ardência ao urinar;
- Dor pélvica;
- Prisão de ventre;
- Massa palpável
- Diagnóstico
-
Os principais exames para diagnosticar o câncer de vagina são o Papanicolau e a Colposcopia, que permite examinar a olho nu ou com o aparelho colposcópio lesões ou problemas possíveis. Lesões suspeitas poderão passar por biópsia para um diagnóstico mais preciso. Outros exames podem ser usados também como exames de imagem (Radiografia do Torax, Tomografia Computadorizada, Ressonância Magnética e PETscan).
- Tratamento
-
O tratamento varia conforme o estagio da doença e danos causados, mas os principais métodos são:
- Cirurgia – para retirada dos tecidos comprometidos pela doença;
- Radioterapia;
- Quimioterapia
- Estadiamento
-
Em atualização.
O câncer de vulva é um câncer raro, responsável por 0,5% de todos os cânceres nas mulheres e 5% dos tumores ginecológicos. O tipo mais comum deste câncer é o carcinoma espinocelular, um câncer de pele que surge como uma mancha ou ferida que não cicatriza e vai aumentando.
O câncer de vulva aparece com mais frequente em mulheres após a menopausa, porém alguns fatores podem favorecer o surgimento da doença em idades mais jovens.
Os principais fatores de risco do câncer de vulva são:
- Idade: mulheres com mais de 50 anos, sendo a incidência maior após os 70 anos;
- Irritação/inflamação vulvar crônica;
- Infecção pelo vírus HPV (Vírus do Papiloma Humano);
- Infecção pelo vírus HIV (Vírus da Imunodeficiência Humana);
- Tabagismo;
- Neoplasia intraepitelial de Vulva (displasia vulvar): lesão pré-maligna formada por células anormais na camada mais superficial da pele da vulva;
- Outros Cânceres Genitais como câncer de colo do útero;
- Melanoma ou Pintas Atípicas.
Os sintomas mais frequentes do câncer de Vulva são:
- Ferida que não cicatriza (sintoma mais frequente);
- Ardência;
- Coceira na região;
- Mancha ou caroço (que pode se transformar em ferida ou descamar);
- Mulheres infectadas com HPV;
- Inflamação e Irritação na vagina;
- Infecção na vagina;
- Sangramento;
- Nódulo ou ulceração;
- Áreas de pele com cor e textura alteradas.
O diagnóstico do câncer de vulva é feito por histórico clínico e exame físico, confirmado por meio de biópsia. Habitualmente a biópsia da vulva é um procedimento ambulatorial, realizado pelo médico com uso de anestesia local. Outros exames utilizados no diagnóstico são: exames de imagem (Ressonância Magnética, Tomografia Computadorizada, Petscan (tomografia por emissão de pósitrons) e Radiografia de Tórax) e Cistoscopia(que examina a parte superior da bexiga), Proctoscopia (examina o reto) e exame pélvico.
Os tumores em estágio inicial são tratados por cirurgia, onde tumor e os gânglios linfáticos inguinais – primeiro local para onde o câncer da vulva pode espalhar- são removidos. Já os tumores avançados podem ser tratados com quimioterapia e radioterapia, antes ou após da cirurgia.
Os tratamentos utilizados são:
- Cirurgias;
- Terapia com laser: destruição das células anormais utilizando um feixe de luz concentrada (laser) pode ser utilizada no tratamento das lesões pré-malignas (Neoplasia Intra-Epitelial Vulvar ou NIV);
- Vulvectomia simples: ressecção de toda a vulva;
- Vulvectomia radical: remoção da vulva com tecido normal ao redor e inclui esvaziamento dos gânglios linfáticos inguinais;
- Linfadenectomia: ressecção dos gânglios linfáticos;
- Radioterapia: utiliza feixes de radiação para destruir as células tumorais.
É preciso que o médico e o paciente estejam sempre atentos ao estadiamento da doença! Mas, o que é estadiamento? São os estágios que o câncer está no momento, ou seja, o tamanho, a localização e se espalhou para outros órgãos. O estádio de um tumor reflete não apenas a taxa de crescimento e a extensão da doença, mas também o tipo de tumor e sua relação com o hospedeiro. O sistema de estadiamento mais utilizado é o TNM da American Joint Committee on Cancer.
O que é TNM?
É a abreviatura de tumor, linfonodo e metástase. Este sistema utiliza três critérios para avaliar o estágio do câncer:
- O próprio tumor ( T + um número de 0 a 4 usa-se para descrever o tumor primário);
- Os linfonodos regionais ao redor do tumor ( N + 0 a 3 usa-se para descrever se a doença disseminou para os gânglios linfáticos)
- E se o tumor se espalhou para outras partes do corpo (M usa-se para descrever que a doença se espalhou para outros órgãos)
O estadiamento pode ser clínico e patológico. O estadiamento clínico é estabelecido a partir dos dados do exame físico e dos exames complementares. O estadiamento patológico baseia-se nos achados cirúrgicos e no exame anátomopatológico – é estabelecido após tratamento cirúrgico e determina a extensão da doença com maior precisão. Lembrando que o estadiamento patológico pode ou não coincidir com o estadiamento clínico e não é aplicável a todos os tumores.
E o estadiamento para Câncer de Vulva, como funciona?
O Estadiamento da Federação Internacional de Ginecologia e Obstetrícia (FIGO) adota como critérios o tamanho do tumor, invasão das estruturas perineais, comprometimento dos linfonodos e metástases à distância:
TNM
T – Tumor primário
TTis – Carcinoma pré-invasivo
T1 – Tumor confinado à vulva e/ou períneo com 2,0 cm ou menos na sua maior dimensão
T2 – Tumor confinado à vulva e/ou períneo com mais de 2,0 cm na sua maior dimensão
T3 – Tumor de qualquer tamanho com invasão da uretra e/ou ânus
T4 – Tumor de qualquer tamanho infiltrando a mucosa vesical e/ou retal, incluindo a porção superior da mucosa uretral e/ou ânus
N – Linfonodos regionais
N0 – Linfonodos não palpáveis
N1 – Linfonodos regionais unilaterais metastáticos
N2 – Linfonodos regionais bilaterais metastáticos
M – Metástase à distância
M0 – Ausência de metástases
Estadiamento cirúrgico do câncer vulvar:
O Tis Carcinoma in situ (Carcinoma pré-invasivo)
I
T1N0M0: Tumor confinado à vulva e/ou períneo maior diâmetro menor que 2,0 cm e linfonodos inguinais negativos
T1a Invasão estromal inferior a 1,0 mm inclusive
T1b Invasão estromal superior a 1,0 mm
II
T2N0M0: Tumor confinado a vulva e/ou períneo com maior diâmetro superior a 2,0 cm e linfonodos inguinais negativos
III
T1N1M0 / T2N1M0: Tumor de qualquer tamanho infiltrando a porção inferior da uretra e/ou vagina ou ânus e/ou metástase linfonodal regional unilateral
T3N0M0 / T3N1M0
IVA
T1N2M0: Tumor invade porção superior da uretra,mucosa vesical, mucosa retal, osso pélvico e/ou linfonodos regionais bilaterais
T2N2M0 / T3N2M0 / T4NqqM0
IVBT
qqNqqM1 : Metástases à distância, incluindo linfonodos pélvicos
Fonte: Associação Médica Brasileira e Agência Nacional de Saúde Suplementar
O câncer de vulva é um câncer raro, responsável por 0,5% de todos os cânceres nas mulheres e 5% dos tumores ginecológicos. O tipo mais comum deste câncer é o carcinoma espinocelular, um câncer de pele que surge como uma mancha ou ferida que não cicatriza e vai aumentando.
O câncer de vulva aparece com mais frequente em mulheres após a menopausa, porém alguns fatores podem favorecer o surgimento da doença em idades mais jovens.
Os principais fatores de risco do câncer de vulva são:
- Idade: mulheres com mais de 50 anos, sendo a incidência maior após os 70 anos;
- Irritação/inflamação vulvar crônica;
- Infecção pelo vírus HPV (Vírus do Papiloma Humano);
- Infecção pelo vírus HIV (Vírus da Imunodeficiência Humana);
- Tabagismo;
- Neoplasia intraepitelial de Vulva (displasia vulvar): lesão pré-maligna formada por células anormais na camada mais superficial da pele da vulva;
- Outros Cânceres Genitais como câncer de colo do útero;
- Melanoma ou Pintas Atípicas.
Os sintomas mais frequentes do câncer de Vulva são:
- Ferida que não cicatriza (sintoma mais frequente);
- Ardência;
- Coceira na região;
- Mancha ou caroço (que pode se transformar em ferida ou descamar);
- Mulheres infectadas com HPV;
- Inflamação e Irritação na vagina;
- Infecção na vagina;
- Sangramento;
- Nódulo ou ulceração;
- Áreas de pele com cor e textura alteradas.
O diagnóstico do câncer de vulva é feito por histórico clínico e exame físico, confirmado por meio de biópsia. Habitualmente a biópsia da vulva é um procedimento ambulatorial, realizado pelo médico com uso de anestesia local. Outros exames utilizados no diagnóstico são: exames de imagem (Ressonância Magnética, Tomografia Computadorizada, Petscan (tomografia por emissão de pósitrons) e Radiografia de Tórax) e Cistoscopia(que examina a parte superior da bexiga), Proctoscopia (examina o reto) e exame pélvico.
Os tumores em estágio inicial são tratados por cirurgia, onde tumor e os gânglios linfáticos inguinais – primeiro local para onde o câncer da vulva pode espalhar- são removidos. Já os tumores avançados podem ser tratados com quimioterapia e radioterapia, antes ou após da cirurgia.
Os tratamentos utilizados são:
- Cirurgias;
- Terapia com laser: destruição das células anormais utilizando um feixe de luz concentrada (laser) pode ser utilizada no tratamento das lesões pré-malignas (Neoplasia Intra-Epitelial Vulvar ou NIV);
- Vulvectomia simples: ressecção de toda a vulva;
- Vulvectomia radical: remoção da vulva com tecido normal ao redor e inclui esvaziamento dos gânglios linfáticos inguinais;
- Linfadenectomia: ressecção dos gânglios linfáticos;
- Radioterapia: utiliza feixes de radiação para destruir as células tumorais.
É preciso que o médico e o paciente estejam sempre atentos ao estadiamento da doença! Mas, o que é estadiamento? São os estágios que o câncer está no momento, ou seja, o tamanho, a localização e se espalhou para outros órgãos. O estádio de um tumor reflete não apenas a taxa de crescimento e a extensão da doença, mas também o tipo de tumor e sua relação com o hospedeiro. O sistema de estadiamento mais utilizado é o TNM da American Joint Committee on Cancer.
O que é TNM?
É a abreviatura de tumor, linfonodo e metástase. Este sistema utiliza três critérios para avaliar o estágio do câncer:
- O próprio tumor ( T + um número de 0 a 4 usa-se para descrever o tumor primário);
- Os linfonodos regionais ao redor do tumor ( N + 0 a 3 usa-se para descrever se a doença disseminou para os gânglios linfáticos)
- E se o tumor se espalhou para outras partes do corpo (M usa-se para descrever que a doença se espalhou para outros órgãos)
O estadiamento pode ser clínico e patológico. O estadiamento clínico é estabelecido a partir dos dados do exame físico e dos exames complementares. O estadiamento patológico baseia-se nos achados cirúrgicos e no exame anátomopatológico – é estabelecido após tratamento cirúrgico e determina a extensão da doença com maior precisão. Lembrando que o estadiamento patológico pode ou não coincidir com o estadiamento clínico e não é aplicável a todos os tumores.
E o estadiamento para Câncer de Vulva, como funciona?
O Estadiamento da Federação Internacional de Ginecologia e Obstetrícia (FIGO) adota como critérios o tamanho do tumor, invasão das estruturas perineais, comprometimento dos linfonodos e metástases à distância:
TNM
T – Tumor primário
TTis – Carcinoma pré-invasivo
T1 – Tumor confinado à vulva e/ou períneo com 2,0 cm ou menos na sua maior dimensão
T2 – Tumor confinado à vulva e/ou períneo com mais de 2,0 cm na sua maior dimensão
T3 – Tumor de qualquer tamanho com invasão da uretra e/ou ânus
T4 – Tumor de qualquer tamanho infiltrando a mucosa vesical e/ou retal, incluindo a porção superior da mucosa uretral e/ou ânus
N – Linfonodos regionais
N0 – Linfonodos não palpáveis
N1 – Linfonodos regionais unilaterais metastáticos
N2 – Linfonodos regionais bilaterais metastáticos
M – Metástase à distância
M0 – Ausência de metástases
Estadiamento cirúrgico do câncer vulvar:
O Tis Carcinoma in situ (Carcinoma pré-invasivo)
I
T1N0M0: Tumor confinado à vulva e/ou períneo maior diâmetro menor que 2,0 cm e linfonodos inguinais negativos
T1a Invasão estromal inferior a 1,0 mm inclusive
T1b Invasão estromal superior a 1,0 mm
II
T2N0M0: Tumor confinado a vulva e/ou períneo com maior diâmetro superior a 2,0 cm e linfonodos inguinais negativos
III
T1N1M0 / T2N1M0: Tumor de qualquer tamanho infiltrando a porção inferior da uretra e/ou vagina ou ânus e/ou metástase linfonodal regional unilateral
T3N0M0 / T3N1M0
IVA
T1N2M0: Tumor invade porção superior da uretra,mucosa vesical, mucosa retal, osso pélvico e/ou linfonodos regionais bilaterais
T2N2M0 / T3N2M0 / T4NqqM0
IVBT
qqNqqM1 : Metástases à distância, incluindo linfonodos pélvicos
Fonte: Associação Médica Brasileira e Agência Nacional de Saúde Suplementar
- O que é?
-
O câncer de vulva é um câncer raro, responsável por 0,5% de todos os cânceres nas mulheres e 5% dos tumores ginecológicos. O tipo mais comum deste câncer é o carcinoma espinocelular, um câncer de pele que surge como uma mancha ou ferida que não cicatriza e vai aumentando.
O câncer de vulva aparece com mais frequente em mulheres após a menopausa, porém alguns fatores podem favorecer o surgimento da doença em idades mais jovens. - Fatores de Risco
-
Os principais fatores de risco do câncer de vulva são:
- Idade: mulheres com mais de 50 anos, sendo a incidência maior após os 70 anos;
- Irritação/inflamação vulvar crônica;
- Infecção pelo vírus HPV (Vírus do Papiloma Humano);
- Infecção pelo vírus HIV (Vírus da Imunodeficiência Humana);
- Tabagismo;
- Neoplasia intraepitelial de Vulva (displasia vulvar): lesão pré-maligna formada por células anormais na camada mais superficial da pele da vulva;
- Outros Cânceres Genitais como câncer de colo do útero;
- Melanoma ou Pintas Atípicas.
- Sintomas
-
Os sintomas mais frequentes do câncer de Vulva são:
- Ferida que não cicatriza (sintoma mais frequente);
- Ardência;
- Coceira na região;
- Mancha ou caroço (que pode se transformar em ferida ou descamar);
- Mulheres infectadas com HPV;
- Inflamação e Irritação na vagina;
- Infecção na vagina;
- Sangramento;
- Nódulo ou ulceração;
- Áreas de pele com cor e textura alteradas.
- Diagnóstico
-
O diagnóstico do câncer de vulva é feito por histórico clínico e exame físico, confirmado por meio de biópsia. Habitualmente a biópsia da vulva é um procedimento ambulatorial, realizado pelo médico com uso de anestesia local. Outros exames utilizados no diagnóstico são: exames de imagem (Ressonância Magnética, Tomografia Computadorizada, Petscan (tomografia por emissão de pósitrons) e Radiografia de Tórax) e Cistoscopia(que examina a parte superior da bexiga), Proctoscopia (examina o reto) e exame pélvico.
- Tratamento
-
Os tumores em estágio inicial são tratados por cirurgia, onde tumor e os gânglios linfáticos inguinais – primeiro local para onde o câncer da vulva pode espalhar- são removidos. Já os tumores avançados podem ser tratados com quimioterapia e radioterapia, antes ou após da cirurgia.
Os tratamentos utilizados são:
- Cirurgias;
- Terapia com laser: destruição das células anormais utilizando um feixe de luz concentrada (laser) pode ser utilizada no tratamento das lesões pré-malignas (Neoplasia Intra-Epitelial Vulvar ou NIV);
- Vulvectomia simples: ressecção de toda a vulva;
- Vulvectomia radical: remoção da vulva com tecido normal ao redor e inclui esvaziamento dos gânglios linfáticos inguinais;
- Linfadenectomia: ressecção dos gânglios linfáticos;
- Radioterapia: utiliza feixes de radiação para destruir as células tumorais.
- Estadiamento
-
É preciso que o médico e o paciente estejam sempre atentos ao estadiamento da doença! Mas, o que é estadiamento? São os estágios que o câncer está no momento, ou seja, o tamanho, a localização e se espalhou para outros órgãos. O estádio de um tumor reflete não apenas a taxa de crescimento e a extensão da doença, mas também o tipo de tumor e sua relação com o hospedeiro. O sistema de estadiamento mais utilizado é o TNM da American Joint Committee on Cancer.
O que é TNM?
É a abreviatura de tumor, linfonodo e metástase. Este sistema utiliza três critérios para avaliar o estágio do câncer:
- O próprio tumor ( T + um número de 0 a 4 usa-se para descrever o tumor primário);
- Os linfonodos regionais ao redor do tumor ( N + 0 a 3 usa-se para descrever se a doença disseminou para os gânglios linfáticos)
- E se o tumor se espalhou para outras partes do corpo (M usa-se para descrever que a doença se espalhou para outros órgãos)
O estadiamento pode ser clínico e patológico. O estadiamento clínico é estabelecido a partir dos dados do exame físico e dos exames complementares. O estadiamento patológico baseia-se nos achados cirúrgicos e no exame anátomopatológico – é estabelecido após tratamento cirúrgico e determina a extensão da doença com maior precisão. Lembrando que o estadiamento patológico pode ou não coincidir com o estadiamento clínico e não é aplicável a todos os tumores.
E o estadiamento para Câncer de Vulva, como funciona?
O Estadiamento da Federação Internacional de Ginecologia e Obstetrícia (FIGO) adota como critérios o tamanho do tumor, invasão das estruturas perineais, comprometimento dos linfonodos e metástases à distância:
TNM
T – Tumor primário
TTis – Carcinoma pré-invasivo
T1 – Tumor confinado à vulva e/ou períneo com 2,0 cm ou menos na sua maior dimensão
T2 – Tumor confinado à vulva e/ou períneo com mais de 2,0 cm na sua maior dimensão
T3 – Tumor de qualquer tamanho com invasão da uretra e/ou ânus
T4 – Tumor de qualquer tamanho infiltrando a mucosa vesical e/ou retal, incluindo a porção superior da mucosa uretral e/ou ânus
N – Linfonodos regionais
N0 – Linfonodos não palpáveis
N1 – Linfonodos regionais unilaterais metastáticos
N2 – Linfonodos regionais bilaterais metastáticos
M – Metástase à distância
M0 – Ausência de metástases
Estadiamento cirúrgico do câncer vulvar:
O Tis Carcinoma in situ (Carcinoma pré-invasivo)
I
T1N0M0: Tumor confinado à vulva e/ou períneo maior diâmetro menor que 2,0 cm e linfonodos inguinais negativos
T1a Invasão estromal inferior a 1,0 mm inclusive
T1b Invasão estromal superior a 1,0 mm
II
T2N0M0: Tumor confinado a vulva e/ou períneo com maior diâmetro superior a 2,0 cm e linfonodos inguinais negativos
III
T1N1M0 / T2N1M0: Tumor de qualquer tamanho infiltrando a porção inferior da uretra e/ou vagina ou ânus e/ou metástase linfonodal regional unilateral
T3N0M0 / T3N1M0
IVA
T1N2M0: Tumor invade porção superior da uretra,mucosa vesical, mucosa retal, osso pélvico e/ou linfonodos regionais bilaterais
T2N2M0 / T3N2M0 / T4NqqM0
IVBT
qqNqqM1 : Metástases à distância, incluindo linfonodos pélvicos
Fonte: Associação Médica Brasileira e Agência Nacional de Saúde Suplementar
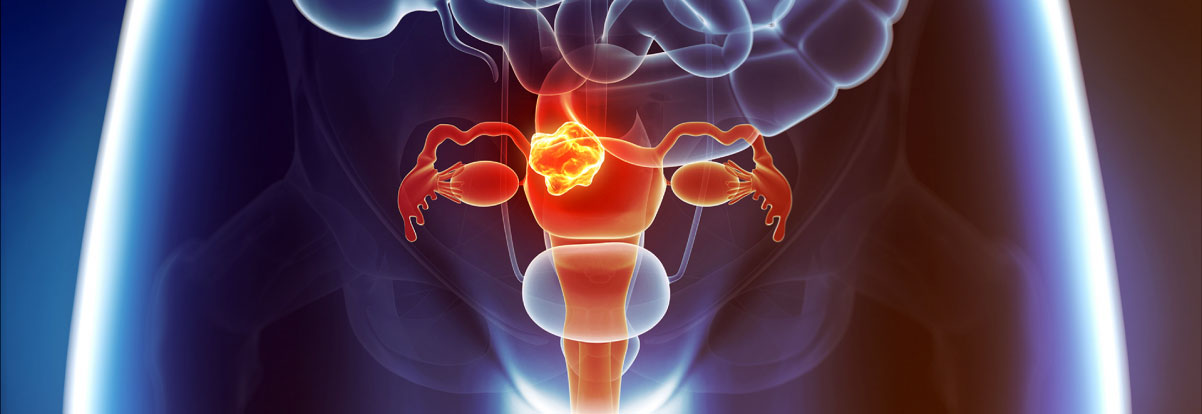
O Câncer de Colo de Útero é um tumor que ataca a área inferior do útero, chamada de colo ou cérvix. Os primeiros sintomas são verrugas na mucosa da vagina, do pênis, do ânus, da laringe e do esôfago. Esta é uma doença que demora anos para desenvolver, aproximadamente, de 10 a 20 anos.
Este é o segundo tipo de câncer feminino mais comum, perdendo apenas para o câncer de mama.Segundo o Instituto Nacional do Câncer – INCA, no Brasil, está em terceiro lugar, atrás do câncer de mama e intestino (colon e reto), com taxa de incidência de 15 novos casos em 100.000 mulheres ao ano. A mortalidade pode chegar a 5 casos em 100.000 ao ano. Geralmente, afeta mulheres entre 40 e 60 anos de idade.
A endometriose (outra doença muito comum as mulheres adultas) e a genética não possuem relação com o surgimento desse câncer. O Câncer de Colo de Útero pode evoluir para uma doença mais severa, o Carcinoma invasor do colo uterino (tumor maligno).
Alguns riscos possibilitam o aparecimento do Câncer de Colo do Útero:
- Sexo desprotegido com múltiplos parceiros
- Histórico de DSTs (HPV – Papiloma Vírus Humano)
- Tabagismo
- Idade precoce da primeira relação sexual
- Má higiene íntima
- Multiparidade (Várias gravidezes)
Por ser uma doença lenta, na maioria dos casos, quando os sintomas aparecem é sinal de que o câncer está em estágio avançado.
Os sintomas variam conforme a gravidade da doença:
- Corrimento persistente de coloração amarelada ou rosa e com forte odor;
- Hemorragia anormal;
- Desconforto ao urinar;
- Micção irregular;
- Ciclos menstruais irregulares;
- Sexo desconfortável (com dor);
- Dor na pelve;
- Dor nas costas;
O principal exame para prevenir e detectar o Câncer do colo de útero é o Papanicolau. Este exame faz parte dos exames de rotina da saúde da mulher e permite ao médico examinar visualmente o interior da vagina e o colo do útero. Com uma espátula de madeira e uma pequena escova especial o médico realiza a descamação do colo do útero a fim de recolher as células para a análise em laboratório. O Papanicolau pode ser complementado com Colposcopia com a realização de biópsia para se confirmar o diagnóstico.
Os tratamentos aplicados para o Câncer de colo do útero podem ser:
Cirurgia – Este procedimento consiste na retirada do tumor e, em algum casos, do útero e da parte superior da vagina também.
Radioterapia – O objetivo deste tratamento é reduzir o volume volume tumoral.
Quimioterapia – Este tratamento é indicado para tumores em estágios mais avançados.
O tipo de tratamento irá depender do estágio da doença, do tamanho do tumor e fatores pessoais, como idade e desejo de ter filhos.
Em atualização.
Mais informações acesse o site da International Myeloma Foundation Latin America – IMF Latin America ou ligue para ligue para 0800 777 0355 (IMF Latin America) e saiba tudo sobre essa doença!
O Câncer de Colo de Útero é um tumor que ataca a área inferior do útero, chamada de colo ou cérvix. Os primeiros sintomas são verrugas na mucosa da vagina, do pênis, do ânus, da laringe e do esôfago. Esta é uma doença que demora anos para desenvolver, aproximadamente, de 10 a 20 anos.
Este é o segundo tipo de câncer feminino mais comum, perdendo apenas para o câncer de mama.Segundo o Instituto Nacional do Câncer – INCA, no Brasil, está em terceiro lugar, atrás do câncer de mama e intestino (colon e reto), com taxa de incidência de 15 novos casos em 100.000 mulheres ao ano. A mortalidade pode chegar a 5 casos em 100.000 ao ano. Geralmente, afeta mulheres entre 40 e 60 anos de idade.
A endometriose (outra doença muito comum as mulheres adultas) e a genética não possuem relação com o surgimento desse câncer. O Câncer de Colo de Útero pode evoluir para uma doença mais severa, o Carcinoma invasor do colo uterino (tumor maligno).
Alguns riscos possibilitam o aparecimento do Câncer de Colo do Útero:
- Sexo desprotegido com múltiplos parceiros
- Histórico de DSTs (HPV – Papiloma Vírus Humano)
- Tabagismo
- Idade precoce da primeira relação sexual
- Má higiene íntima
- Multiparidade (Várias gravidezes)
Por ser uma doença lenta, na maioria dos casos, quando os sintomas aparecem é sinal de que o câncer está em estágio avançado.
Os sintomas variam conforme a gravidade da doença:
- Corrimento persistente de coloração amarelada ou rosa e com forte odor;
- Hemorragia anormal;
- Desconforto ao urinar;
- Micção irregular;
- Ciclos menstruais irregulares;
- Sexo desconfortável (com dor);
- Dor na pelve;
- Dor nas costas;
O principal exame para prevenir e detectar o Câncer do colo de útero é o Papanicolau. Este exame faz parte dos exames de rotina da saúde da mulher e permite ao médico examinar visualmente o interior da vagina e o colo do útero. Com uma espátula de madeira e uma pequena escova especial o médico realiza a descamação do colo do útero a fim de recolher as células para a análise em laboratório. O Papanicolau pode ser complementado com Colposcopia com a realização de biópsia para se confirmar o diagnóstico.
Os tratamentos aplicados para o Câncer de colo do útero podem ser:
Cirurgia – Este procedimento consiste na retirada do tumor e, em algum casos, do útero e da parte superior da vagina também.
Radioterapia – O objetivo deste tratamento é reduzir o volume volume tumoral.
Quimioterapia – Este tratamento é indicado para tumores em estágios mais avançados.
O tipo de tratamento irá depender do estágio da doença, do tamanho do tumor e fatores pessoais, como idade e desejo de ter filhos.
Em atualização.
- O que é?
-
O Câncer de Colo de Útero é um tumor que ataca a área inferior do útero, chamada de colo ou cérvix. Os primeiros sintomas são verrugas na mucosa da vagina, do pênis, do ânus, da laringe e do esôfago. Esta é uma doença que demora anos para desenvolver, aproximadamente, de 10 a 20 anos.
Este é o segundo tipo de câncer feminino mais comum, perdendo apenas para o câncer de mama.Segundo o Instituto Nacional do Câncer – INCA, no Brasil, está em terceiro lugar, atrás do câncer de mama e intestino (colon e reto), com taxa de incidência de 15 novos casos em 100.000 mulheres ao ano. A mortalidade pode chegar a 5 casos em 100.000 ao ano. Geralmente, afeta mulheres entre 40 e 60 anos de idade.
A endometriose (outra doença muito comum as mulheres adultas) e a genética não possuem relação com o surgimento desse câncer. O Câncer de Colo de Útero pode evoluir para uma doença mais severa, o Carcinoma invasor do colo uterino (tumor maligno).
- Fatores de Risco
-
Alguns riscos possibilitam o aparecimento do Câncer de Colo do Útero:
- Sexo desprotegido com múltiplos parceiros
- Histórico de DSTs (HPV – Papiloma Vírus Humano)
- Tabagismo
- Idade precoce da primeira relação sexual
- Má higiene íntima
- Multiparidade (Várias gravidezes)
- Sintomas
-
Por ser uma doença lenta, na maioria dos casos, quando os sintomas aparecem é sinal de que o câncer está em estágio avançado.
Os sintomas variam conforme a gravidade da doença:
- Corrimento persistente de coloração amarelada ou rosa e com forte odor;
- Hemorragia anormal;
- Desconforto ao urinar;
- Micção irregular;
- Ciclos menstruais irregulares;
- Sexo desconfortável (com dor);
- Dor na pelve;
- Dor nas costas;
- Diagnóstico
-
O principal exame para prevenir e detectar o Câncer do colo de útero é o Papanicolau. Este exame faz parte dos exames de rotina da saúde da mulher e permite ao médico examinar visualmente o interior da vagina e o colo do útero. Com uma espátula de madeira e uma pequena escova especial o médico realiza a descamação do colo do útero a fim de recolher as células para a análise em laboratório. O Papanicolau pode ser complementado com Colposcopia com a realização de biópsia para se confirmar o diagnóstico.
- Tratamento
-
Os tratamentos aplicados para o Câncer de colo do útero podem ser:
Cirurgia – Este procedimento consiste na retirada do tumor e, em algum casos, do útero e da parte superior da vagina também.
Radioterapia – O objetivo deste tratamento é reduzir o volume volume tumoral.
Quimioterapia – Este tratamento é indicado para tumores em estágios mais avançados.
O tipo de tratamento irá depender do estágio da doença, do tamanho do tumor e fatores pessoais, como idade e desejo de ter filhos.
- Estadiamento
-
Em atualização.
A leucemia é um câncer das primeiras células formadoras de sangue. Na maioria das vezes, a leucemia é um câncer dos glóbulos brancos do sangue, mas algumas leucemias começam em outros tipos de células do sangue. Existem vários tipos de leucemias, que são divididas principalmente com base em se a leucemia é aguda (crescimento rápido) ou crônica (crescimento mais lento) e se começa nas células mielóides ou células linfóides. Diferentes tipos de leucemia têm diferentes opções de tratamento e perspectivas.
Quais são os tipos de Leucemia?
Leucemia Linfoide Aguda (LLA)
A leucemia linfocide aguda (ou linfoblástica) às vezes é chamada de LLA. Começa na medula óssea, onde são feitas as células sanguíneas. É mais comum em crianças do que em adultos.
Leucemia Mieloide Aguda (LMA) em Adultos
A leucemia mieloide aguda (LMA) começa na medula óssea (a parte interna mole de certos ossos, onde novas células sanguíneas são feitas – as células-tronco). Às vezes, pode se espalhar para outras partes do corpo, incluindo os gânglios linfáticos, fígado, baço, sistema nervoso central (cérebro e medula espinhal) e testículos. A LMA se desenvolve a partir de células que se transformariam em glóbulos brancos (exceto linfócitos), mas às vezes a LMA se desenvolve em outros tipos de células formadoras de sangue. A leucemia mieloide aguda (LMA) tem muitos outros nomes, incluindo leucemia mielocítica aguda, leucemia mieloide aguda, leucemia granulocítica aguda e leucemia não linfocítica aguda.
Leucemia Linfoide Crônica (LLC)
É a leucemia mais comum em adultos. É um tipo de câncer que começa nas células que se transformam em certos glóbulos brancos (chamados linfócitos) na medula óssea. As células cancerosas (leucemia) começam na medula óssea, mas depois vão para o sangue. Na LLC, as células leucêmicas frequentemente se acumulam lentamente. Muitas pessoas não apresentam sintomas por pelo menos alguns anos. Mas, com o tempo, as células crescem e se espalham para outras partes do corpo, incluindo os gânglios linfáticos, fígado e baço.
Leucemia Mieloide Crônica (LMC)
Também conhecida como leucemia mielogênica crônica
É um tipo de câncer que começa em certas células formadoras de sangue da medula óssea. Na LMC, uma mudança genética ocorre em uma versão inicial (imatura) das células mieloides – as células que produzem glóbulos vermelhos, plaquetas e a maioria dos tipos de glóbulos brancos (exceto linfócitos). Essa mudança forma um gene anormal chamado BCR-ABL, que transforma a célula em uma célula LMC. As células leucêmicas crescem e se dividem, acumulando-se na medula óssea e transbordando para o sangue. Com o tempo, as células também podem se estabelecer em outras partes do corpo, incluindo o baço. LMC é uma leucemia de crescimento bastante lento, mas pode se transformar em uma leucemia aguda de crescimento rápido que é difícil de tratar. A LMC ocorre principalmente em adultos, mas muito raramente também ocorre em crianças. Em geral, o tratamento é igual ao dos adultos.
Leucemia Mielomonocítica Crônica (LMMC)
Começa nas células formadoras de sangue na medula óssea e invade o sangue. As células em quase qualquer parte do corpo podem se tornar câncer e podem se espalhar para outras áreas do corpo. Pessoas com LMMC podem ter falta de algumas células sanguíneas, mas o principal problema são os monócitos em excesso, um tipo de glóbulos brancos. (pelo menos 1.000 por mm3). Frequentemente, a contagem de monócitos é muito maior, fazendo com que sua contagem total de leucócitos também fique muito alta.Normalmente, existem algumas células anormais, chamadas blastos, na medula óssea. A quantidade de explosões na LMMC é inferior a 20%.Muitas pessoas com LMMC têm baços aumentados (um órgão que fica logo abaixo da caixa torácica esquerda).Cerca de 15% a 30% das pessoas com LMMC desenvolvem leucemia mieloide aguda (LMA)O DNA dentro das células anormais não tem certas mudanças nos genes chamados BCR / ABL (cromossomo Filadélfia), ou PDGFRA e PDGRFRB. Como a LMMC tem características tanto de síndrome mielodisplásica quanto de neoplasia mieloproliferativa, os especialistas criaram uma nova categoria para ela: neoplasia mielodisplásica / mieloproliferativa (mielo – medula óssea, proliferativa – crescimento excessivo, displásica – aparência anormal). A LMMC é a doença mais comum nesse grupo. Doenças muito menos comuns nesse grupo são a leucemia mieloide crônica atípica e a leucemia mielomonocítica juvenil (LMMJ). Todas essas doenças produzem muitas células sanguíneas anormais. A leucemia mieloide crônica é um exemplo de neoplasia mieloproliferativa em que há uma superprodução de glóbulos brancos do sangue.
Leucemia Infantojuvenil
As leucemias são cânceres que começam nas células que normalmente se desenvolveriam em diferentes tipos de células do sangue. Na maioria das vezes, a leucemia começa nas formas iniciais de glóbulos brancos, mas algumas leucemias começam em outros tipos de células sanguíneas. Existem diferentes tipos de leucemia, que se baseiam principalmente em:
Se a leucemia for aguda (crescimento rápido) ou crônica (crescimento mais lento).
Se a leucemia começar nas células mieloides ou linfoides.
Saber o tipo específico de leucemia que uma criança e/ou adolescente tem pode ajudar os médicos a prever melhor o prognóstico (perspectiva) de cada criança e selecionar o melhor tratamento.
Leucemias Agudas
A maioria das leucemias infantojuvenis são agudas. Essas leucemias podem progredir rapidamente e geralmente precisam ser tratadas imediatamente. Os principais tipos de leucemia aguda são:
Leucemia linfocítica (linfoblástica) aguda (LLA): cerca de 3 em cada 4 leucemias infantojuvenis são LLA. Essas leucemias começam nas primeiras formas de glóbulos brancos do sangue chamadas linfócitos.
Leucemia mieloide aguda (LMA): este tipo de leucemia, também chamada de ou leucemia não linfocítica aguda, é responsável pela maioria dos casos restantes de leucemia infantojuvenil. A LMA começa a partir das células mieloides que normalmente formam os glóbulos brancos (exceto linfócitos), glóbulos vermelhos ou plaquetas.
Raramente, as leucemias agudas podem apresentar características tanto de LLA quanto de LMA. Estas são chamadas de leucemias de linhagem mista, leucemias agudas indiferenciadas ou Leucemias Agudas de Fenótipo Misto.
Leucemia Crônica
As leucemias crônicas são raras em crianças e adolescentes. Essas leucemias tendem a crescer mais lentamente do que as leucemias agudas, mas também são mais difíceis de curar. As leucemias crônicas podem ser divididas em 2 tipos principais:
Leucemia mieloide crônica (LMC): também chamada de leucemia mieloide crônica, a LMA é rara em crianças e adolescentes. O tratamento é semelhante ao usado para adultos.
Leucemia linfocítica crônica (LLC): essa leucemia é extremamente rara em crianças e adolescentes.
Leucemia Mielomonocítica Juvenil (LMMJ)
Este tipo raro de leucemia não é crônica nem aguda. Começa nas células mieloides, mas geralmente não cresce tão rápido quanto a LMA ou tão lentamente quanto a LMC. Ocorre com mais frequência em crianças pequenas (idade média de 2 anos). Os sintomas podem incluir pele pálida, febre, tosse, hematomas ou sangramento fácil, dificuldade para respirar (devido a muitos glóbulos brancos nos pulmões), erupção cutânea e aumento do tamanho do baço, fígado e nódulos linfáticos.
Imagem: National Cancer Institute
Mais informações em breve.
Mais informações em breve.
Mais informações em breve.
Mais informações em breve.
Mais informações em breve.
Mais informações acesse o site da International Myeloma Foundation Latin America – IMF Latin America ou ligue para ligue para 0800 777 0355 (IMF Latin America) e saiba tudo sobre essa doença!
A leucemia é um câncer das primeiras células formadoras de sangue. Na maioria das vezes, a leucemia é um câncer dos glóbulos brancos do sangue, mas algumas leucemias começam em outros tipos de células do sangue. Existem vários tipos de leucemias, que são divididas principalmente com base em se a leucemia é aguda (crescimento rápido) ou crônica (crescimento mais lento) e se começa nas células mielóides ou células linfóides. Diferentes tipos de leucemia têm diferentes opções de tratamento e perspectivas.
Quais são os tipos de Leucemia?
Leucemia Linfoide Aguda (LLA)
A leucemia linfocide aguda (ou linfoblástica) às vezes é chamada de LLA. Começa na medula óssea, onde são feitas as células sanguíneas. É mais comum em crianças do que em adultos.
Leucemia Mieloide Aguda (LMA) em Adultos
A leucemia mieloide aguda (LMA) começa na medula óssea (a parte interna mole de certos ossos, onde novas células sanguíneas são feitas – as células-tronco). Às vezes, pode se espalhar para outras partes do corpo, incluindo os gânglios linfáticos, fígado, baço, sistema nervoso central (cérebro e medula espinhal) e testículos. A LMA se desenvolve a partir de células que se transformariam em glóbulos brancos (exceto linfócitos), mas às vezes a LMA se desenvolve em outros tipos de células formadoras de sangue. A leucemia mieloide aguda (LMA) tem muitos outros nomes, incluindo leucemia mielocítica aguda, leucemia mieloide aguda, leucemia granulocítica aguda e leucemia não linfocítica aguda.
Leucemia Linfoide Crônica (LLC)
É a leucemia mais comum em adultos. É um tipo de câncer que começa nas células que se transformam em certos glóbulos brancos (chamados linfócitos) na medula óssea. As células cancerosas (leucemia) começam na medula óssea, mas depois vão para o sangue. Na LLC, as células leucêmicas frequentemente se acumulam lentamente. Muitas pessoas não apresentam sintomas por pelo menos alguns anos. Mas, com o tempo, as células crescem e se espalham para outras partes do corpo, incluindo os gânglios linfáticos, fígado e baço.
Leucemia Mieloide Crônica (LMC)
Também conhecida como leucemia mielogênica crônica
É um tipo de câncer que começa em certas células formadoras de sangue da medula óssea. Na LMC, uma mudança genética ocorre em uma versão inicial (imatura) das células mieloides – as células que produzem glóbulos vermelhos, plaquetas e a maioria dos tipos de glóbulos brancos (exceto linfócitos). Essa mudança forma um gene anormal chamado BCR-ABL, que transforma a célula em uma célula LMC. As células leucêmicas crescem e se dividem, acumulando-se na medula óssea e transbordando para o sangue. Com o tempo, as células também podem se estabelecer em outras partes do corpo, incluindo o baço. LMC é uma leucemia de crescimento bastante lento, mas pode se transformar em uma leucemia aguda de crescimento rápido que é difícil de tratar. A LMC ocorre principalmente em adultos, mas muito raramente também ocorre em crianças. Em geral, o tratamento é igual ao dos adultos.
Leucemia Mielomonocítica Crônica (LMMC)
Começa nas células formadoras de sangue na medula óssea e invade o sangue. As células em quase qualquer parte do corpo podem se tornar câncer e podem se espalhar para outras áreas do corpo. Pessoas com LMMC podem ter falta de algumas células sanguíneas, mas o principal problema são os monócitos em excesso, um tipo de glóbulos brancos. (pelo menos 1.000 por mm3). Frequentemente, a contagem de monócitos é muito maior, fazendo com que sua contagem total de leucócitos também fique muito alta.Normalmente, existem algumas células anormais, chamadas blastos, na medula óssea. A quantidade de explosões na LMMC é inferior a 20%.Muitas pessoas com LMMC têm baços aumentados (um órgão que fica logo abaixo da caixa torácica esquerda).Cerca de 15% a 30% das pessoas com LMMC desenvolvem leucemia mieloide aguda (LMA)O DNA dentro das células anormais não tem certas mudanças nos genes chamados BCR / ABL (cromossomo Filadélfia), ou PDGFRA e PDGRFRB. Como a LMMC tem características tanto de síndrome mielodisplásica quanto de neoplasia mieloproliferativa, os especialistas criaram uma nova categoria para ela: neoplasia mielodisplásica / mieloproliferativa (mielo – medula óssea, proliferativa – crescimento excessivo, displásica – aparência anormal). A LMMC é a doença mais comum nesse grupo. Doenças muito menos comuns nesse grupo são a leucemia mieloide crônica atípica e a leucemia mielomonocítica juvenil (LMMJ). Todas essas doenças produzem muitas células sanguíneas anormais. A leucemia mieloide crônica é um exemplo de neoplasia mieloproliferativa em que há uma superprodução de glóbulos brancos do sangue.
Leucemia Infantojuvenil
As leucemias são cânceres que começam nas células que normalmente se desenvolveriam em diferentes tipos de células do sangue. Na maioria das vezes, a leucemia começa nas formas iniciais de glóbulos brancos, mas algumas leucemias começam em outros tipos de células sanguíneas. Existem diferentes tipos de leucemia, que se baseiam principalmente em:
Se a leucemia for aguda (crescimento rápido) ou crônica (crescimento mais lento).
Se a leucemia começar nas células mieloides ou linfoides.
Saber o tipo específico de leucemia que uma criança e/ou adolescente tem pode ajudar os médicos a prever melhor o prognóstico (perspectiva) de cada criança e selecionar o melhor tratamento.
Leucemias Agudas
A maioria das leucemias infantojuvenis são agudas. Essas leucemias podem progredir rapidamente e geralmente precisam ser tratadas imediatamente. Os principais tipos de leucemia aguda são:
Leucemia linfocítica (linfoblástica) aguda (LLA): cerca de 3 em cada 4 leucemias infantojuvenis são LLA. Essas leucemias começam nas primeiras formas de glóbulos brancos do sangue chamadas linfócitos.
Leucemia mieloide aguda (LMA): este tipo de leucemia, também chamada de ou leucemia não linfocítica aguda, é responsável pela maioria dos casos restantes de leucemia infantojuvenil. A LMA começa a partir das células mieloides que normalmente formam os glóbulos brancos (exceto linfócitos), glóbulos vermelhos ou plaquetas.
Raramente, as leucemias agudas podem apresentar características tanto de LLA quanto de LMA. Estas são chamadas de leucemias de linhagem mista, leucemias agudas indiferenciadas ou Leucemias Agudas de Fenótipo Misto.
Leucemia Crônica
As leucemias crônicas são raras em crianças e adolescentes. Essas leucemias tendem a crescer mais lentamente do que as leucemias agudas, mas também são mais difíceis de curar. As leucemias crônicas podem ser divididas em 2 tipos principais:
Leucemia mieloide crônica (LMC): também chamada de leucemia mieloide crônica, a LMA é rara em crianças e adolescentes. O tratamento é semelhante ao usado para adultos.
Leucemia linfocítica crônica (LLC): essa leucemia é extremamente rara em crianças e adolescentes.
Leucemia Mielomonocítica Juvenil (LMMJ)
Este tipo raro de leucemia não é crônica nem aguda. Começa nas células mieloides, mas geralmente não cresce tão rápido quanto a LMA ou tão lentamente quanto a LMC. Ocorre com mais frequência em crianças pequenas (idade média de 2 anos). Os sintomas podem incluir pele pálida, febre, tosse, hematomas ou sangramento fácil, dificuldade para respirar (devido a muitos glóbulos brancos nos pulmões), erupção cutânea e aumento do tamanho do baço, fígado e nódulos linfáticos.
Imagem: National Cancer Institute
Mais informações em breve.
Mais informações em breve.
Mais informações em breve.
Mais informações em breve.
Mais informações em breve.
- O que é?
-
A leucemia é um câncer das primeiras células formadoras de sangue. Na maioria das vezes, a leucemia é um câncer dos glóbulos brancos do sangue, mas algumas leucemias começam em outros tipos de células do sangue. Existem vários tipos de leucemias, que são divididas principalmente com base em se a leucemia é aguda (crescimento rápido) ou crônica (crescimento mais lento) e se começa nas células mielóides ou células linfóides. Diferentes tipos de leucemia têm diferentes opções de tratamento e perspectivas.
Quais são os tipos de Leucemia?
Leucemia Linfoide Aguda (LLA)
A leucemia linfocide aguda (ou linfoblástica) às vezes é chamada de LLA. Começa na medula óssea, onde são feitas as células sanguíneas. É mais comum em crianças do que em adultos.
Leucemia Mieloide Aguda (LMA) em Adultos
A leucemia mieloide aguda (LMA) começa na medula óssea (a parte interna mole de certos ossos, onde novas células sanguíneas são feitas – as células-tronco). Às vezes, pode se espalhar para outras partes do corpo, incluindo os gânglios linfáticos, fígado, baço, sistema nervoso central (cérebro e medula espinhal) e testículos. A LMA se desenvolve a partir de células que se transformariam em glóbulos brancos (exceto linfócitos), mas às vezes a LMA se desenvolve em outros tipos de células formadoras de sangue. A leucemia mieloide aguda (LMA) tem muitos outros nomes, incluindo leucemia mielocítica aguda, leucemia mieloide aguda, leucemia granulocítica aguda e leucemia não linfocítica aguda.
Leucemia Linfoide Crônica (LLC)
É a leucemia mais comum em adultos. É um tipo de câncer que começa nas células que se transformam em certos glóbulos brancos (chamados linfócitos) na medula óssea. As células cancerosas (leucemia) começam na medula óssea, mas depois vão para o sangue. Na LLC, as células leucêmicas frequentemente se acumulam lentamente. Muitas pessoas não apresentam sintomas por pelo menos alguns anos. Mas, com o tempo, as células crescem e se espalham para outras partes do corpo, incluindo os gânglios linfáticos, fígado e baço.
Leucemia Mieloide Crônica (LMC)
Também conhecida como leucemia mielogênica crônica
É um tipo de câncer que começa em certas células formadoras de sangue da medula óssea. Na LMC, uma mudança genética ocorre em uma versão inicial (imatura) das células mieloides – as células que produzem glóbulos vermelhos, plaquetas e a maioria dos tipos de glóbulos brancos (exceto linfócitos). Essa mudança forma um gene anormal chamado BCR-ABL, que transforma a célula em uma célula LMC. As células leucêmicas crescem e se dividem, acumulando-se na medula óssea e transbordando para o sangue. Com o tempo, as células também podem se estabelecer em outras partes do corpo, incluindo o baço. LMC é uma leucemia de crescimento bastante lento, mas pode se transformar em uma leucemia aguda de crescimento rápido que é difícil de tratar. A LMC ocorre principalmente em adultos, mas muito raramente também ocorre em crianças. Em geral, o tratamento é igual ao dos adultos.
Leucemia Mielomonocítica Crônica (LMMC)
Começa nas células formadoras de sangue na medula óssea e invade o sangue. As células em quase qualquer parte do corpo podem se tornar câncer e podem se espalhar para outras áreas do corpo. Pessoas com LMMC podem ter falta de algumas células sanguíneas, mas o principal problema são os monócitos em excesso, um tipo de glóbulos brancos. (pelo menos 1.000 por mm3). Frequentemente, a contagem de monócitos é muito maior, fazendo com que sua contagem total de leucócitos também fique muito alta.Normalmente, existem algumas células anormais, chamadas blastos, na medula óssea. A quantidade de explosões na LMMC é inferior a 20%.Muitas pessoas com LMMC têm baços aumentados (um órgão que fica logo abaixo da caixa torácica esquerda).Cerca de 15% a 30% das pessoas com LMMC desenvolvem leucemia mieloide aguda (LMA)O DNA dentro das células anormais não tem certas mudanças nos genes chamados BCR / ABL (cromossomo Filadélfia), ou PDGFRA e PDGRFRB. Como a LMMC tem características tanto de síndrome mielodisplásica quanto de neoplasia mieloproliferativa, os especialistas criaram uma nova categoria para ela: neoplasia mielodisplásica / mieloproliferativa (mielo – medula óssea, proliferativa – crescimento excessivo, displásica – aparência anormal). A LMMC é a doença mais comum nesse grupo. Doenças muito menos comuns nesse grupo são a leucemia mieloide crônica atípica e a leucemia mielomonocítica juvenil (LMMJ). Todas essas doenças produzem muitas células sanguíneas anormais. A leucemia mieloide crônica é um exemplo de neoplasia mieloproliferativa em que há uma superprodução de glóbulos brancos do sangue.
Leucemia Infantojuvenil
As leucemias são cânceres que começam nas células que normalmente se desenvolveriam em diferentes tipos de células do sangue. Na maioria das vezes, a leucemia começa nas formas iniciais de glóbulos brancos, mas algumas leucemias começam em outros tipos de células sanguíneas. Existem diferentes tipos de leucemia, que se baseiam principalmente em:
Se a leucemia for aguda (crescimento rápido) ou crônica (crescimento mais lento).
Se a leucemia começar nas células mieloides ou linfoides.
Saber o tipo específico de leucemia que uma criança e/ou adolescente tem pode ajudar os médicos a prever melhor o prognóstico (perspectiva) de cada criança e selecionar o melhor tratamento.
Leucemias Agudas
A maioria das leucemias infantojuvenis são agudas. Essas leucemias podem progredir rapidamente e geralmente precisam ser tratadas imediatamente. Os principais tipos de leucemia aguda são:
Leucemia linfocítica (linfoblástica) aguda (LLA): cerca de 3 em cada 4 leucemias infantojuvenis são LLA. Essas leucemias começam nas primeiras formas de glóbulos brancos do sangue chamadas linfócitos.
Leucemia mieloide aguda (LMA): este tipo de leucemia, também chamada de ou leucemia não linfocítica aguda, é responsável pela maioria dos casos restantes de leucemia infantojuvenil. A LMA começa a partir das células mieloides que normalmente formam os glóbulos brancos (exceto linfócitos), glóbulos vermelhos ou plaquetas.
Raramente, as leucemias agudas podem apresentar características tanto de LLA quanto de LMA. Estas são chamadas de leucemias de linhagem mista, leucemias agudas indiferenciadas ou Leucemias Agudas de Fenótipo Misto.
Leucemia Crônica
As leucemias crônicas são raras em crianças e adolescentes. Essas leucemias tendem a crescer mais lentamente do que as leucemias agudas, mas também são mais difíceis de curar. As leucemias crônicas podem ser divididas em 2 tipos principais:
Leucemia mieloide crônica (LMC): também chamada de leucemia mieloide crônica, a LMA é rara em crianças e adolescentes. O tratamento é semelhante ao usado para adultos.
Leucemia linfocítica crônica (LLC): essa leucemia é extremamente rara em crianças e adolescentes.
Leucemia Mielomonocítica Juvenil (LMMJ)
Este tipo raro de leucemia não é crônica nem aguda. Começa nas células mieloides, mas geralmente não cresce tão rápido quanto a LMA ou tão lentamente quanto a LMC. Ocorre com mais frequência em crianças pequenas (idade média de 2 anos). Os sintomas podem incluir pele pálida, febre, tosse, hematomas ou sangramento fácil, dificuldade para respirar (devido a muitos glóbulos brancos nos pulmões), erupção cutânea e aumento do tamanho do baço, fígado e nódulos linfáticos.
Imagem: National Cancer Institute
- Fatores de Risco
-
Mais informações em breve.
- Sintomas
-
Mais informações em breve.
- Diagnóstico
-
Mais informações em breve.
- Tratamento
-
Mais informações em breve.
- Estadiamento
-
Mais informações em breve.

O que você deve saber:
- O linfoma de Hodgkin é um tipo de câncer que afeta o sistema linfático;
- O linfoma de Hodgkin é uma das patologias com maiores chances de cura;
- Os hematologistas e oncologistas são especialistas que tratam pessoas que têm linfoma de Hodgkin ou outros tipos de câncer do sangue;
- O tratamento inclui radiação, quimioterapia ou ambos, dependendo dos fatores individuais do paciente.
O que você deve fazer:
- Converse com o seu médico sobre os seus exames e o significado dos resultados;
- Saiba o seu subtipo de linfoma de Hodgkin – subtipos diferentes têm tratamentos diferentes. Fique atento!
Como o Linfoma de Hodgkin se desenvolve?
O linfoma de Hodgkin começa quando uma célula branca (chamada linfócito) sofre uma alteração anormal que a torna uma célula do linfoma.
- As células do linfoma crescem e formam massas, geralmente nos linfonodos, localizados em todo o nosso corpo no sistema linfático;
- As células do linfoma também podem se reunir em outras áreas do corpo onde encontra-se o tecido linfoide;
- O linfoma de Hodgkin é diferenciado de outros tipos de linfoma pela presença de células Reed-Sternberg (que recebeu esse nome pelos cientistas que as identificaram primeiro). Outras células associadas à doença são chamadas de células de Hodgkin.
Se não tratado, as células cancerosas crescem para fora das células brancas normais, e o sistema imunológico não pode deter a infecção de maneira efetiva.
Subtipos do Linfoma de Hodgkin
A maioria das pessoas diagnosticadas com linfoma de Hodgkin tem um dos dois principais tipos da doença, chamados subtipos:
• Linfoma de Hodgkin clássico;
• Linfoma de Hodgkin com predominância linfocitária nodular.
Os subtipos foram classificados pela Organização Mundial de Saúde (OMS). É importante saber o seu subtipo, já que ele tem uma grande importância na determinação do tipo de tratamento que você receberá.
Linfoma de Hodgkin Clássico
Cerca de 95% das pessoas com linfoma de Hodgkin tem o subtipo clássico. O linfoma de Hodgkin clássico é ainda dividido em quatro subtipos:
1) Linfoma de Hodgkin esclerose nodular
- Constitui cerca de 60% de todos os casos de linfoma de Hodgkin;
- Mais comumente diagnosticado em adultos jovens com idade entre 15 e 34 anos;
- Altamente curável;
- Tem algumas anormalidades que podem persistir após o tratamento bem-sucedido, como a formação de pequenos pedaços de tecido cicatrizado inofensivo (fibrose residual).
2) Linfoma de Hodgkin de celularidade mista
- O segundo subtipo mais comum, que constitui 25% de todos os casos de linfoma de Hodgkin;
- Mais comumente diagnosticado em crianças com idade até 14 anos e adultos mais velhos com idade entre 55 e 74 anos;
- Comum em pessoas com transtornos do sistema imunológico, como o vírus da imunodeficiência humana (HIV);
- Um subtipo agressivo, porém altamente curável;
3) Linfoma de Hodgkin de depleção linfocitária
- Constitui cerca de 4% de todos os casos de linfoma de Hodgkin;
- Geralmente tem um panorama relativamente desfavorável quando comparado com outros subtipos de linfoma de Hodgkin;
- Algumas vezes tem o diagnóstico confundido com o linfoma não Hodgkin.
4) Linfoma de Hodgkin clássico rico em linfócitos
- Semelhante ao subtipo de predominância linfocítica nodular, porém tem mais características em comum com o linfoma de Hodgkin clássico.
Linfoma de Hodgkin de Predominância Linfocítica Nodular
O linfoma de Hodgkin de predominância linfocítica nodular (LHPLN) afeta cerca de 5% dos pacientes, em grande parte rapazes. O LHPLN é identificado por determinados fatores:
- As células do LHPLN são células “linfocíticas” e “histolíticas” – diferentes das células de Reed-Sternberg clássicas que sinalizam o linfoma de Hodgkin clássico;
- Os pacientes nem sempre têm sintomas;
- O LHPLN é de crescimento lento (indolente), e as chances de sobrevida de longo prazo são boas;
- Existe um risco de 3% de que o LHPLN se transformará em um linfoma não Hodgkin;
- O tratamento do LHPLN é geralmente diferente da terapia de primeira linha padrão para o linfoma de Hodgkin clássico.
Para a maioria das pessoas que têm linfoma de Hodgkin não existem fatores de risco que expliquem por que eles desenvolveram a doença. Os resultados de determinados estudos sobre as causas do linfoma de Hodgkin não são definitivos:
- Foram conduzidos muitos estudos sobre associações entre o linfoma de Hodgkin e exposições ambientais com resultados pouco claros;
- Embora o vírus de Epstein-Barr (EBV) tenha sido associado a quase metade dos casos de linfoma de Hodgkin, o EBV não foi estabelecido conclusivamente como uma causa;
- A maioria dos casos de linfoma de Hodgkin ocorre em pessoas que não têm fatores de risco identificáveis;
- A maioria das pessoas com fatores de risco identificáveis não desenvolve o linfoma de Hodgkin;
- Os pacientes que têm um histórico de um exame de sangue confirmando mononucleose têm um risco três vezes maior de LH em comparação à população geral;
- As pessoas infectadas com vírus linfocitotrópico de células T humanas (HTLV) ou o vírus da imunodeficiência humana (HIV) também têm probabilidade aumentada de desenvolver o LH;
- Os especialistas constataram que, ocasionalmente, irmãos de pessoas com linfoma de Hodgkin tendem a ter maiores taxas da doença do que as pessoas com irmãos e irmãs que não têm a doença. Embora a ligação não seja comum, os cientistas estão estudando por que o linfoma é mais comum em algumas famílias do que em outras.
O sinal inicial mais comum do linfoma de Hodgkin é o inchaço (aumento) indolor de um ou mais linfonodos. A maioria das pessoas apresenta linfonodos afetados na parte superior do corpo, geralmente no pescoço ou no tórax superior. Algumas vezes, você pode sentir o(s) linfonodo(s) afetado(s) na sua axila, na área do estômago ou na virilha.
Além dos linfonodos inchados, outros sinais e sintomas do linfoma de Hodgkin podem incluir:
- Febre sem uma causa evidente;
- Uma tosse persistente;
- Falta de ar durante a atividade normal;
- Sudorese excessiva, especialmente à noite;
- Cansaço ou falta de energia;
- Perda inexplicada de peso;
- Coceira;
- Dor no linfonodo após consumo de bebida alcoólica;
- Baço com tamanho aumentado.
Alguns sintomas do linfoma de Hodgkin estão associados às outras doenças menos sérias. No entanto, se estiver incomodado com algum dos sintomas acima, não hesite em procurar o seu médico.
Testes Diagnósticos
Exames de Imagem:
O seu médico pode pedir exames de imagem se o seu histórico médico e exame físico sugerirem um diagnóstico possível de linfoma de Hodgkin. O seu médico procura por:
- Linfonodos aumentados no tórax ou abdômen ou em ambos;
- Massas tumorais fora dos linfonodos no pulmão, nos ossos ou em outro tecido corporal.
Os exames de imagem podem incluir:
- Uma radiografia do tórax;
- Uma varredura de tomografia computadorizada (TC) do tórax, pelve e abdômen (área do estômago);
- Uma varredura por imagem de ressonância magnética (IRM);
- Uma varredura por tomografia de emissão de pósitrons (PET) ;
- Uma varredura PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo.
Biópsia do Linfonodo:
O diagnóstico do linfoma de Hodgkin geralmente envolve a realização de uma biópsia de linfonodo. Se a biópsia confirmar que você tem a doença, o seu médico realiza testes adicionais para estadiar o linfoma. A finalidade da biópsia do linfonodo é confirmar um diagnósticom, além de identificar o subtipo do seu linfoma de Hodgkin para desenvolver um plano de tratamento.
Exames Laboratoriais para Confirmar um Diagnóstico
Um hematopatologista examina a amostra do seu linfonodo sob um microscópico para procurar identificar as características do linfoma de Hodgkin. Um hematopatologista é um especialista que estuda as doenças de células sanguíneas ao analisar as amostras de sangue e células da medula e outros tecidos.
O hematopatologista pode usar um exame laboratorial chamado imunofenotipagem para analisar a presença de células de Reed-Sternberg e as células de Hodgkin para diferenciar o linfoma de Hodgkin de outros tipos de linfoma e outras condições não cancerosas.
O linfoma de Hodgkin pode ser uma doença de difícil diagnóstico. Você pode querer uma segunda opinião médica por um hematopatologista experiente antes de começar o tratamento. O linfoma de Hodgkin pode ser confundido com alguns tipos de linfoma não Hodgkin. O tratamento apropriado depende de ter o diagnóstico correto.
Testes de Estadiamento
Assim que o seu oncologista hematologista confirmar o diagnóstico do linfoma de Hodgkin, ele irá pedir mais testes para estadiar a sua doença. O estadiamento identifica a extensão da sua doença e onde ela está localizada no seu corpo.
Os testes de estadiamento incluem:
- Exames de sangue;
- Exames da medula óssea;
- Exames de imagem.
Exames de Sangue
Após coletar o seu sangue, ele é enviado a um laboratório para um hemograma completo (CBC) e exames adicionais. O seu sangue é dosado para:
- Níveis de células vermelhas (eritrócitos), células brancas (leucócitos) e plaquetas;
- Níveis séricos de proteína;
- Níveis de ácido úrico;
- Velocidade de hemossedimentação (a velocidade para as células vermelhas se depositarem no fundo de um tubo de ensaio – uma velocidade aumentada pode indicar câncer);
- Função hepática.
Exames da Medula Óssea
O seu médico pode decidir examinar a sua medula óssea para ver se a doença se espalhou. Se a sua doença está em um estágio inicial e alguns sinais e sintomas não apareceram, você pode não precisar fazer o teste.
O teste de medula óssea envolve duas etapas geralmente feitas ao mesmo tempo em um consultório médico ou em um hospital:
- Uma aspiração da medula óssea para remover uma amostra líquida da medula;
- Uma biópsia da medula óssea para remover uma pequena quantidade de osso preenchido com medula;
Exames de Imagem
O seu médico conduz um ou mais exames de imagem, juntamente com um exame físico, para verificar:
- A localização e distribuição dos linfonodos aumentados;
- O efeito da doença, se houver, em outros órgãos, como os pulmões e o fígado;
- Massas tumorais grandes.
Os exames de imagem podem incluir:
- Uma radiografia de tórax;
- Uma varredura de tomografia computadorizada (TC) do tórax, pelve e abdômen (área do estômago);
- Uma varredura por imagem de ressonância magnética (IRM);
- Uma varredura de tomografia de emissão de pósitrons (PET);
- Uma varredura PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo (F-18).
É importante que o seu médico seja experiente no tratamento de pacientes com linfoma de Hodgkin ou trabalhe em consulta com um especialista em linfoma de Hodgkin. Este tipo de especialista é chamado oncologista hematologista.
Para muitas pessoas com linfoma de Hodgkin, iniciar o tratamento os auxilia a focar e seguir em frente buscando a recuperação. Um olhar sobre a taxa de sucesso do tratamento pode ser encorajador: Mais de 75 % de todos os pacientes podem ser curados. A taxa aumenta para 90% para pacientes mais jovens. O linfoma de Hodgkin é considerado uma das formas mais curáveis de câncer.
Tipos de Tratamento
Os médicos usam diversos tipos de abordagens e combinações de tratamento para adultos e crianças com linfoma de Hodgkin, alguns em estágios diferentes:
- Quimioterapia e farmacoterapia;
- Radioterapia de campo envolvido;
- Transplante de células tronco;
- O seu médico pode sugerir que você participe de um estudo clínico. Estudos clínicos podem envolver a terapia com novos medicamentos e novas combinações de medicamentos ou novas abordagens para o transplante de células tronco.
Considerações Pré-Tratamento
Adultos em idade fértil e pais de crianças diagnosticadas com LH devem pedir aos seus médicos informações sobre o possível risco de infertilidade.
Encontrando a Melhor Abordagem de Tratamento:
O objetivo do tratamento para o linfoma de Hodgkin é curar a doença.
O tratamento que o seu médico recomendar é baseado em diversos fatores, incluindo:
- O subtipo da sua doença;
- O estágio e categoria da sua doença;
- Se a sua doença é recidiva ou refratária;
- A sua saúde geral e se você tem alguma condição, como doença cardíaca, doença renal, doença pulmonar, diabetes ou anemia;
- Se você está grávida.
Quando desenvolver um plano de tratamento com o seu médico, assegure-se de discutir:
- Os resultados que você pode esperar com o tratamento;
- Possíveis efeitos colaterais, incluindo efeitos de longo prazo e efeitos tardios;
- A possibilidade de participar de um estudo clínico, onde você terá acesso ao tratamento médico avançado que pode ser mais benéfico a você do que o tratamento padrão.
Você pode achar útil levar alguém próximo a você as suas visitas com o seu médico para apoio, para tomar notas e fazer perguntas de acompanhamento. Uma sugestão é preparar as perguntas que gostaria de fazer quando visitar o seu médico. Você também pode registrar as suas conversas e ouvir com mais atenção ao chegar em casa.
Outras Considerações de Tratamento:
- Se tiver 60 ou mais anos, o seu tratamento pode variar das abordagens padrão. Por exemplo, o seu corpo pode não ser capaz de tolerar os medicamentos quimioterápicos tóxicos ou você pode ter outras enfermidades que são mais comuns à medida que envelhecemos. Esses fatores, entre outros, podem tornar mais complicada a escolha do tratamento;
- Se o seu filho está sendo tratado para linfoma de Hodgkin, a terapia pode diferir ligeiramente daquela para um adulto comum. Vide Linfoma de Hodgkin Infantil.
QUIMIOTERAPIA E TERAPIA FARMACOLÓGICA
Durante a quimioterapia, você recebe medicamentos potentes que devem ser tóxicos o suficiente para danificar ou matar as células do linfoma. Ao mesmo tempo, eles podem afetar as células normais e causar efeitos colaterais.
Os médicos combinam comumente quatro ou mais medicamentos quimioterápicos para tratar o linfoma de Hodgkin. Os medicamentos são normalmente administrados por um cateter (um tubo fino e flexível ou linha intravenosa) cirurgicamente colocada em uma veia, normalmente no seu tórax superior.
Medicamentos Quimioterápicos usados para o Linfoma de Hodgkin:
Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. Combinar tipos de medicamentos pode aumentar a sua efetividade. As combinações têm geralmente o nome das abreviações para a primeira letra usada na mistura. As combinações mais comuns e efetivas usadas incluem:
- ABVD: doxorrubicina (Adriamycin®), bleomicina (Blenoxane®), vinblastina (Cytoxan®), dacarbazina (DTIC-Dome®);
- BEACOPP: Blenoxano, etoposida (Etopophos®, Toposar®, VePesid®, VP-16), Adriamicina, ciclofosfamida (Cytoxan®), vincristina (Oncovin®), procarbazina (Matulane®), prednisona;
- Stanford V: mecloretamina (Mustargen®), Adriamicina, Cytoxan, Oncovin, Blenoxano, etoposida, prednisone.
ABVD é usado para os estágios I e II do linfoma de Hodgkin (combinado com a radioterapia de campo envolvido) e para os estágios III e IV (por um período de tempo mais longo). ABVD é a primeira escolha de tratamento para a maioria dos pacientes adultos devido a sua efetividade e reputação para produzir efeitos colaterais menos tóxicos do que aqueles de outras combinações de medicamentos, que têm um maior risco de infertilidade ou leucemia. A taxa de cura para os estágios I e II é de mais de 95%.
Os pacientes nos estágios I e II geralmente recebem até dois ciclos de ABVD, com várias semanas de intervalo, seguido por radioterapia de campo envolvido com uma dose reduzida de radiação. Se eles estiverem em alto risco, eles geralmente são submetidos a quatro a seis ciclos antes da radiação. O tratamento pode durar de seis a oito meses.
Os pacientes nos estágios III e IV são tratados com seis a oito cursos da terapia de combinação, como ABVD ou BEACOPP. BEACOPP possui uma boa taxa de cura, porém tem um risco pequeno de leucemia ou de um segundo câncer, o que o faz um tratamento menos comum nos Estados Unidos e no Canadá. Os médicos podem usar BEACOPP para o linfoma de Hodgkin agressivo e avançado.
Stanford V é outra combinação de medicamentos que os médicos usam com ou sem a radioterapia para a doença avançada. Ela é administrada por um tempo mais curto, porém mais frequente do que ABVD.
RADIOTERAPIA DE CAMPO ENVOLVIDO
Uma combinação de radioterapia e quimioterapia provou ser uma abordagem efetiva de duas vertentes para tratar os estágios I e II do linfoma de Hodgkin. Os pacientes que têm doença mais disseminada (estágios III e IV e categoria B) são geralmente tratados com a quimioterapia isolada.
A radioterapia de campo envolvido com a quimioterapia – também conhecida como terapia de modalidade combinada – envolve duas principais etapas realizadas em momentos separados, geralmente em um centro ambulatorial de clínica oncológica:
1 Medicamentos quimioterápicos são administrados para matar as células vizinhas do linfoma;
2 Radiação é aplicada por raios de alta energia para encolher massas de células do linfoma.
Você pode precisar permanecer no hospital por um período curto durante o tratamento se a sua terapia for particularmente intensiva e levar à infecção ou decréscimos prolongados ou graves nos hemogramas.
Durante a radioterapia de campo envolvido, você recebe radiação somente nas áreas do seu corpo afetadas pelo linfoma de Hodgkin. Uma máquina chamada acelerador linear, ou linac, aplica feixe de radiação a área(s) alvo(s) do seu corpo enquanto você está deitado em uma mesa móvel. Partes do seu corpo não afetadas pelo linfoma de Hodgkin, como os órgãos reprodutores, são protegidos para ajudar a reduzir os efeitos colaterais do tratamento. O procedimento em si é indolor, embora algumas pessoas possam sentir desconforto ao permanecer na mesma posição por vários minutos durante a sessão. Vários dias depois, a sua radioterapia é seguida pela quimioterapia.
Tratamento do Hodgkin com Predominância Linfocítica Nodular:
Uma exceção ao uso do tratamento combinado de primeira linha da radioterapia e da quimioterapia é o tratamento para o subtipo do linfoma e Hodgkin de predominância linfocítica nodular (LHPLN). No seu lugar, a radioterapia é usada de maneira isolada e não combinada com a quimioterapia. O LHPLN é uma forma de crescimento lento da doença que é geralmente diagnosticada durante o estágio I, resultando em uma taxa de sobrevida próxima a 100%. Portanto, é importante não tratar demasiadamente a doença.
TRANSPLANTE DE CÉLULAS TRONCO
O transplante de células tronco não é recomendado para o tratamento inicial de pacientes que têm linfoma de Hodgkin, porém pode ser usado para tratar pacientes na primeira recidiva. Podem ser usados dois tipos de transplante de células tronco:
- Transplante autólogo de células tronco, que usa as suas próprias células tronco.
- Transplante alogênico de células tronco, que usa as células tronco de um doador compatível. O transplante autólogo apresenta menos risco aos pacientes do que o transplante alogênico.
A efetividade das terapias para pacientes recém-diagnosticados tem reduzido a necessidade para o transplante de células tronco. No entanto, o transplante autólogo de células tronco pode curar alguns pacientes, cujo linfoma de Hodgkin retornou após um período sem sinal da doença. Os pesquisadores estão estudando em estudos clínicos o transplante alogênico de células tronco padrão e de intensidade reduzida para tratar alguns pacientes com linfoma de Hodgkin que têm um doador compatível. Para tratar ou curar o seu câncer do sangue, o seu médico pode sugerir doses muito altas de quimioterapia e um transplante autólogo de células tronco usando as suas próprias células tronco.
TRANSPLANTE AUTÓLOGO DE CÉLULAS TRONCO
Como Ele Funciona?
A sua medula é coletada enquanto você está em remissão. Você deve primeiro ser submetido a terapia condicionante na forma de quimioterapia ou radioterapia de alta intensidade para controlar a doença e reduzir o número de células com câncer na sua medula e sangue. As suas próprias células tronco são “coletadas”, ou recuperadas, do seu corpo e congeladas. Após receber a quimioterapia ou radioterapia intensiva, as suas células são devolvidas ao seu corpo por infusão através de uma veia.
O objetivo de um transplante autólogo de células tronco é restaurar a capacidade do corpo de produzir células sanguíneas normais após a quimioterapia ou radioterapia de alta dose. Diferente do transplante alogênico de células tronco este procedimento:
- Não oferece os benefícios do efeito enxerto versus tumor (GVL) quando as células sadias do doador atacam as células cancerosas;
- Não tem o risco da doença do enxerto versus hospedeiro.
O transplante autólogo de células tronco pode causar alguns efeitos adversos, em grande parte da terapia condicionante de alta intensidade:
- Decréscimo acentuado no hemograma pode levar a infecção e necessidade de transfusões de células vermelhas (para tratar a anemia) e plaquetas (para prevenir ou tratar a hemorragia);
- Alguns medicamentos condicionantes podem causar complicações, como pneumonia intersticial, como resultado da infecção ou dano da terapia intensive;
- Úlceras orais dolorosas (mucosite oral) podem se desenvolver que, em casos raros, podem impedir que você coma ou beba. O fator de crescimento de células cutâneas, palifermina (Kepivance®), e outras medidas podem prevenir ou reduzir os efeitos da mucosite oral.
TRANSPLANTE ALOGÊNICO DE CÉLULAS TRONCO
O transplante alogênico de células tronco envolve a transferência de células tronco de uma pessoa sadia (o doador) para o seu corpo após a quimioterapia ou radioterapia de alta intensidade.
O transplante alogênico de células tronco é usado para curar alguns pacientes que:
- Estão em alto risco de recidiva;
- Não respondem completamente ao tratamento;
- Recidiva após tratamento prévio bem sucedido.
O transplante alogênico de células tronco pode ser um procedimento de alto risco. Os regimes de alto condicionamento são destinados para comprometer severamente ou completamente a sua capacidade de produzir células tronco e você provavelmente apresentará efeitos colaterais durante os dias que receber a radioterapia ou quimioterapia condicionante de alta dose. Os objetivos da terapia de alto condicionamento são:
- Tratar de maneira intensiva as células cancerosas restantes, tornando assim a recorrência do câncer menos provável;
- Inativar o sistema imunológico para reduzir as chances de rejeição do enxerto de células tronco;
- Permitir que as células do doador cheguem até a medula (enxerto), produzam células sanguíneas e proporcionem o efeito enxerto versus tumor.
Possíveis Efeitos Adversos
O sistema imunológico e o sistema sanguíneo são proximamente ligados e não podem ser separados um do outro. Por causa disso, o transplante alogênico permite que não apenas o sistema sanguíneo do doador, mas também o seu sistema imunológico, sejam transferidos. Consequentemente, são possíveis os seguintes efeitos adversos:
- Rejeição imunológica pelo receptor das células tronco doadas (efeito hospedeiro versus enxerto);
- Reação imunológica pelas células doadoras contra os tecidos do receptor (doença do enxerto versus hospedeiro [GVHD]).
A reação imunológica, ou GVHD, é tratada com a administração de medicamentos ao paciente após o transplante que reduzem a capacidade das células imunológicas doadas de atacar e lesionar os tecidos do paciente. Vide Doença do Enxerto Versus Hospedeiro. Os transplantes alogênicos de células tronco para pacientes que têm mais idade ou têm saúde geral debilitada são relativamente incomuns. Isto porque a terapia condicionante no pré-transplante é geralmente não bem tolerada por esses pacientes, especialmente aqueles com funcionamento inadequado dos órgãos internos. No entanto, transplantes alogênicos de células tronco de intensidade reduzida podem ser um tratamento apropriado para alguns pacientes mais velhos ou mais enfermos.
Depleção de Linfócitos T
Um objetivo do transplante alogênico de células tronco é fazer com que os linfócitos T no sangue ou medula do doador se estabeleçam (enxertam) e cresçam na medula do paciente. Às vezes, os linfócitos T atacam as células cancerosas. Quando isto acontece, é chamado de efeito enxerto versus tumor (GVT) (também chamado efeito enxerto versus câncer). O ataque torna menos provável que a doença retorne. Este efeito é mais comum em leucemias mieloides do que é em outros cânceres de sangue.
Infelizmente, os linfócitos T são as mesmas células que causam a doença do enxerto versus hospedeiro (GVHD). Devido a este efeito colateral sério e, algumas vezes, de risco à vida, os médicos, em determinados casos, querem reduzir o número de linfócitos T a serem infundidos com as células de tronco. Este procedimento, chamado depleção de linfócitos T, está sendo atualmente estudado pelos pesquisadores. A técnica envolve tratar as células tronco coletadas para transplante com agentes que reduzem o número de linfócitos T. O objetivo da depleção de linfócitos T é reduzir a incidência e a gravidade da GVHD. No entanto, ela também pode causar o aumento nas taxas de rejeição ao enxerto, reduzir o efeito do GVT e a uma recuperação imunológica mais lenta. Os médicos devem ser cuidadosos sobre o número de linfócitos T removidos ao utilizar esta técnica.
Seleção das Células Tronco:
A seleção das células tronco é outra técnica que está sendo estudada em estudos clínicos que pode reduzir o número de linfócitos T que um paciente recebe. Devido às características específicas da camada externa das células tronco, os médicos podem remover seletivamente as células tronco de uma mistura celular. Esta técnica produz um grande número de células tronco e menor de outras células, incluindo linfócitos T.
Encontrando um Doador:
Se estiver considerando o transplante alogênico de células tronco, você precisará de um doador de medula óssea. Em primeiro lugar, você e seus irmãos, se houver, terão o sangue ou uma raspagem do lado de dentro da bochecha testados para determinar o tipo de tecido. Um irmão tem o potencial de ser o mais proximamente compatível com você, pois vocês dois receberam genes dos mesmos pais.
Um técnico de laboratório examina a superfície das células do tecido da amostra para identificar as proteínas que proporcionam a todos o seu próprio tipo de tecido, chamado antígenos leucocitários humanos (HLAs). Se o HLA das células do doador for idêntico (de gêmeos idênticos, por exemplo) ou semelhantes (como aqueles de irmãos), é muito provável que o transplante seja bem-sucedido. Em média, você tem uma entre quatro chances de ter o mesmo tipo HLA de um irmão. Muitos pacientes, no entanto, não têm um irmão com o mesmo tipo de tecido.
Se um irmão ou irmã não for um doador compatível, o seu médico fará uma busca nos registros de doadores voluntários, como no Programa Nacional de Doadores de Medula, por um doador sem parentesco que seja compatível com o seu tipo de tecido. Um doador que não tem parentesco com você, mas que tem um tipo de tecido semelhante é chamado doador compatível não relacionado (MUD).
Coletando Células Tronco
As células tronco para transplante são coletadas de três fontes:
- Sangue;
- Medula óssea;
- Sangue da placenta e do cordão umbilical.
Antes das células tronco serem coletadas do sangue ou da medula óssea, o doador deve passar por um exame físico completo e exames de sangue para vírus da hepatite, doença da imunodeficiência humana (HIV) e outros agentes ou vírus infecciosos.
Sangue
A fonte mais comum de células tronco para transplante é o sangue periférico, o sangue que flui por nossas veias e artérias.
A medula óssea normalmente libera um número pequeno de células tronco do sangue periférico (PBSCs) para a corrente sanguínea. Para obter PBSCs suficientes para um transplante, o doador toma um fator de crescimento de células brancas, como o medicamento fator de estimulação de colônia de granulócitos (G-CSF), que aumenta o número de células tronco ao retirá-las da medula e colocá-las na corrente sanguínea. Quando as próprias células tronco de um paciente são usadas, G-CSF e a quimioterapia usada para tratar a doença geralmente aumentam as PBSCs. Em pacientes que têm mieloma e linfoma não Hodgkin, o medicamento plerixafor (Mozobil®) pode ser usado para mobilizar as suas próprias células tronco.
O sangue é removido do doador e as células coletadas usando um processo chamado aférese, que envolve colocar uma agulha na veia do doador, geralmente no braço, como ao fazer um exame de sangue. O sangue do doador é bombeado por meio de uma máquina de aférese, que separa o sangue em quatro compartimentos: células vermelhas (eritrócitos), plasma, células brancas (leucócitos) e plaquetas. As células brancas e plaquetas, que contêm as células tronco, são coletadas, ao passo que as células vermelhas e o plasma são devolvidas ao doador. Pode levar uma a duas sessões de aférese para coletar sangue suficiente de um MUD. Se você for o seu próprio doador, pode levar mais que duas sessões.
Medula Óssea
Se as células tronco suficientes não puderem ser recuperadas pela aférese, elas podem ser retiradas diretamente da medula óssea. Isto requer que o doador se submeta a um pequeno procedimento cirúrgico ambulatorial. Enquanto o doador está sob anestesia, o cirurgião insere uma agulha oca nos ossos pélvicos do doador logo abaixo da cintura e remove o líquido da medula. Isto é feito uma série de vezes até que vários litros de medula sejam coletados. O doador pode permanecer no hospital por seis a oito horas após o procedimento para se recuperar da anestesia e da dor aguda nos locais de inserção da agulha. Ele ou ela pode sentir alguma dor na região lombar das costas por alguns dias depois do procedimento. O corpo do doador repõe naturalmente a medula logo após o procedimento. As células vermelhas são também removidas, e o doador pode apresentar anemia, que é geralmente tratada com suplementos de ferro.
A medula óssea que é removida (coletada) passa por uma série de filtros para remover os fragmentos de osso ou tecido e é então colocada em uma bolsa plástica, a partir da qual pode ser infundida na veia do receptor. A medula é geralmente fornecida ao paciente dentro de algumas horas e quase sempre dentro de 24 horas. Se necessário, no entanto, a medula pode ser congelada e armazenada e permanecerá adequada para uso por anos. Se o transplante for autólogo, a medula é geralmente congelada enquanto o paciente é submetido à quimioterapia intensiva.
Sangue da Placenta e do Cordão Umbilical
Uma fonte rica em células tronco para pacientes com câncer do sangue são as células tronco armazenadas coletadas do cordão umbilical e da placenta após o nascimento de um bebê, chamado unidade de sangue do cordão umbilical. Os pais podem escolher ter a unidade de sangue do cordão umbilical coletada após o parto. Os pais sadios com crianças sadias e sem candidato a transplante na família podem escolher doar o sangue do cordão umbilical do seu recém-nascido para bancos de sangue do cordão umbilical ou programas de pesquisa em hospitais participantes. Pais com uma criança ou parente que pode ser um candidato para transplante devem discutir com o seu médico sobre os possíveis benefícios de guardar o sangue do cordão umbilical do seu recém-nascido para possível uso na família.
Vantagens do Sangue do Cordão Umbilical
As vantagens de usar as células tronco do sangue do cordão umbilical, ao invés das células tronco da medula do doador incluem:
- Disponibilidade. O sangue do cordão umbilical armazenado em um banco público de sangue do cordão umbilical passou por uma pré-seleção, teste e está congelado e pronto para uso; por outro lado, pode levar vários meses para encontrar e confirmar um doador de medula ou sangue periférico;
- Compatibilidade de HLA. Uma próxima compatibilidade entre o paciente e a unidade de sangue do cordão umbilical pode melhorar o resultado;
- Doença do enxerto versus hospedeiro. Pacientes que são submetidos a transplante de células tronco do sangue do cordão umbilical são menos propensos a desenvolver a doença do enxerto versus hospedeiro (GVHD) ou apresentar menos complicações graves da GVHD do que pacientes que têm transplantes de medula óssea ou do sangue periférico;
- Diversidade. As unidades do sangue do cordão umbilical doadas coletadas de hospitais onde partos de bebês com ascendências étnicas variadas têm números bastante representativos têm o potencial de fornecer uma fonte de células tronco com diversidade racial;
- Transmissão de doenças infecciosas. Os transplantes de célula tronco do sangue do cordão umbilical têm menos risco de transmissão de doenças infecciosas de transmissão sanguínea em comparação às células tronco do sangue periférico ou de medula de doadores relacionados ou não relacionados.
Desvantagens do Uso do Sangue do Cordão Umbilical
Também pode haver desvantagens ao usar células tronco do cordão umbilical:
- Dados clínicos. Doenças genéticas podem estar presentes, mas não visíveis no momento do nascimento, podendo ser transplantadas a um paciente por meio das células tronco do sangue do cordão umbilical do doador. Os procedimentos para detectar esta possibilidade requerem o acompanhamento até o bebê doador ter meses ou até mesmo anos de vida, e esse tipo de acompanhamento tem provado ser difícil. Uma solução parcial usada por muitos bancos públicos de sangue do cordão umbilical é obter um histórico de saúde detalhado de possíveis doadores antes da coleta do sangue do cordão umbilical — como em procedimentos padrão usados para selecionar doadores voluntários de sangue;
- Armazenamento. Os pesquisadores não sabem por quanto tempo o sangue do cordão umbilical pode ser congelado e armazenado antes de perder a sua efetividade. No entanto, as amostras de sangue do cordão umbilical têm sido conservadas por até 10 anos e ainda foram transplantadas com sucesso;
- Enxerto. O número de células necessárias dar a um paciente de transplante as melhores chances para enxerto e sobrevida do transplante é baseado no peso, idade e no estado de doença do paciente. Uma unidade de sangue do cordão umbilical pode conter muito poucas células tronco para o tamanho do receptor. Devido ao menor número de células tronco, os transplantes de células tronco do sangue do cordão umbilical enxertam mais lentamente do que as células tronco da medula ou do sangue periférico. Até ocorrer o enxerto, os pacientes estão em risco de desenvolver infecções com risco à vida. Isto significa que os receptores de transplante de sangue do cordão umbilical podem ser vulneráveis a infecções por até um a dois meses mais do que os receptores de células tronco da medula e do sangue periférico.
Após o Tratamento:
O decréscimo na função da medula geralmente começa a ter efeito pelo segundo ou terceiro dia após uma infusão alogênica de células tronco. Você será mantido em um ambiente protegido para reduzir o contato com agentes infecciosos. Geralmente nas duas a quatro semanas após o transplante, o enxerto das células doadas estará visível com o aparecimento de células brancas normais em seu sangue. Você receberá transfusões periódicas de células vermelhas e plaquetas até a função da sua medula ser restaurada pelas células tronco transplantadas.
O seu médico irá monitorá-lo cuidadosamente com exames físicos, exames de bioquímica sérica, estudos de imagem e outros testes para assegurar que o seu coração, pulmões, rins, fígado e outros órgão importantes estejam funcionando normalmente. Você precisará de medicamentos para prevenir a GVHD, além das transfusões de sangue. Se tiver pouco apetite ou diarreia, você pode precisar ser alimentado intravenosamente ou por meio de um tubo duodenal (chamado hiperalimentação) para assegurar que você receba nutrição adequada.
Resultados do Tratamento
Os resultados do tratamento variam entre os pacientes. Terapias com novos tratamentos, progresso no transplante de células tronco, melhor cuidado de suporte e estudos de novos medicamentos em estudos clínicos estão todos contribuindo para melhora nos resultados e na qualidade de vida para pessoas diagnosticadas com cânceres do sangue.
Muitos pacientes com linfoma de Hodgkin são curados após o seu tratamento inicial. Para um pequeno número de pacientes que têm recorrência ou recidiva da doença, o tratamento adicional com quimioterapia, algumas vezes, combinado com o transplante de células tronco, é geralmente bem-sucedido. Um grande número desses pacientes é curado ou apresenta longos períodos livres de doença.
Linfoma de Hodgkin Refratário
Alguns pacientes ainda têm células cancerosas em sua medula óssea após o tratamento para linfoma de Hodgkin. O termo ‘linfoma de Hodgkin refratário’ é usado para descrever uma doença que não entra em remissão (mas pode estar estável) ou que piora nos seis meses desde o último tratamento.
Se tiver linfoma de Hodgkin refratário, você pode ser submetido a quimioterapia de alta dose com transplante de células tronco.
Linfoma de Hodgkin Recidivado
Se o linfoma na sua medula óssea voltar e o número de suas células sanguíneas reduzir após uma remissão de seis meses ou mais, você teve uma recidiva. Você precisará de mais quimioterapia, igual àquela que você recebeu quando foi recém-diagnosticado. O tratamento geralmente dá aos pacientes períodos muito longos livres de doença, e a doença é ainda potencialmente curável.
Um tratamento para pacientes com linfoma de Hodgkin recidivado está apresentado a seguir.
- Brentuximabe vedotina (Adcetris®)
LINFOMA DE HODGKIN INFANTIL
Devido a terapias novas e melhores, as taxas de sobrevida de crianças com câncer têm melhorado dramaticamente durante as últimas décadas. Os cientistas continuam a procurar pelas causas do linfoma infantil para que possam desenvolver melhores tratamentos com menos efeitos colaterais tóxicos.
Tratamento
O diagnóstico de câncer de uma criança pode trazer consigo sentimentos de incerteza para os pais e outros familiares. De repente, você é empurrado para um mundo de mudanças rápidas, com preocupações, medos e incertezas. Você terá que tomar decisões de tratamento enquanto estiver confortando o seu filho – e ao mesmo tempo tentará enfrentar as suas próprias emoções.
O tratamento do seu filho depende de determinados fatores:
- O estágio da doença;
- O subtipo da doença;
- Possíveis fatores de risco que podem ser encontrados durante os exames laboratoriais;
- A taxa de resposta para o tratamento mensurada por técnicas de imagem, como varreduras por tomografia de emissão de pósitrons (PET) e tomografia computadorizada (TC).
O oncologista hematologista (especialista em câncer) do seu filho deve desenvolver um plano de tratamento que limita a quantidade de terapia necessária para atingir a remissão. Certifique-se de perguntar o oncologista sobre possíveis efeitos colaterais e efeitos de longo prazo ao considerar as opções de tratamento.
Adultos em idade fértil e pais de crianças devem pedir aos seus médicos informações sobre como reduzir o risco de infertilidade. Vide a publicação gratuita da LLS sobre Fatos sobre Fertilidade para mais detalhes.
Combinações de Medicamentos Quimioterápicos
Crianças e adultos jovens com linfoma de Hodgkin são geralmente tratados com combinação de quimioterapia e radioterapia de campo envolvido. O principal avanço no tratamento nos últimos tempos é a capacidade dos médicos de desenvolver planos de tratamento que limitam a quantidade de terapia necessária para alcançar a remissão.
As combinações comuns de medicamentos quimioterápicos usadas para tratar crianças e adultos jovens incluem:
- COPP: ciclofosfamida (Cytoxan®), vincristina (Oncovin®), prednisona, procarbazina (Matulane®);
- ABVD: doxorrubicina (Adriamycin®), bleomicina (Blenoxane®), vinblastina (Cytoxan®), dacarbazina (DTIC-Dome®);
- COPP-ABV: Cytoxan, Oncovin, prednisona, Matulane, Adriamicina, Blenoxano, Cytoxan;
- CHOP: Cytoxan, hidroxidaunomicina, Oncovin, prednisone;
- Stanford V: mecloretamina (Mustargen®), Adriamicina, Cytoxan, Oncovin, Blenoxano, etoposida, prednisone.
Estudos Clínicos
Um estudo clínico pode ser uma opção quando se trata de encontrar o tratamento certo para o câncer do seu filho. O seu filho terá acesso a terapias novas ou melhoras em estudo e ainda não disponíveis no mercado. Discuta com o médico do seu filho sobre a possibilidade de participar de um estudo clínico, onde o tratamento é administrado em um ambiente seguro e criteriosamente monitorado.
Sobrevivência e Necessidades de Cuidado à Saúde Especiais
Após o tratamento, a maioria das crianças pode esperar ter vidas plenas e produtivas. Muitos sobreviventes voltam à escola, vão à faculdade, entram para a força de trabalho, casam-se e têm filhos. Você pode considerar um programa de sobrevivência para o seu filho que foca na vida após o câncer. A maioria dos principais hospitais em todo o mundo oferece esses programas.
Cuidado de Acompanhamento
O seu filho deve visitar o pediatra ou médico pelo menos uma vez por ano para um exame físico completo e testes adicionais necessários. O seu oncologista também deve examinar regularmente o seu filho.
As visitas regulares ao médico são encorajadas para:
- Permitir que os médicos avaliem o efeito completo da terapia;
- Detectar e tratar a recorrência da doença;
- Identificar e controlar efeitos de longo prazo e tardios do tratamento.
Efeitos de Longo Prazo e Tardios do Tratamento
Alguns efeitos colaterais do tratamento para câncer, como fadiga, podem durar meses ou anos após a terapia. Algumas condições médicas, como doença cardíaca e outros cânceres podem não aparecer até anos após o final do tratamento. Os efeitos de longo prazo e tardios podem impactar a saúde física mental e cognitiva (função cerebral) do seu filho.
A maioria dos sobreviventes do linfoma infantil não desenvolve efeitos significativos de longo prazo ou tardios do tratamento. No entanto, para alguns pacientes, os efeitos podem variar de leves a graves.
Efeitos de Longo Prazo e Tardios da Quimioterapia
As crianças tratadas para linfoma podem estar em risco aumentado para:
- Fadiga;
- Atraso no crescimento;
- Disfunção da tireoide;
- Perda na audição;
- Um câncer secundário.
Alguns efeitos de longo prazo e tardios se tornam visíveis com a maturação (puberdade), crescimento e o processo normal de envelhecimento. A intervenção precoce e práticas de estilo de vida saudável (não fumar, dieta equilibrada, prática de exercícios, check-ups e acompanhamento regulares) ajudam.
Efeitos de Longo Prazo e Tardios da Radioterapia
As meninas (e também mulheres com menos de 30 anos de idade) que recebem radiação na área das mamas estão em risco para desenvolver câncer de mama 15 a 20 anos após o tratamento. Os meninos sobreviventes do câncer infantil estão em risco de desenvolver um segundo câncer, mas não têm um risco tão alto para desenvolver câncer de mama que as meninas sobreviventes do câncer infantil.
As meninas que receberam radioterapia na área do tórax (mediastinal) devem:
- Realizar autoexames mensais da mama;
- Fazer uma mamografia basal com 25 a 30 anos de idade ou 10 anos após a radioterapia;
- Fazer um exame clínico anual da mama;
- Fazer uma mamografia a cada dois a três anos, dependendo da densidade do tecido mamário.
As meninas e meninos que tiverem recebido radioterapia mediastinal devem fazer o teste basal para a função cardíaca. Isto deve ser seguido pelo teste a cada três a cinco anos após o tratamento ou com mais regularidade se forem encontradas anormalidades.
Volta à Escola
Dificuldades no aprendizado podem começar durante o tratamento ou aparecer meses ou anos depois. Eduque os familiares, amigos, professores e profissionais de saúde sobre os possíveis efeitos de longo prazo e tardios do tratamento do seu filho. Conversar com os professores e profissionais de saúde do seu filho para desenvolver um programa personalizado às suas necessidades que apresente teste basal, acomodações especiais e planejamento de longo prazo.
Os médicos classificam o linfoma de Hodgkin (LH) por estadiamento. O estadiamento auxilia os médicos a prever a extensão da doença e criar um plano de tratamento apropriado. Os médicos usam comumente o Sistema de Estadiamento Ann Arbor Modificado, que categoriza a doença pela sua extensão e sintomas:
Estágios do Linfoma
Estágio I
Envolvimento de um grupo de linfonodo
Estágio II
Envolvimento de dois ou mais grupos de linfonodos do mesmo lado do diafragma (um músculo fino abaixo dos pulmões)
Estágio III
Envolvimento de grupos de linfonodos nos dois lados do diafragma
Estágio IV
Envolvimento de um ou mais órgãos, além dos linfonodos, e possível envolvimento dos linfonodos
Categorias A, B, X e E
Os quatro estágios do LH podem ser divididos em categorias:
- Categoria A: Sem febre, sem sudorese exagerada e sem perda de peso presente;
- Categoria B: Febre, sudorese excessiva e perda de peso presente;
- Categoria X: Doença volumosa (massas grandes de linfócitos) presente;
- Categoria E: O linfoma se espalhou para áreas ou órgãos fora dos linfonodos, ou para tecidos além, mas próximos, das principais áreas linfáticas.
Por exemplo, o estágio IIB indica que o paciente tem:
- Dois locais de linfonodos próximos um do outro com envolvimento da doença (por exemplo, linfonodos aumentados no pescoço e próximo à clavícula, ou no pescoço e na axila);
- Febre, sudorese excessiva e perda de peso.
O seu tratamento depende do seu estágio e categoria. Os pacientes que se enquadrarem na categoria B geralmente precisam de tratamento mais agressivo do que os pacientes da categoria A.
O que você deve saber:
- O linfoma de Hodgkin é um tipo de câncer que afeta o sistema linfático;
- O linfoma de Hodgkin é uma das patologias com maiores chances de cura;
- Os hematologistas e oncologistas são especialistas que tratam pessoas que têm linfoma de Hodgkin ou outros tipos de câncer do sangue;
- O tratamento inclui radiação, quimioterapia ou ambos, dependendo dos fatores individuais do paciente.
O que você deve fazer:
- Converse com o seu médico sobre os seus exames e o significado dos resultados;
- Saiba o seu subtipo de linfoma de Hodgkin – subtipos diferentes têm tratamentos diferentes. Fique atento!
Como o Linfoma de Hodgkin se desenvolve?
O linfoma de Hodgkin começa quando uma célula branca (chamada linfócito) sofre uma alteração anormal que a torna uma célula do linfoma.
- As células do linfoma crescem e formam massas, geralmente nos linfonodos, localizados em todo o nosso corpo no sistema linfático;
- As células do linfoma também podem se reunir em outras áreas do corpo onde encontra-se o tecido linfoide;
- O linfoma de Hodgkin é diferenciado de outros tipos de linfoma pela presença de células Reed-Sternberg (que recebeu esse nome pelos cientistas que as identificaram primeiro). Outras células associadas à doença são chamadas de células de Hodgkin.
Se não tratado, as células cancerosas crescem para fora das células brancas normais, e o sistema imunológico não pode deter a infecção de maneira efetiva.
Subtipos do Linfoma de Hodgkin
A maioria das pessoas diagnosticadas com linfoma de Hodgkin tem um dos dois principais tipos da doença, chamados subtipos:
• Linfoma de Hodgkin clássico;
• Linfoma de Hodgkin com predominância linfocitária nodular.
Os subtipos foram classificados pela Organização Mundial de Saúde (OMS). É importante saber o seu subtipo, já que ele tem uma grande importância na determinação do tipo de tratamento que você receberá.
Linfoma de Hodgkin Clássico
Cerca de 95% das pessoas com linfoma de Hodgkin tem o subtipo clássico. O linfoma de Hodgkin clássico é ainda dividido em quatro subtipos:
1) Linfoma de Hodgkin esclerose nodular
- Constitui cerca de 60% de todos os casos de linfoma de Hodgkin;
- Mais comumente diagnosticado em adultos jovens com idade entre 15 e 34 anos;
- Altamente curável;
- Tem algumas anormalidades que podem persistir após o tratamento bem-sucedido, como a formação de pequenos pedaços de tecido cicatrizado inofensivo (fibrose residual).
2) Linfoma de Hodgkin de celularidade mista
- O segundo subtipo mais comum, que constitui 25% de todos os casos de linfoma de Hodgkin;
- Mais comumente diagnosticado em crianças com idade até 14 anos e adultos mais velhos com idade entre 55 e 74 anos;
- Comum em pessoas com transtornos do sistema imunológico, como o vírus da imunodeficiência humana (HIV);
- Um subtipo agressivo, porém altamente curável;
3) Linfoma de Hodgkin de depleção linfocitária
- Constitui cerca de 4% de todos os casos de linfoma de Hodgkin;
- Geralmente tem um panorama relativamente desfavorável quando comparado com outros subtipos de linfoma de Hodgkin;
- Algumas vezes tem o diagnóstico confundido com o linfoma não Hodgkin.
4) Linfoma de Hodgkin clássico rico em linfócitos
- Semelhante ao subtipo de predominância linfocítica nodular, porém tem mais características em comum com o linfoma de Hodgkin clássico.
Linfoma de Hodgkin de Predominância Linfocítica Nodular
O linfoma de Hodgkin de predominância linfocítica nodular (LHPLN) afeta cerca de 5% dos pacientes, em grande parte rapazes. O LHPLN é identificado por determinados fatores:
- As células do LHPLN são células “linfocíticas” e “histolíticas” – diferentes das células de Reed-Sternberg clássicas que sinalizam o linfoma de Hodgkin clássico;
- Os pacientes nem sempre têm sintomas;
- O LHPLN é de crescimento lento (indolente), e as chances de sobrevida de longo prazo são boas;
- Existe um risco de 3% de que o LHPLN se transformará em um linfoma não Hodgkin;
- O tratamento do LHPLN é geralmente diferente da terapia de primeira linha padrão para o linfoma de Hodgkin clássico.
Para a maioria das pessoas que têm linfoma de Hodgkin não existem fatores de risco que expliquem por que eles desenvolveram a doença. Os resultados de determinados estudos sobre as causas do linfoma de Hodgkin não são definitivos:
- Foram conduzidos muitos estudos sobre associações entre o linfoma de Hodgkin e exposições ambientais com resultados pouco claros;
- Embora o vírus de Epstein-Barr (EBV) tenha sido associado a quase metade dos casos de linfoma de Hodgkin, o EBV não foi estabelecido conclusivamente como uma causa;
- A maioria dos casos de linfoma de Hodgkin ocorre em pessoas que não têm fatores de risco identificáveis;
- A maioria das pessoas com fatores de risco identificáveis não desenvolve o linfoma de Hodgkin;
- Os pacientes que têm um histórico de um exame de sangue confirmando mononucleose têm um risco três vezes maior de LH em comparação à população geral;
- As pessoas infectadas com vírus linfocitotrópico de células T humanas (HTLV) ou o vírus da imunodeficiência humana (HIV) também têm probabilidade aumentada de desenvolver o LH;
- Os especialistas constataram que, ocasionalmente, irmãos de pessoas com linfoma de Hodgkin tendem a ter maiores taxas da doença do que as pessoas com irmãos e irmãs que não têm a doença. Embora a ligação não seja comum, os cientistas estão estudando por que o linfoma é mais comum em algumas famílias do que em outras.
O sinal inicial mais comum do linfoma de Hodgkin é o inchaço (aumento) indolor de um ou mais linfonodos. A maioria das pessoas apresenta linfonodos afetados na parte superior do corpo, geralmente no pescoço ou no tórax superior. Algumas vezes, você pode sentir o(s) linfonodo(s) afetado(s) na sua axila, na área do estômago ou na virilha.
Além dos linfonodos inchados, outros sinais e sintomas do linfoma de Hodgkin podem incluir:
- Febre sem uma causa evidente;
- Uma tosse persistente;
- Falta de ar durante a atividade normal;
- Sudorese excessiva, especialmente à noite;
- Cansaço ou falta de energia;
- Perda inexplicada de peso;
- Coceira;
- Dor no linfonodo após consumo de bebida alcoólica;
- Baço com tamanho aumentado.
Alguns sintomas do linfoma de Hodgkin estão associados às outras doenças menos sérias. No entanto, se estiver incomodado com algum dos sintomas acima, não hesite em procurar o seu médico.
Testes Diagnósticos
Exames de Imagem:
O seu médico pode pedir exames de imagem se o seu histórico médico e exame físico sugerirem um diagnóstico possível de linfoma de Hodgkin. O seu médico procura por:
- Linfonodos aumentados no tórax ou abdômen ou em ambos;
- Massas tumorais fora dos linfonodos no pulmão, nos ossos ou em outro tecido corporal.
Os exames de imagem podem incluir:
- Uma radiografia do tórax;
- Uma varredura de tomografia computadorizada (TC) do tórax, pelve e abdômen (área do estômago);
- Uma varredura por imagem de ressonância magnética (IRM);
- Uma varredura por tomografia de emissão de pósitrons (PET) ;
- Uma varredura PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo.
Biópsia do Linfonodo:
O diagnóstico do linfoma de Hodgkin geralmente envolve a realização de uma biópsia de linfonodo. Se a biópsia confirmar que você tem a doença, o seu médico realiza testes adicionais para estadiar o linfoma. A finalidade da biópsia do linfonodo é confirmar um diagnósticom, além de identificar o subtipo do seu linfoma de Hodgkin para desenvolver um plano de tratamento.
Exames Laboratoriais para Confirmar um Diagnóstico
Um hematopatologista examina a amostra do seu linfonodo sob um microscópico para procurar identificar as características do linfoma de Hodgkin. Um hematopatologista é um especialista que estuda as doenças de células sanguíneas ao analisar as amostras de sangue e células da medula e outros tecidos.
O hematopatologista pode usar um exame laboratorial chamado imunofenotipagem para analisar a presença de células de Reed-Sternberg e as células de Hodgkin para diferenciar o linfoma de Hodgkin de outros tipos de linfoma e outras condições não cancerosas.
O linfoma de Hodgkin pode ser uma doença de difícil diagnóstico. Você pode querer uma segunda opinião médica por um hematopatologista experiente antes de começar o tratamento. O linfoma de Hodgkin pode ser confundido com alguns tipos de linfoma não Hodgkin. O tratamento apropriado depende de ter o diagnóstico correto.
Testes de Estadiamento
Assim que o seu oncologista hematologista confirmar o diagnóstico do linfoma de Hodgkin, ele irá pedir mais testes para estadiar a sua doença. O estadiamento identifica a extensão da sua doença e onde ela está localizada no seu corpo.
Os testes de estadiamento incluem:
- Exames de sangue;
- Exames da medula óssea;
- Exames de imagem.
Exames de Sangue
Após coletar o seu sangue, ele é enviado a um laboratório para um hemograma completo (CBC) e exames adicionais. O seu sangue é dosado para:
- Níveis de células vermelhas (eritrócitos), células brancas (leucócitos) e plaquetas;
- Níveis séricos de proteína;
- Níveis de ácido úrico;
- Velocidade de hemossedimentação (a velocidade para as células vermelhas se depositarem no fundo de um tubo de ensaio – uma velocidade aumentada pode indicar câncer);
- Função hepática.
Exames da Medula Óssea
O seu médico pode decidir examinar a sua medula óssea para ver se a doença se espalhou. Se a sua doença está em um estágio inicial e alguns sinais e sintomas não apareceram, você pode não precisar fazer o teste.
O teste de medula óssea envolve duas etapas geralmente feitas ao mesmo tempo em um consultório médico ou em um hospital:
- Uma aspiração da medula óssea para remover uma amostra líquida da medula;
- Uma biópsia da medula óssea para remover uma pequena quantidade de osso preenchido com medula;
Exames de Imagem
O seu médico conduz um ou mais exames de imagem, juntamente com um exame físico, para verificar:
- A localização e distribuição dos linfonodos aumentados;
- O efeito da doença, se houver, em outros órgãos, como os pulmões e o fígado;
- Massas tumorais grandes.
Os exames de imagem podem incluir:
- Uma radiografia de tórax;
- Uma varredura de tomografia computadorizada (TC) do tórax, pelve e abdômen (área do estômago);
- Uma varredura por imagem de ressonância magnética (IRM);
- Uma varredura de tomografia de emissão de pósitrons (PET);
- Uma varredura PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo (F-18).
É importante que o seu médico seja experiente no tratamento de pacientes com linfoma de Hodgkin ou trabalhe em consulta com um especialista em linfoma de Hodgkin. Este tipo de especialista é chamado oncologista hematologista.
Para muitas pessoas com linfoma de Hodgkin, iniciar o tratamento os auxilia a focar e seguir em frente buscando a recuperação. Um olhar sobre a taxa de sucesso do tratamento pode ser encorajador: Mais de 75 % de todos os pacientes podem ser curados. A taxa aumenta para 90% para pacientes mais jovens. O linfoma de Hodgkin é considerado uma das formas mais curáveis de câncer.
Tipos de Tratamento
Os médicos usam diversos tipos de abordagens e combinações de tratamento para adultos e crianças com linfoma de Hodgkin, alguns em estágios diferentes:
- Quimioterapia e farmacoterapia;
- Radioterapia de campo envolvido;
- Transplante de células tronco;
- O seu médico pode sugerir que você participe de um estudo clínico. Estudos clínicos podem envolver a terapia com novos medicamentos e novas combinações de medicamentos ou novas abordagens para o transplante de células tronco.
Considerações Pré-Tratamento
Adultos em idade fértil e pais de crianças diagnosticadas com LH devem pedir aos seus médicos informações sobre o possível risco de infertilidade.
Encontrando a Melhor Abordagem de Tratamento:
O objetivo do tratamento para o linfoma de Hodgkin é curar a doença.
O tratamento que o seu médico recomendar é baseado em diversos fatores, incluindo:
- O subtipo da sua doença;
- O estágio e categoria da sua doença;
- Se a sua doença é recidiva ou refratária;
- A sua saúde geral e se você tem alguma condição, como doença cardíaca, doença renal, doença pulmonar, diabetes ou anemia;
- Se você está grávida.
Quando desenvolver um plano de tratamento com o seu médico, assegure-se de discutir:
- Os resultados que você pode esperar com o tratamento;
- Possíveis efeitos colaterais, incluindo efeitos de longo prazo e efeitos tardios;
- A possibilidade de participar de um estudo clínico, onde você terá acesso ao tratamento médico avançado que pode ser mais benéfico a você do que o tratamento padrão.
Você pode achar útil levar alguém próximo a você as suas visitas com o seu médico para apoio, para tomar notas e fazer perguntas de acompanhamento. Uma sugestão é preparar as perguntas que gostaria de fazer quando visitar o seu médico. Você também pode registrar as suas conversas e ouvir com mais atenção ao chegar em casa.
Outras Considerações de Tratamento:
- Se tiver 60 ou mais anos, o seu tratamento pode variar das abordagens padrão. Por exemplo, o seu corpo pode não ser capaz de tolerar os medicamentos quimioterápicos tóxicos ou você pode ter outras enfermidades que são mais comuns à medida que envelhecemos. Esses fatores, entre outros, podem tornar mais complicada a escolha do tratamento;
- Se o seu filho está sendo tratado para linfoma de Hodgkin, a terapia pode diferir ligeiramente daquela para um adulto comum. Vide Linfoma de Hodgkin Infantil.
QUIMIOTERAPIA E TERAPIA FARMACOLÓGICA
Durante a quimioterapia, você recebe medicamentos potentes que devem ser tóxicos o suficiente para danificar ou matar as células do linfoma. Ao mesmo tempo, eles podem afetar as células normais e causar efeitos colaterais.
Os médicos combinam comumente quatro ou mais medicamentos quimioterápicos para tratar o linfoma de Hodgkin. Os medicamentos são normalmente administrados por um cateter (um tubo fino e flexível ou linha intravenosa) cirurgicamente colocada em uma veia, normalmente no seu tórax superior.
Medicamentos Quimioterápicos usados para o Linfoma de Hodgkin:
Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. Combinar tipos de medicamentos pode aumentar a sua efetividade. As combinações têm geralmente o nome das abreviações para a primeira letra usada na mistura. As combinações mais comuns e efetivas usadas incluem:
- ABVD: doxorrubicina (Adriamycin®), bleomicina (Blenoxane®), vinblastina (Cytoxan®), dacarbazina (DTIC-Dome®);
- BEACOPP: Blenoxano, etoposida (Etopophos®, Toposar®, VePesid®, VP-16), Adriamicina, ciclofosfamida (Cytoxan®), vincristina (Oncovin®), procarbazina (Matulane®), prednisona;
- Stanford V: mecloretamina (Mustargen®), Adriamicina, Cytoxan, Oncovin, Blenoxano, etoposida, prednisone.
ABVD é usado para os estágios I e II do linfoma de Hodgkin (combinado com a radioterapia de campo envolvido) e para os estágios III e IV (por um período de tempo mais longo). ABVD é a primeira escolha de tratamento para a maioria dos pacientes adultos devido a sua efetividade e reputação para produzir efeitos colaterais menos tóxicos do que aqueles de outras combinações de medicamentos, que têm um maior risco de infertilidade ou leucemia. A taxa de cura para os estágios I e II é de mais de 95%.
Os pacientes nos estágios I e II geralmente recebem até dois ciclos de ABVD, com várias semanas de intervalo, seguido por radioterapia de campo envolvido com uma dose reduzida de radiação. Se eles estiverem em alto risco, eles geralmente são submetidos a quatro a seis ciclos antes da radiação. O tratamento pode durar de seis a oito meses.
Os pacientes nos estágios III e IV são tratados com seis a oito cursos da terapia de combinação, como ABVD ou BEACOPP. BEACOPP possui uma boa taxa de cura, porém tem um risco pequeno de leucemia ou de um segundo câncer, o que o faz um tratamento menos comum nos Estados Unidos e no Canadá. Os médicos podem usar BEACOPP para o linfoma de Hodgkin agressivo e avançado.
Stanford V é outra combinação de medicamentos que os médicos usam com ou sem a radioterapia para a doença avançada. Ela é administrada por um tempo mais curto, porém mais frequente do que ABVD.
RADIOTERAPIA DE CAMPO ENVOLVIDO
Uma combinação de radioterapia e quimioterapia provou ser uma abordagem efetiva de duas vertentes para tratar os estágios I e II do linfoma de Hodgkin. Os pacientes que têm doença mais disseminada (estágios III e IV e categoria B) são geralmente tratados com a quimioterapia isolada.
A radioterapia de campo envolvido com a quimioterapia – também conhecida como terapia de modalidade combinada – envolve duas principais etapas realizadas em momentos separados, geralmente em um centro ambulatorial de clínica oncológica:
1 Medicamentos quimioterápicos são administrados para matar as células vizinhas do linfoma;
2 Radiação é aplicada por raios de alta energia para encolher massas de células do linfoma.
Você pode precisar permanecer no hospital por um período curto durante o tratamento se a sua terapia for particularmente intensiva e levar à infecção ou decréscimos prolongados ou graves nos hemogramas.
Durante a radioterapia de campo envolvido, você recebe radiação somente nas áreas do seu corpo afetadas pelo linfoma de Hodgkin. Uma máquina chamada acelerador linear, ou linac, aplica feixe de radiação a área(s) alvo(s) do seu corpo enquanto você está deitado em uma mesa móvel. Partes do seu corpo não afetadas pelo linfoma de Hodgkin, como os órgãos reprodutores, são protegidos para ajudar a reduzir os efeitos colaterais do tratamento. O procedimento em si é indolor, embora algumas pessoas possam sentir desconforto ao permanecer na mesma posição por vários minutos durante a sessão. Vários dias depois, a sua radioterapia é seguida pela quimioterapia.
Tratamento do Hodgkin com Predominância Linfocítica Nodular:
Uma exceção ao uso do tratamento combinado de primeira linha da radioterapia e da quimioterapia é o tratamento para o subtipo do linfoma e Hodgkin de predominância linfocítica nodular (LHPLN). No seu lugar, a radioterapia é usada de maneira isolada e não combinada com a quimioterapia. O LHPLN é uma forma de crescimento lento da doença que é geralmente diagnosticada durante o estágio I, resultando em uma taxa de sobrevida próxima a 100%. Portanto, é importante não tratar demasiadamente a doença.
TRANSPLANTE DE CÉLULAS TRONCO
O transplante de células tronco não é recomendado para o tratamento inicial de pacientes que têm linfoma de Hodgkin, porém pode ser usado para tratar pacientes na primeira recidiva. Podem ser usados dois tipos de transplante de células tronco:
- Transplante autólogo de células tronco, que usa as suas próprias células tronco.
- Transplante alogênico de células tronco, que usa as células tronco de um doador compatível. O transplante autólogo apresenta menos risco aos pacientes do que o transplante alogênico.
A efetividade das terapias para pacientes recém-diagnosticados tem reduzido a necessidade para o transplante de células tronco. No entanto, o transplante autólogo de células tronco pode curar alguns pacientes, cujo linfoma de Hodgkin retornou após um período sem sinal da doença. Os pesquisadores estão estudando em estudos clínicos o transplante alogênico de células tronco padrão e de intensidade reduzida para tratar alguns pacientes com linfoma de Hodgkin que têm um doador compatível. Para tratar ou curar o seu câncer do sangue, o seu médico pode sugerir doses muito altas de quimioterapia e um transplante autólogo de células tronco usando as suas próprias células tronco.
TRANSPLANTE AUTÓLOGO DE CÉLULAS TRONCO
Como Ele Funciona?
A sua medula é coletada enquanto você está em remissão. Você deve primeiro ser submetido a terapia condicionante na forma de quimioterapia ou radioterapia de alta intensidade para controlar a doença e reduzir o número de células com câncer na sua medula e sangue. As suas próprias células tronco são “coletadas”, ou recuperadas, do seu corpo e congeladas. Após receber a quimioterapia ou radioterapia intensiva, as suas células são devolvidas ao seu corpo por infusão através de uma veia.
O objetivo de um transplante autólogo de células tronco é restaurar a capacidade do corpo de produzir células sanguíneas normais após a quimioterapia ou radioterapia de alta dose. Diferente do transplante alogênico de células tronco este procedimento:
- Não oferece os benefícios do efeito enxerto versus tumor (GVL) quando as células sadias do doador atacam as células cancerosas;
- Não tem o risco da doença do enxerto versus hospedeiro.
O transplante autólogo de células tronco pode causar alguns efeitos adversos, em grande parte da terapia condicionante de alta intensidade:
- Decréscimo acentuado no hemograma pode levar a infecção e necessidade de transfusões de células vermelhas (para tratar a anemia) e plaquetas (para prevenir ou tratar a hemorragia);
- Alguns medicamentos condicionantes podem causar complicações, como pneumonia intersticial, como resultado da infecção ou dano da terapia intensive;
- Úlceras orais dolorosas (mucosite oral) podem se desenvolver que, em casos raros, podem impedir que você coma ou beba. O fator de crescimento de células cutâneas, palifermina (Kepivance®), e outras medidas podem prevenir ou reduzir os efeitos da mucosite oral.
TRANSPLANTE ALOGÊNICO DE CÉLULAS TRONCO
O transplante alogênico de células tronco envolve a transferência de células tronco de uma pessoa sadia (o doador) para o seu corpo após a quimioterapia ou radioterapia de alta intensidade.
O transplante alogênico de células tronco é usado para curar alguns pacientes que:
- Estão em alto risco de recidiva;
- Não respondem completamente ao tratamento;
- Recidiva após tratamento prévio bem sucedido.
O transplante alogênico de células tronco pode ser um procedimento de alto risco. Os regimes de alto condicionamento são destinados para comprometer severamente ou completamente a sua capacidade de produzir células tronco e você provavelmente apresentará efeitos colaterais durante os dias que receber a radioterapia ou quimioterapia condicionante de alta dose. Os objetivos da terapia de alto condicionamento são:
- Tratar de maneira intensiva as células cancerosas restantes, tornando assim a recorrência do câncer menos provável;
- Inativar o sistema imunológico para reduzir as chances de rejeição do enxerto de células tronco;
- Permitir que as células do doador cheguem até a medula (enxerto), produzam células sanguíneas e proporcionem o efeito enxerto versus tumor.
Possíveis Efeitos Adversos
O sistema imunológico e o sistema sanguíneo são proximamente ligados e não podem ser separados um do outro. Por causa disso, o transplante alogênico permite que não apenas o sistema sanguíneo do doador, mas também o seu sistema imunológico, sejam transferidos. Consequentemente, são possíveis os seguintes efeitos adversos:
- Rejeição imunológica pelo receptor das células tronco doadas (efeito hospedeiro versus enxerto);
- Reação imunológica pelas células doadoras contra os tecidos do receptor (doença do enxerto versus hospedeiro [GVHD]).
A reação imunológica, ou GVHD, é tratada com a administração de medicamentos ao paciente após o transplante que reduzem a capacidade das células imunológicas doadas de atacar e lesionar os tecidos do paciente. Vide Doença do Enxerto Versus Hospedeiro. Os transplantes alogênicos de células tronco para pacientes que têm mais idade ou têm saúde geral debilitada são relativamente incomuns. Isto porque a terapia condicionante no pré-transplante é geralmente não bem tolerada por esses pacientes, especialmente aqueles com funcionamento inadequado dos órgãos internos. No entanto, transplantes alogênicos de células tronco de intensidade reduzida podem ser um tratamento apropriado para alguns pacientes mais velhos ou mais enfermos.
Depleção de Linfócitos T
Um objetivo do transplante alogênico de células tronco é fazer com que os linfócitos T no sangue ou medula do doador se estabeleçam (enxertam) e cresçam na medula do paciente. Às vezes, os linfócitos T atacam as células cancerosas. Quando isto acontece, é chamado de efeito enxerto versus tumor (GVT) (também chamado efeito enxerto versus câncer). O ataque torna menos provável que a doença retorne. Este efeito é mais comum em leucemias mieloides do que é em outros cânceres de sangue.
Infelizmente, os linfócitos T são as mesmas células que causam a doença do enxerto versus hospedeiro (GVHD). Devido a este efeito colateral sério e, algumas vezes, de risco à vida, os médicos, em determinados casos, querem reduzir o número de linfócitos T a serem infundidos com as células de tronco. Este procedimento, chamado depleção de linfócitos T, está sendo atualmente estudado pelos pesquisadores. A técnica envolve tratar as células tronco coletadas para transplante com agentes que reduzem o número de linfócitos T. O objetivo da depleção de linfócitos T é reduzir a incidência e a gravidade da GVHD. No entanto, ela também pode causar o aumento nas taxas de rejeição ao enxerto, reduzir o efeito do GVT e a uma recuperação imunológica mais lenta. Os médicos devem ser cuidadosos sobre o número de linfócitos T removidos ao utilizar esta técnica.
Seleção das Células Tronco:
A seleção das células tronco é outra técnica que está sendo estudada em estudos clínicos que pode reduzir o número de linfócitos T que um paciente recebe. Devido às características específicas da camada externa das células tronco, os médicos podem remover seletivamente as células tronco de uma mistura celular. Esta técnica produz um grande número de células tronco e menor de outras células, incluindo linfócitos T.
Encontrando um Doador:
Se estiver considerando o transplante alogênico de células tronco, você precisará de um doador de medula óssea. Em primeiro lugar, você e seus irmãos, se houver, terão o sangue ou uma raspagem do lado de dentro da bochecha testados para determinar o tipo de tecido. Um irmão tem o potencial de ser o mais proximamente compatível com você, pois vocês dois receberam genes dos mesmos pais.
Um técnico de laboratório examina a superfície das células do tecido da amostra para identificar as proteínas que proporcionam a todos o seu próprio tipo de tecido, chamado antígenos leucocitários humanos (HLAs). Se o HLA das células do doador for idêntico (de gêmeos idênticos, por exemplo) ou semelhantes (como aqueles de irmãos), é muito provável que o transplante seja bem-sucedido. Em média, você tem uma entre quatro chances de ter o mesmo tipo HLA de um irmão. Muitos pacientes, no entanto, não têm um irmão com o mesmo tipo de tecido.
Se um irmão ou irmã não for um doador compatível, o seu médico fará uma busca nos registros de doadores voluntários, como no Programa Nacional de Doadores de Medula, por um doador sem parentesco que seja compatível com o seu tipo de tecido. Um doador que não tem parentesco com você, mas que tem um tipo de tecido semelhante é chamado doador compatível não relacionado (MUD).
Coletando Células Tronco
As células tronco para transplante são coletadas de três fontes:
- Sangue;
- Medula óssea;
- Sangue da placenta e do cordão umbilical.
Antes das células tronco serem coletadas do sangue ou da medula óssea, o doador deve passar por um exame físico completo e exames de sangue para vírus da hepatite, doença da imunodeficiência humana (HIV) e outros agentes ou vírus infecciosos.
Sangue
A fonte mais comum de células tronco para transplante é o sangue periférico, o sangue que flui por nossas veias e artérias.
A medula óssea normalmente libera um número pequeno de células tronco do sangue periférico (PBSCs) para a corrente sanguínea. Para obter PBSCs suficientes para um transplante, o doador toma um fator de crescimento de células brancas, como o medicamento fator de estimulação de colônia de granulócitos (G-CSF), que aumenta o número de células tronco ao retirá-las da medula e colocá-las na corrente sanguínea. Quando as próprias células tronco de um paciente são usadas, G-CSF e a quimioterapia usada para tratar a doença geralmente aumentam as PBSCs. Em pacientes que têm mieloma e linfoma não Hodgkin, o medicamento plerixafor (Mozobil®) pode ser usado para mobilizar as suas próprias células tronco.
O sangue é removido do doador e as células coletadas usando um processo chamado aférese, que envolve colocar uma agulha na veia do doador, geralmente no braço, como ao fazer um exame de sangue. O sangue do doador é bombeado por meio de uma máquina de aférese, que separa o sangue em quatro compartimentos: células vermelhas (eritrócitos), plasma, células brancas (leucócitos) e plaquetas. As células brancas e plaquetas, que contêm as células tronco, são coletadas, ao passo que as células vermelhas e o plasma são devolvidas ao doador. Pode levar uma a duas sessões de aférese para coletar sangue suficiente de um MUD. Se você for o seu próprio doador, pode levar mais que duas sessões.
Medula Óssea
Se as células tronco suficientes não puderem ser recuperadas pela aférese, elas podem ser retiradas diretamente da medula óssea. Isto requer que o doador se submeta a um pequeno procedimento cirúrgico ambulatorial. Enquanto o doador está sob anestesia, o cirurgião insere uma agulha oca nos ossos pélvicos do doador logo abaixo da cintura e remove o líquido da medula. Isto é feito uma série de vezes até que vários litros de medula sejam coletados. O doador pode permanecer no hospital por seis a oito horas após o procedimento para se recuperar da anestesia e da dor aguda nos locais de inserção da agulha. Ele ou ela pode sentir alguma dor na região lombar das costas por alguns dias depois do procedimento. O corpo do doador repõe naturalmente a medula logo após o procedimento. As células vermelhas são também removidas, e o doador pode apresentar anemia, que é geralmente tratada com suplementos de ferro.
A medula óssea que é removida (coletada) passa por uma série de filtros para remover os fragmentos de osso ou tecido e é então colocada em uma bolsa plástica, a partir da qual pode ser infundida na veia do receptor. A medula é geralmente fornecida ao paciente dentro de algumas horas e quase sempre dentro de 24 horas. Se necessário, no entanto, a medula pode ser congelada e armazenada e permanecerá adequada para uso por anos. Se o transplante for autólogo, a medula é geralmente congelada enquanto o paciente é submetido à quimioterapia intensiva.
Sangue da Placenta e do Cordão Umbilical
Uma fonte rica em células tronco para pacientes com câncer do sangue são as células tronco armazenadas coletadas do cordão umbilical e da placenta após o nascimento de um bebê, chamado unidade de sangue do cordão umbilical. Os pais podem escolher ter a unidade de sangue do cordão umbilical coletada após o parto. Os pais sadios com crianças sadias e sem candidato a transplante na família podem escolher doar o sangue do cordão umbilical do seu recém-nascido para bancos de sangue do cordão umbilical ou programas de pesquisa em hospitais participantes. Pais com uma criança ou parente que pode ser um candidato para transplante devem discutir com o seu médico sobre os possíveis benefícios de guardar o sangue do cordão umbilical do seu recém-nascido para possível uso na família.
Vantagens do Sangue do Cordão Umbilical
As vantagens de usar as células tronco do sangue do cordão umbilical, ao invés das células tronco da medula do doador incluem:
- Disponibilidade. O sangue do cordão umbilical armazenado em um banco público de sangue do cordão umbilical passou por uma pré-seleção, teste e está congelado e pronto para uso; por outro lado, pode levar vários meses para encontrar e confirmar um doador de medula ou sangue periférico;
- Compatibilidade de HLA. Uma próxima compatibilidade entre o paciente e a unidade de sangue do cordão umbilical pode melhorar o resultado;
- Doença do enxerto versus hospedeiro. Pacientes que são submetidos a transplante de células tronco do sangue do cordão umbilical são menos propensos a desenvolver a doença do enxerto versus hospedeiro (GVHD) ou apresentar menos complicações graves da GVHD do que pacientes que têm transplantes de medula óssea ou do sangue periférico;
- Diversidade. As unidades do sangue do cordão umbilical doadas coletadas de hospitais onde partos de bebês com ascendências étnicas variadas têm números bastante representativos têm o potencial de fornecer uma fonte de células tronco com diversidade racial;
- Transmissão de doenças infecciosas. Os transplantes de célula tronco do sangue do cordão umbilical têm menos risco de transmissão de doenças infecciosas de transmissão sanguínea em comparação às células tronco do sangue periférico ou de medula de doadores relacionados ou não relacionados.
Desvantagens do Uso do Sangue do Cordão Umbilical
Também pode haver desvantagens ao usar células tronco do cordão umbilical:
- Dados clínicos. Doenças genéticas podem estar presentes, mas não visíveis no momento do nascimento, podendo ser transplantadas a um paciente por meio das células tronco do sangue do cordão umbilical do doador. Os procedimentos para detectar esta possibilidade requerem o acompanhamento até o bebê doador ter meses ou até mesmo anos de vida, e esse tipo de acompanhamento tem provado ser difícil. Uma solução parcial usada por muitos bancos públicos de sangue do cordão umbilical é obter um histórico de saúde detalhado de possíveis doadores antes da coleta do sangue do cordão umbilical — como em procedimentos padrão usados para selecionar doadores voluntários de sangue;
- Armazenamento. Os pesquisadores não sabem por quanto tempo o sangue do cordão umbilical pode ser congelado e armazenado antes de perder a sua efetividade. No entanto, as amostras de sangue do cordão umbilical têm sido conservadas por até 10 anos e ainda foram transplantadas com sucesso;
- Enxerto. O número de células necessárias dar a um paciente de transplante as melhores chances para enxerto e sobrevida do transplante é baseado no peso, idade e no estado de doença do paciente. Uma unidade de sangue do cordão umbilical pode conter muito poucas células tronco para o tamanho do receptor. Devido ao menor número de células tronco, os transplantes de células tronco do sangue do cordão umbilical enxertam mais lentamente do que as células tronco da medula ou do sangue periférico. Até ocorrer o enxerto, os pacientes estão em risco de desenvolver infecções com risco à vida. Isto significa que os receptores de transplante de sangue do cordão umbilical podem ser vulneráveis a infecções por até um a dois meses mais do que os receptores de células tronco da medula e do sangue periférico.
Após o Tratamento:
O decréscimo na função da medula geralmente começa a ter efeito pelo segundo ou terceiro dia após uma infusão alogênica de células tronco. Você será mantido em um ambiente protegido para reduzir o contato com agentes infecciosos. Geralmente nas duas a quatro semanas após o transplante, o enxerto das células doadas estará visível com o aparecimento de células brancas normais em seu sangue. Você receberá transfusões periódicas de células vermelhas e plaquetas até a função da sua medula ser restaurada pelas células tronco transplantadas.
O seu médico irá monitorá-lo cuidadosamente com exames físicos, exames de bioquímica sérica, estudos de imagem e outros testes para assegurar que o seu coração, pulmões, rins, fígado e outros órgão importantes estejam funcionando normalmente. Você precisará de medicamentos para prevenir a GVHD, além das transfusões de sangue. Se tiver pouco apetite ou diarreia, você pode precisar ser alimentado intravenosamente ou por meio de um tubo duodenal (chamado hiperalimentação) para assegurar que você receba nutrição adequada.
Resultados do Tratamento
Os resultados do tratamento variam entre os pacientes. Terapias com novos tratamentos, progresso no transplante de células tronco, melhor cuidado de suporte e estudos de novos medicamentos em estudos clínicos estão todos contribuindo para melhora nos resultados e na qualidade de vida para pessoas diagnosticadas com cânceres do sangue.
Muitos pacientes com linfoma de Hodgkin são curados após o seu tratamento inicial. Para um pequeno número de pacientes que têm recorrência ou recidiva da doença, o tratamento adicional com quimioterapia, algumas vezes, combinado com o transplante de células tronco, é geralmente bem-sucedido. Um grande número desses pacientes é curado ou apresenta longos períodos livres de doença.
Linfoma de Hodgkin Refratário
Alguns pacientes ainda têm células cancerosas em sua medula óssea após o tratamento para linfoma de Hodgkin. O termo ‘linfoma de Hodgkin refratário’ é usado para descrever uma doença que não entra em remissão (mas pode estar estável) ou que piora nos seis meses desde o último tratamento.
Se tiver linfoma de Hodgkin refratário, você pode ser submetido a quimioterapia de alta dose com transplante de células tronco.
Linfoma de Hodgkin Recidivado
Se o linfoma na sua medula óssea voltar e o número de suas células sanguíneas reduzir após uma remissão de seis meses ou mais, você teve uma recidiva. Você precisará de mais quimioterapia, igual àquela que você recebeu quando foi recém-diagnosticado. O tratamento geralmente dá aos pacientes períodos muito longos livres de doença, e a doença é ainda potencialmente curável.
Um tratamento para pacientes com linfoma de Hodgkin recidivado está apresentado a seguir.
- Brentuximabe vedotina (Adcetris®)
LINFOMA DE HODGKIN INFANTIL
Devido a terapias novas e melhores, as taxas de sobrevida de crianças com câncer têm melhorado dramaticamente durante as últimas décadas. Os cientistas continuam a procurar pelas causas do linfoma infantil para que possam desenvolver melhores tratamentos com menos efeitos colaterais tóxicos.
Tratamento
O diagnóstico de câncer de uma criança pode trazer consigo sentimentos de incerteza para os pais e outros familiares. De repente, você é empurrado para um mundo de mudanças rápidas, com preocupações, medos e incertezas. Você terá que tomar decisões de tratamento enquanto estiver confortando o seu filho – e ao mesmo tempo tentará enfrentar as suas próprias emoções.
O tratamento do seu filho depende de determinados fatores:
- O estágio da doença;
- O subtipo da doença;
- Possíveis fatores de risco que podem ser encontrados durante os exames laboratoriais;
- A taxa de resposta para o tratamento mensurada por técnicas de imagem, como varreduras por tomografia de emissão de pósitrons (PET) e tomografia computadorizada (TC).
O oncologista hematologista (especialista em câncer) do seu filho deve desenvolver um plano de tratamento que limita a quantidade de terapia necessária para atingir a remissão. Certifique-se de perguntar o oncologista sobre possíveis efeitos colaterais e efeitos de longo prazo ao considerar as opções de tratamento.
Adultos em idade fértil e pais de crianças devem pedir aos seus médicos informações sobre como reduzir o risco de infertilidade. Vide a publicação gratuita da LLS sobre Fatos sobre Fertilidade para mais detalhes.
Combinações de Medicamentos Quimioterápicos
Crianças e adultos jovens com linfoma de Hodgkin são geralmente tratados com combinação de quimioterapia e radioterapia de campo envolvido. O principal avanço no tratamento nos últimos tempos é a capacidade dos médicos de desenvolver planos de tratamento que limitam a quantidade de terapia necessária para alcançar a remissão.
As combinações comuns de medicamentos quimioterápicos usadas para tratar crianças e adultos jovens incluem:
- COPP: ciclofosfamida (Cytoxan®), vincristina (Oncovin®), prednisona, procarbazina (Matulane®);
- ABVD: doxorrubicina (Adriamycin®), bleomicina (Blenoxane®), vinblastina (Cytoxan®), dacarbazina (DTIC-Dome®);
- COPP-ABV: Cytoxan, Oncovin, prednisona, Matulane, Adriamicina, Blenoxano, Cytoxan;
- CHOP: Cytoxan, hidroxidaunomicina, Oncovin, prednisone;
- Stanford V: mecloretamina (Mustargen®), Adriamicina, Cytoxan, Oncovin, Blenoxano, etoposida, prednisone.
Estudos Clínicos
Um estudo clínico pode ser uma opção quando se trata de encontrar o tratamento certo para o câncer do seu filho. O seu filho terá acesso a terapias novas ou melhoras em estudo e ainda não disponíveis no mercado. Discuta com o médico do seu filho sobre a possibilidade de participar de um estudo clínico, onde o tratamento é administrado em um ambiente seguro e criteriosamente monitorado.
Sobrevivência e Necessidades de Cuidado à Saúde Especiais
Após o tratamento, a maioria das crianças pode esperar ter vidas plenas e produtivas. Muitos sobreviventes voltam à escola, vão à faculdade, entram para a força de trabalho, casam-se e têm filhos. Você pode considerar um programa de sobrevivência para o seu filho que foca na vida após o câncer. A maioria dos principais hospitais em todo o mundo oferece esses programas.
Cuidado de Acompanhamento
O seu filho deve visitar o pediatra ou médico pelo menos uma vez por ano para um exame físico completo e testes adicionais necessários. O seu oncologista também deve examinar regularmente o seu filho.
As visitas regulares ao médico são encorajadas para:
- Permitir que os médicos avaliem o efeito completo da terapia;
- Detectar e tratar a recorrência da doença;
- Identificar e controlar efeitos de longo prazo e tardios do tratamento.
Efeitos de Longo Prazo e Tardios do Tratamento
Alguns efeitos colaterais do tratamento para câncer, como fadiga, podem durar meses ou anos após a terapia. Algumas condições médicas, como doença cardíaca e outros cânceres podem não aparecer até anos após o final do tratamento. Os efeitos de longo prazo e tardios podem impactar a saúde física mental e cognitiva (função cerebral) do seu filho.
A maioria dos sobreviventes do linfoma infantil não desenvolve efeitos significativos de longo prazo ou tardios do tratamento. No entanto, para alguns pacientes, os efeitos podem variar de leves a graves.
Efeitos de Longo Prazo e Tardios da Quimioterapia
As crianças tratadas para linfoma podem estar em risco aumentado para:
- Fadiga;
- Atraso no crescimento;
- Disfunção da tireoide;
- Perda na audição;
- Um câncer secundário.
Alguns efeitos de longo prazo e tardios se tornam visíveis com a maturação (puberdade), crescimento e o processo normal de envelhecimento. A intervenção precoce e práticas de estilo de vida saudável (não fumar, dieta equilibrada, prática de exercícios, check-ups e acompanhamento regulares) ajudam.
Efeitos de Longo Prazo e Tardios da Radioterapia
As meninas (e também mulheres com menos de 30 anos de idade) que recebem radiação na área das mamas estão em risco para desenvolver câncer de mama 15 a 20 anos após o tratamento. Os meninos sobreviventes do câncer infantil estão em risco de desenvolver um segundo câncer, mas não têm um risco tão alto para desenvolver câncer de mama que as meninas sobreviventes do câncer infantil.
As meninas que receberam radioterapia na área do tórax (mediastinal) devem:
- Realizar autoexames mensais da mama;
- Fazer uma mamografia basal com 25 a 30 anos de idade ou 10 anos após a radioterapia;
- Fazer um exame clínico anual da mama;
- Fazer uma mamografia a cada dois a três anos, dependendo da densidade do tecido mamário.
As meninas e meninos que tiverem recebido radioterapia mediastinal devem fazer o teste basal para a função cardíaca. Isto deve ser seguido pelo teste a cada três a cinco anos após o tratamento ou com mais regularidade se forem encontradas anormalidades.
Volta à Escola
Dificuldades no aprendizado podem começar durante o tratamento ou aparecer meses ou anos depois. Eduque os familiares, amigos, professores e profissionais de saúde sobre os possíveis efeitos de longo prazo e tardios do tratamento do seu filho. Conversar com os professores e profissionais de saúde do seu filho para desenvolver um programa personalizado às suas necessidades que apresente teste basal, acomodações especiais e planejamento de longo prazo.
Os médicos classificam o linfoma de Hodgkin (LH) por estadiamento. O estadiamento auxilia os médicos a prever a extensão da doença e criar um plano de tratamento apropriado. Os médicos usam comumente o Sistema de Estadiamento Ann Arbor Modificado, que categoriza a doença pela sua extensão e sintomas:
Estágios do Linfoma
Estágio I
Envolvimento de um grupo de linfonodo
Estágio II
Envolvimento de dois ou mais grupos de linfonodos do mesmo lado do diafragma (um músculo fino abaixo dos pulmões)
Estágio III
Envolvimento de grupos de linfonodos nos dois lados do diafragma
Estágio IV
Envolvimento de um ou mais órgãos, além dos linfonodos, e possível envolvimento dos linfonodos
Categorias A, B, X e E
Os quatro estágios do LH podem ser divididos em categorias:
- Categoria A: Sem febre, sem sudorese exagerada e sem perda de peso presente;
- Categoria B: Febre, sudorese excessiva e perda de peso presente;
- Categoria X: Doença volumosa (massas grandes de linfócitos) presente;
- Categoria E: O linfoma se espalhou para áreas ou órgãos fora dos linfonodos, ou para tecidos além, mas próximos, das principais áreas linfáticas.
Por exemplo, o estágio IIB indica que o paciente tem:
- Dois locais de linfonodos próximos um do outro com envolvimento da doença (por exemplo, linfonodos aumentados no pescoço e próximo à clavícula, ou no pescoço e na axila);
- Febre, sudorese excessiva e perda de peso.
O seu tratamento depende do seu estágio e categoria. Os pacientes que se enquadrarem na categoria B geralmente precisam de tratamento mais agressivo do que os pacientes da categoria A.
- O que é?
-
O que você deve saber:
- O linfoma de Hodgkin é um tipo de câncer que afeta o sistema linfático;
- O linfoma de Hodgkin é uma das patologias com maiores chances de cura;
- Os hematologistas e oncologistas são especialistas que tratam pessoas que têm linfoma de Hodgkin ou outros tipos de câncer do sangue;
- O tratamento inclui radiação, quimioterapia ou ambos, dependendo dos fatores individuais do paciente.
O que você deve fazer:
- Converse com o seu médico sobre os seus exames e o significado dos resultados;
- Saiba o seu subtipo de linfoma de Hodgkin – subtipos diferentes têm tratamentos diferentes. Fique atento!
Como o Linfoma de Hodgkin se desenvolve?
O linfoma de Hodgkin começa quando uma célula branca (chamada linfócito) sofre uma alteração anormal que a torna uma célula do linfoma.
- As células do linfoma crescem e formam massas, geralmente nos linfonodos, localizados em todo o nosso corpo no sistema linfático;
- As células do linfoma também podem se reunir em outras áreas do corpo onde encontra-se o tecido linfoide;
- O linfoma de Hodgkin é diferenciado de outros tipos de linfoma pela presença de células Reed-Sternberg (que recebeu esse nome pelos cientistas que as identificaram primeiro). Outras células associadas à doença são chamadas de células de Hodgkin.
Se não tratado, as células cancerosas crescem para fora das células brancas normais, e o sistema imunológico não pode deter a infecção de maneira efetiva.
Subtipos do Linfoma de Hodgkin
A maioria das pessoas diagnosticadas com linfoma de Hodgkin tem um dos dois principais tipos da doença, chamados subtipos:
• Linfoma de Hodgkin clássico;
• Linfoma de Hodgkin com predominância linfocitária nodular.
Os subtipos foram classificados pela Organização Mundial de Saúde (OMS). É importante saber o seu subtipo, já que ele tem uma grande importância na determinação do tipo de tratamento que você receberá.
Linfoma de Hodgkin Clássico
Cerca de 95% das pessoas com linfoma de Hodgkin tem o subtipo clássico. O linfoma de Hodgkin clássico é ainda dividido em quatro subtipos:
1) Linfoma de Hodgkin esclerose nodular
- Constitui cerca de 60% de todos os casos de linfoma de Hodgkin;
- Mais comumente diagnosticado em adultos jovens com idade entre 15 e 34 anos;
- Altamente curável;
- Tem algumas anormalidades que podem persistir após o tratamento bem-sucedido, como a formação de pequenos pedaços de tecido cicatrizado inofensivo (fibrose residual).
2) Linfoma de Hodgkin de celularidade mista
- O segundo subtipo mais comum, que constitui 25% de todos os casos de linfoma de Hodgkin;
- Mais comumente diagnosticado em crianças com idade até 14 anos e adultos mais velhos com idade entre 55 e 74 anos;
- Comum em pessoas com transtornos do sistema imunológico, como o vírus da imunodeficiência humana (HIV);
- Um subtipo agressivo, porém altamente curável;
3) Linfoma de Hodgkin de depleção linfocitária
- Constitui cerca de 4% de todos os casos de linfoma de Hodgkin;
- Geralmente tem um panorama relativamente desfavorável quando comparado com outros subtipos de linfoma de Hodgkin;
- Algumas vezes tem o diagnóstico confundido com o linfoma não Hodgkin.
4) Linfoma de Hodgkin clássico rico em linfócitos
- Semelhante ao subtipo de predominância linfocítica nodular, porém tem mais características em comum com o linfoma de Hodgkin clássico.
Linfoma de Hodgkin de Predominância Linfocítica Nodular
O linfoma de Hodgkin de predominância linfocítica nodular (LHPLN) afeta cerca de 5% dos pacientes, em grande parte rapazes. O LHPLN é identificado por determinados fatores:
- As células do LHPLN são células “linfocíticas” e “histolíticas” – diferentes das células de Reed-Sternberg clássicas que sinalizam o linfoma de Hodgkin clássico;
- Os pacientes nem sempre têm sintomas;
- O LHPLN é de crescimento lento (indolente), e as chances de sobrevida de longo prazo são boas;
- Existe um risco de 3% de que o LHPLN se transformará em um linfoma não Hodgkin;
- O tratamento do LHPLN é geralmente diferente da terapia de primeira linha padrão para o linfoma de Hodgkin clássico.
- Fatores de Risco
-
Para a maioria das pessoas que têm linfoma de Hodgkin não existem fatores de risco que expliquem por que eles desenvolveram a doença. Os resultados de determinados estudos sobre as causas do linfoma de Hodgkin não são definitivos:
- Foram conduzidos muitos estudos sobre associações entre o linfoma de Hodgkin e exposições ambientais com resultados pouco claros;
- Embora o vírus de Epstein-Barr (EBV) tenha sido associado a quase metade dos casos de linfoma de Hodgkin, o EBV não foi estabelecido conclusivamente como uma causa;
- A maioria dos casos de linfoma de Hodgkin ocorre em pessoas que não têm fatores de risco identificáveis;
- A maioria das pessoas com fatores de risco identificáveis não desenvolve o linfoma de Hodgkin;
- Os pacientes que têm um histórico de um exame de sangue confirmando mononucleose têm um risco três vezes maior de LH em comparação à população geral;
- As pessoas infectadas com vírus linfocitotrópico de células T humanas (HTLV) ou o vírus da imunodeficiência humana (HIV) também têm probabilidade aumentada de desenvolver o LH;
- Os especialistas constataram que, ocasionalmente, irmãos de pessoas com linfoma de Hodgkin tendem a ter maiores taxas da doença do que as pessoas com irmãos e irmãs que não têm a doença. Embora a ligação não seja comum, os cientistas estão estudando por que o linfoma é mais comum em algumas famílias do que em outras.
- Sintomas
-
O sinal inicial mais comum do linfoma de Hodgkin é o inchaço (aumento) indolor de um ou mais linfonodos. A maioria das pessoas apresenta linfonodos afetados na parte superior do corpo, geralmente no pescoço ou no tórax superior. Algumas vezes, você pode sentir o(s) linfonodo(s) afetado(s) na sua axila, na área do estômago ou na virilha.
Além dos linfonodos inchados, outros sinais e sintomas do linfoma de Hodgkin podem incluir:
- Febre sem uma causa evidente;
- Uma tosse persistente;
- Falta de ar durante a atividade normal;
- Sudorese excessiva, especialmente à noite;
- Cansaço ou falta de energia;
- Perda inexplicada de peso;
- Coceira;
- Dor no linfonodo após consumo de bebida alcoólica;
- Baço com tamanho aumentado.
Alguns sintomas do linfoma de Hodgkin estão associados às outras doenças menos sérias. No entanto, se estiver incomodado com algum dos sintomas acima, não hesite em procurar o seu médico.
- Diagnóstico
-
Testes Diagnósticos
Exames de Imagem:
O seu médico pode pedir exames de imagem se o seu histórico médico e exame físico sugerirem um diagnóstico possível de linfoma de Hodgkin. O seu médico procura por:
- Linfonodos aumentados no tórax ou abdômen ou em ambos;
- Massas tumorais fora dos linfonodos no pulmão, nos ossos ou em outro tecido corporal.
Os exames de imagem podem incluir:
- Uma radiografia do tórax;
- Uma varredura de tomografia computadorizada (TC) do tórax, pelve e abdômen (área do estômago);
- Uma varredura por imagem de ressonância magnética (IRM);
- Uma varredura por tomografia de emissão de pósitrons (PET) ;
- Uma varredura PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo.
Biópsia do Linfonodo:
O diagnóstico do linfoma de Hodgkin geralmente envolve a realização de uma biópsia de linfonodo. Se a biópsia confirmar que você tem a doença, o seu médico realiza testes adicionais para estadiar o linfoma. A finalidade da biópsia do linfonodo é confirmar um diagnósticom, além de identificar o subtipo do seu linfoma de Hodgkin para desenvolver um plano de tratamento.
Exames Laboratoriais para Confirmar um Diagnóstico
Um hematopatologista examina a amostra do seu linfonodo sob um microscópico para procurar identificar as características do linfoma de Hodgkin. Um hematopatologista é um especialista que estuda as doenças de células sanguíneas ao analisar as amostras de sangue e células da medula e outros tecidos.
O hematopatologista pode usar um exame laboratorial chamado imunofenotipagem para analisar a presença de células de Reed-Sternberg e as células de Hodgkin para diferenciar o linfoma de Hodgkin de outros tipos de linfoma e outras condições não cancerosas.
O linfoma de Hodgkin pode ser uma doença de difícil diagnóstico. Você pode querer uma segunda opinião médica por um hematopatologista experiente antes de começar o tratamento. O linfoma de Hodgkin pode ser confundido com alguns tipos de linfoma não Hodgkin. O tratamento apropriado depende de ter o diagnóstico correto.
Testes de Estadiamento
Assim que o seu oncologista hematologista confirmar o diagnóstico do linfoma de Hodgkin, ele irá pedir mais testes para estadiar a sua doença. O estadiamento identifica a extensão da sua doença e onde ela está localizada no seu corpo.
Os testes de estadiamento incluem:
- Exames de sangue;
- Exames da medula óssea;
- Exames de imagem.
Exames de Sangue
Após coletar o seu sangue, ele é enviado a um laboratório para um hemograma completo (CBC) e exames adicionais. O seu sangue é dosado para:
- Níveis de células vermelhas (eritrócitos), células brancas (leucócitos) e plaquetas;
- Níveis séricos de proteína;
- Níveis de ácido úrico;
- Velocidade de hemossedimentação (a velocidade para as células vermelhas se depositarem no fundo de um tubo de ensaio – uma velocidade aumentada pode indicar câncer);
- Função hepática.
Exames da Medula Óssea
O seu médico pode decidir examinar a sua medula óssea para ver se a doença se espalhou. Se a sua doença está em um estágio inicial e alguns sinais e sintomas não apareceram, você pode não precisar fazer o teste.
O teste de medula óssea envolve duas etapas geralmente feitas ao mesmo tempo em um consultório médico ou em um hospital:
- Uma aspiração da medula óssea para remover uma amostra líquida da medula;
- Uma biópsia da medula óssea para remover uma pequena quantidade de osso preenchido com medula;
Exames de Imagem
O seu médico conduz um ou mais exames de imagem, juntamente com um exame físico, para verificar:
- A localização e distribuição dos linfonodos aumentados;
- O efeito da doença, se houver, em outros órgãos, como os pulmões e o fígado;
- Massas tumorais grandes.
Os exames de imagem podem incluir:
- Uma radiografia de tórax;
- Uma varredura de tomografia computadorizada (TC) do tórax, pelve e abdômen (área do estômago);
- Uma varredura por imagem de ressonância magnética (IRM);
- Uma varredura de tomografia de emissão de pósitrons (PET);
- Uma varredura PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo (F-18).
- Tratamento
-
É importante que o seu médico seja experiente no tratamento de pacientes com linfoma de Hodgkin ou trabalhe em consulta com um especialista em linfoma de Hodgkin. Este tipo de especialista é chamado oncologista hematologista.
Para muitas pessoas com linfoma de Hodgkin, iniciar o tratamento os auxilia a focar e seguir em frente buscando a recuperação. Um olhar sobre a taxa de sucesso do tratamento pode ser encorajador: Mais de 75 % de todos os pacientes podem ser curados. A taxa aumenta para 90% para pacientes mais jovens. O linfoma de Hodgkin é considerado uma das formas mais curáveis de câncer.
Tipos de Tratamento
Os médicos usam diversos tipos de abordagens e combinações de tratamento para adultos e crianças com linfoma de Hodgkin, alguns em estágios diferentes:
- Quimioterapia e farmacoterapia;
- Radioterapia de campo envolvido;
- Transplante de células tronco;
- O seu médico pode sugerir que você participe de um estudo clínico. Estudos clínicos podem envolver a terapia com novos medicamentos e novas combinações de medicamentos ou novas abordagens para o transplante de células tronco.
Considerações Pré-Tratamento
Adultos em idade fértil e pais de crianças diagnosticadas com LH devem pedir aos seus médicos informações sobre o possível risco de infertilidade.
Encontrando a Melhor Abordagem de Tratamento:
O objetivo do tratamento para o linfoma de Hodgkin é curar a doença.
O tratamento que o seu médico recomendar é baseado em diversos fatores, incluindo:
- O subtipo da sua doença;
- O estágio e categoria da sua doença;
- Se a sua doença é recidiva ou refratária;
- A sua saúde geral e se você tem alguma condição, como doença cardíaca, doença renal, doença pulmonar, diabetes ou anemia;
- Se você está grávida.
Quando desenvolver um plano de tratamento com o seu médico, assegure-se de discutir:
- Os resultados que você pode esperar com o tratamento;
- Possíveis efeitos colaterais, incluindo efeitos de longo prazo e efeitos tardios;
- A possibilidade de participar de um estudo clínico, onde você terá acesso ao tratamento médico avançado que pode ser mais benéfico a você do que o tratamento padrão.
Você pode achar útil levar alguém próximo a você as suas visitas com o seu médico para apoio, para tomar notas e fazer perguntas de acompanhamento. Uma sugestão é preparar as perguntas que gostaria de fazer quando visitar o seu médico. Você também pode registrar as suas conversas e ouvir com mais atenção ao chegar em casa.
Outras Considerações de Tratamento:
- Se tiver 60 ou mais anos, o seu tratamento pode variar das abordagens padrão. Por exemplo, o seu corpo pode não ser capaz de tolerar os medicamentos quimioterápicos tóxicos ou você pode ter outras enfermidades que são mais comuns à medida que envelhecemos. Esses fatores, entre outros, podem tornar mais complicada a escolha do tratamento;
- Se o seu filho está sendo tratado para linfoma de Hodgkin, a terapia pode diferir ligeiramente daquela para um adulto comum. Vide Linfoma de Hodgkin Infantil.
QUIMIOTERAPIA E TERAPIA FARMACOLÓGICA
Durante a quimioterapia, você recebe medicamentos potentes que devem ser tóxicos o suficiente para danificar ou matar as células do linfoma. Ao mesmo tempo, eles podem afetar as células normais e causar efeitos colaterais.
Os médicos combinam comumente quatro ou mais medicamentos quimioterápicos para tratar o linfoma de Hodgkin. Os medicamentos são normalmente administrados por um cateter (um tubo fino e flexível ou linha intravenosa) cirurgicamente colocada em uma veia, normalmente no seu tórax superior.
Medicamentos Quimioterápicos usados para o Linfoma de Hodgkin:
Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. Combinar tipos de medicamentos pode aumentar a sua efetividade. As combinações têm geralmente o nome das abreviações para a primeira letra usada na mistura. As combinações mais comuns e efetivas usadas incluem:
- ABVD: doxorrubicina (Adriamycin®), bleomicina (Blenoxane®), vinblastina (Cytoxan®), dacarbazina (DTIC-Dome®);
- BEACOPP: Blenoxano, etoposida (Etopophos®, Toposar®, VePesid®, VP-16), Adriamicina, ciclofosfamida (Cytoxan®), vincristina (Oncovin®), procarbazina (Matulane®), prednisona;
- Stanford V: mecloretamina (Mustargen®), Adriamicina, Cytoxan, Oncovin, Blenoxano, etoposida, prednisone.
ABVD é usado para os estágios I e II do linfoma de Hodgkin (combinado com a radioterapia de campo envolvido) e para os estágios III e IV (por um período de tempo mais longo). ABVD é a primeira escolha de tratamento para a maioria dos pacientes adultos devido a sua efetividade e reputação para produzir efeitos colaterais menos tóxicos do que aqueles de outras combinações de medicamentos, que têm um maior risco de infertilidade ou leucemia. A taxa de cura para os estágios I e II é de mais de 95%.
Os pacientes nos estágios I e II geralmente recebem até dois ciclos de ABVD, com várias semanas de intervalo, seguido por radioterapia de campo envolvido com uma dose reduzida de radiação. Se eles estiverem em alto risco, eles geralmente são submetidos a quatro a seis ciclos antes da radiação. O tratamento pode durar de seis a oito meses.
Os pacientes nos estágios III e IV são tratados com seis a oito cursos da terapia de combinação, como ABVD ou BEACOPP. BEACOPP possui uma boa taxa de cura, porém tem um risco pequeno de leucemia ou de um segundo câncer, o que o faz um tratamento menos comum nos Estados Unidos e no Canadá. Os médicos podem usar BEACOPP para o linfoma de Hodgkin agressivo e avançado.
Stanford V é outra combinação de medicamentos que os médicos usam com ou sem a radioterapia para a doença avançada. Ela é administrada por um tempo mais curto, porém mais frequente do que ABVD.
RADIOTERAPIA DE CAMPO ENVOLVIDO
Uma combinação de radioterapia e quimioterapia provou ser uma abordagem efetiva de duas vertentes para tratar os estágios I e II do linfoma de Hodgkin. Os pacientes que têm doença mais disseminada (estágios III e IV e categoria B) são geralmente tratados com a quimioterapia isolada.
A radioterapia de campo envolvido com a quimioterapia – também conhecida como terapia de modalidade combinada – envolve duas principais etapas realizadas em momentos separados, geralmente em um centro ambulatorial de clínica oncológica:
1 Medicamentos quimioterápicos são administrados para matar as células vizinhas do linfoma;
2 Radiação é aplicada por raios de alta energia para encolher massas de células do linfoma.
Você pode precisar permanecer no hospital por um período curto durante o tratamento se a sua terapia for particularmente intensiva e levar à infecção ou decréscimos prolongados ou graves nos hemogramas.
Durante a radioterapia de campo envolvido, você recebe radiação somente nas áreas do seu corpo afetadas pelo linfoma de Hodgkin. Uma máquina chamada acelerador linear, ou linac, aplica feixe de radiação a área(s) alvo(s) do seu corpo enquanto você está deitado em uma mesa móvel. Partes do seu corpo não afetadas pelo linfoma de Hodgkin, como os órgãos reprodutores, são protegidos para ajudar a reduzir os efeitos colaterais do tratamento. O procedimento em si é indolor, embora algumas pessoas possam sentir desconforto ao permanecer na mesma posição por vários minutos durante a sessão. Vários dias depois, a sua radioterapia é seguida pela quimioterapia.
Tratamento do Hodgkin com Predominância Linfocítica Nodular:
Uma exceção ao uso do tratamento combinado de primeira linha da radioterapia e da quimioterapia é o tratamento para o subtipo do linfoma e Hodgkin de predominância linfocítica nodular (LHPLN). No seu lugar, a radioterapia é usada de maneira isolada e não combinada com a quimioterapia. O LHPLN é uma forma de crescimento lento da doença que é geralmente diagnosticada durante o estágio I, resultando em uma taxa de sobrevida próxima a 100%. Portanto, é importante não tratar demasiadamente a doença.
TRANSPLANTE DE CÉLULAS TRONCO
O transplante de células tronco não é recomendado para o tratamento inicial de pacientes que têm linfoma de Hodgkin, porém pode ser usado para tratar pacientes na primeira recidiva. Podem ser usados dois tipos de transplante de células tronco:
- Transplante autólogo de células tronco, que usa as suas próprias células tronco.
- Transplante alogênico de células tronco, que usa as células tronco de um doador compatível. O transplante autólogo apresenta menos risco aos pacientes do que o transplante alogênico.
A efetividade das terapias para pacientes recém-diagnosticados tem reduzido a necessidade para o transplante de células tronco. No entanto, o transplante autólogo de células tronco pode curar alguns pacientes, cujo linfoma de Hodgkin retornou após um período sem sinal da doença. Os pesquisadores estão estudando em estudos clínicos o transplante alogênico de células tronco padrão e de intensidade reduzida para tratar alguns pacientes com linfoma de Hodgkin que têm um doador compatível. Para tratar ou curar o seu câncer do sangue, o seu médico pode sugerir doses muito altas de quimioterapia e um transplante autólogo de células tronco usando as suas próprias células tronco.
TRANSPLANTE AUTÓLOGO DE CÉLULAS TRONCO
Como Ele Funciona?
A sua medula é coletada enquanto você está em remissão. Você deve primeiro ser submetido a terapia condicionante na forma de quimioterapia ou radioterapia de alta intensidade para controlar a doença e reduzir o número de células com câncer na sua medula e sangue. As suas próprias células tronco são “coletadas”, ou recuperadas, do seu corpo e congeladas. Após receber a quimioterapia ou radioterapia intensiva, as suas células são devolvidas ao seu corpo por infusão através de uma veia.
O objetivo de um transplante autólogo de células tronco é restaurar a capacidade do corpo de produzir células sanguíneas normais após a quimioterapia ou radioterapia de alta dose. Diferente do transplante alogênico de células tronco este procedimento:
- Não oferece os benefícios do efeito enxerto versus tumor (GVL) quando as células sadias do doador atacam as células cancerosas;
- Não tem o risco da doença do enxerto versus hospedeiro.
O transplante autólogo de células tronco pode causar alguns efeitos adversos, em grande parte da terapia condicionante de alta intensidade:
- Decréscimo acentuado no hemograma pode levar a infecção e necessidade de transfusões de células vermelhas (para tratar a anemia) e plaquetas (para prevenir ou tratar a hemorragia);
- Alguns medicamentos condicionantes podem causar complicações, como pneumonia intersticial, como resultado da infecção ou dano da terapia intensive;
- Úlceras orais dolorosas (mucosite oral) podem se desenvolver que, em casos raros, podem impedir que você coma ou beba. O fator de crescimento de células cutâneas, palifermina (Kepivance®), e outras medidas podem prevenir ou reduzir os efeitos da mucosite oral.
TRANSPLANTE ALOGÊNICO DE CÉLULAS TRONCO
O transplante alogênico de células tronco envolve a transferência de células tronco de uma pessoa sadia (o doador) para o seu corpo após a quimioterapia ou radioterapia de alta intensidade.
O transplante alogênico de células tronco é usado para curar alguns pacientes que:
- Estão em alto risco de recidiva;
- Não respondem completamente ao tratamento;
- Recidiva após tratamento prévio bem sucedido.
O transplante alogênico de células tronco pode ser um procedimento de alto risco. Os regimes de alto condicionamento são destinados para comprometer severamente ou completamente a sua capacidade de produzir células tronco e você provavelmente apresentará efeitos colaterais durante os dias que receber a radioterapia ou quimioterapia condicionante de alta dose. Os objetivos da terapia de alto condicionamento são:
- Tratar de maneira intensiva as células cancerosas restantes, tornando assim a recorrência do câncer menos provável;
- Inativar o sistema imunológico para reduzir as chances de rejeição do enxerto de células tronco;
- Permitir que as células do doador cheguem até a medula (enxerto), produzam células sanguíneas e proporcionem o efeito enxerto versus tumor.
Possíveis Efeitos Adversos
O sistema imunológico e o sistema sanguíneo são proximamente ligados e não podem ser separados um do outro. Por causa disso, o transplante alogênico permite que não apenas o sistema sanguíneo do doador, mas também o seu sistema imunológico, sejam transferidos. Consequentemente, são possíveis os seguintes efeitos adversos:
- Rejeição imunológica pelo receptor das células tronco doadas (efeito hospedeiro versus enxerto);
- Reação imunológica pelas células doadoras contra os tecidos do receptor (doença do enxerto versus hospedeiro [GVHD]).
A reação imunológica, ou GVHD, é tratada com a administração de medicamentos ao paciente após o transplante que reduzem a capacidade das células imunológicas doadas de atacar e lesionar os tecidos do paciente. Vide Doença do Enxerto Versus Hospedeiro. Os transplantes alogênicos de células tronco para pacientes que têm mais idade ou têm saúde geral debilitada são relativamente incomuns. Isto porque a terapia condicionante no pré-transplante é geralmente não bem tolerada por esses pacientes, especialmente aqueles com funcionamento inadequado dos órgãos internos. No entanto, transplantes alogênicos de células tronco de intensidade reduzida podem ser um tratamento apropriado para alguns pacientes mais velhos ou mais enfermos.
Depleção de Linfócitos T
Um objetivo do transplante alogênico de células tronco é fazer com que os linfócitos T no sangue ou medula do doador se estabeleçam (enxertam) e cresçam na medula do paciente. Às vezes, os linfócitos T atacam as células cancerosas. Quando isto acontece, é chamado de efeito enxerto versus tumor (GVT) (também chamado efeito enxerto versus câncer). O ataque torna menos provável que a doença retorne. Este efeito é mais comum em leucemias mieloides do que é em outros cânceres de sangue.
Infelizmente, os linfócitos T são as mesmas células que causam a doença do enxerto versus hospedeiro (GVHD). Devido a este efeito colateral sério e, algumas vezes, de risco à vida, os médicos, em determinados casos, querem reduzir o número de linfócitos T a serem infundidos com as células de tronco. Este procedimento, chamado depleção de linfócitos T, está sendo atualmente estudado pelos pesquisadores. A técnica envolve tratar as células tronco coletadas para transplante com agentes que reduzem o número de linfócitos T. O objetivo da depleção de linfócitos T é reduzir a incidência e a gravidade da GVHD. No entanto, ela também pode causar o aumento nas taxas de rejeição ao enxerto, reduzir o efeito do GVT e a uma recuperação imunológica mais lenta. Os médicos devem ser cuidadosos sobre o número de linfócitos T removidos ao utilizar esta técnica.
Seleção das Células Tronco:
A seleção das células tronco é outra técnica que está sendo estudada em estudos clínicos que pode reduzir o número de linfócitos T que um paciente recebe. Devido às características específicas da camada externa das células tronco, os médicos podem remover seletivamente as células tronco de uma mistura celular. Esta técnica produz um grande número de células tronco e menor de outras células, incluindo linfócitos T.
Encontrando um Doador:
Se estiver considerando o transplante alogênico de células tronco, você precisará de um doador de medula óssea. Em primeiro lugar, você e seus irmãos, se houver, terão o sangue ou uma raspagem do lado de dentro da bochecha testados para determinar o tipo de tecido. Um irmão tem o potencial de ser o mais proximamente compatível com você, pois vocês dois receberam genes dos mesmos pais.
Um técnico de laboratório examina a superfície das células do tecido da amostra para identificar as proteínas que proporcionam a todos o seu próprio tipo de tecido, chamado antígenos leucocitários humanos (HLAs). Se o HLA das células do doador for idêntico (de gêmeos idênticos, por exemplo) ou semelhantes (como aqueles de irmãos), é muito provável que o transplante seja bem-sucedido. Em média, você tem uma entre quatro chances de ter o mesmo tipo HLA de um irmão. Muitos pacientes, no entanto, não têm um irmão com o mesmo tipo de tecido.
Se um irmão ou irmã não for um doador compatível, o seu médico fará uma busca nos registros de doadores voluntários, como no Programa Nacional de Doadores de Medula, por um doador sem parentesco que seja compatível com o seu tipo de tecido. Um doador que não tem parentesco com você, mas que tem um tipo de tecido semelhante é chamado doador compatível não relacionado (MUD).
Coletando Células Tronco
As células tronco para transplante são coletadas de três fontes:
- Sangue;
- Medula óssea;
- Sangue da placenta e do cordão umbilical.
Antes das células tronco serem coletadas do sangue ou da medula óssea, o doador deve passar por um exame físico completo e exames de sangue para vírus da hepatite, doença da imunodeficiência humana (HIV) e outros agentes ou vírus infecciosos.
Sangue
A fonte mais comum de células tronco para transplante é o sangue periférico, o sangue que flui por nossas veias e artérias.
A medula óssea normalmente libera um número pequeno de células tronco do sangue periférico (PBSCs) para a corrente sanguínea. Para obter PBSCs suficientes para um transplante, o doador toma um fator de crescimento de células brancas, como o medicamento fator de estimulação de colônia de granulócitos (G-CSF), que aumenta o número de células tronco ao retirá-las da medula e colocá-las na corrente sanguínea. Quando as próprias células tronco de um paciente são usadas, G-CSF e a quimioterapia usada para tratar a doença geralmente aumentam as PBSCs. Em pacientes que têm mieloma e linfoma não Hodgkin, o medicamento plerixafor (Mozobil®) pode ser usado para mobilizar as suas próprias células tronco.
O sangue é removido do doador e as células coletadas usando um processo chamado aférese, que envolve colocar uma agulha na veia do doador, geralmente no braço, como ao fazer um exame de sangue. O sangue do doador é bombeado por meio de uma máquina de aférese, que separa o sangue em quatro compartimentos: células vermelhas (eritrócitos), plasma, células brancas (leucócitos) e plaquetas. As células brancas e plaquetas, que contêm as células tronco, são coletadas, ao passo que as células vermelhas e o plasma são devolvidas ao doador. Pode levar uma a duas sessões de aférese para coletar sangue suficiente de um MUD. Se você for o seu próprio doador, pode levar mais que duas sessões.
Medula Óssea
Se as células tronco suficientes não puderem ser recuperadas pela aférese, elas podem ser retiradas diretamente da medula óssea. Isto requer que o doador se submeta a um pequeno procedimento cirúrgico ambulatorial. Enquanto o doador está sob anestesia, o cirurgião insere uma agulha oca nos ossos pélvicos do doador logo abaixo da cintura e remove o líquido da medula. Isto é feito uma série de vezes até que vários litros de medula sejam coletados. O doador pode permanecer no hospital por seis a oito horas após o procedimento para se recuperar da anestesia e da dor aguda nos locais de inserção da agulha. Ele ou ela pode sentir alguma dor na região lombar das costas por alguns dias depois do procedimento. O corpo do doador repõe naturalmente a medula logo após o procedimento. As células vermelhas são também removidas, e o doador pode apresentar anemia, que é geralmente tratada com suplementos de ferro.
A medula óssea que é removida (coletada) passa por uma série de filtros para remover os fragmentos de osso ou tecido e é então colocada em uma bolsa plástica, a partir da qual pode ser infundida na veia do receptor. A medula é geralmente fornecida ao paciente dentro de algumas horas e quase sempre dentro de 24 horas. Se necessário, no entanto, a medula pode ser congelada e armazenada e permanecerá adequada para uso por anos. Se o transplante for autólogo, a medula é geralmente congelada enquanto o paciente é submetido à quimioterapia intensiva.
Sangue da Placenta e do Cordão Umbilical
Uma fonte rica em células tronco para pacientes com câncer do sangue são as células tronco armazenadas coletadas do cordão umbilical e da placenta após o nascimento de um bebê, chamado unidade de sangue do cordão umbilical. Os pais podem escolher ter a unidade de sangue do cordão umbilical coletada após o parto. Os pais sadios com crianças sadias e sem candidato a transplante na família podem escolher doar o sangue do cordão umbilical do seu recém-nascido para bancos de sangue do cordão umbilical ou programas de pesquisa em hospitais participantes. Pais com uma criança ou parente que pode ser um candidato para transplante devem discutir com o seu médico sobre os possíveis benefícios de guardar o sangue do cordão umbilical do seu recém-nascido para possível uso na família.
Vantagens do Sangue do Cordão Umbilical
As vantagens de usar as células tronco do sangue do cordão umbilical, ao invés das células tronco da medula do doador incluem:
- Disponibilidade. O sangue do cordão umbilical armazenado em um banco público de sangue do cordão umbilical passou por uma pré-seleção, teste e está congelado e pronto para uso; por outro lado, pode levar vários meses para encontrar e confirmar um doador de medula ou sangue periférico;
- Compatibilidade de HLA. Uma próxima compatibilidade entre o paciente e a unidade de sangue do cordão umbilical pode melhorar o resultado;
- Doença do enxerto versus hospedeiro. Pacientes que são submetidos a transplante de células tronco do sangue do cordão umbilical são menos propensos a desenvolver a doença do enxerto versus hospedeiro (GVHD) ou apresentar menos complicações graves da GVHD do que pacientes que têm transplantes de medula óssea ou do sangue periférico;
- Diversidade. As unidades do sangue do cordão umbilical doadas coletadas de hospitais onde partos de bebês com ascendências étnicas variadas têm números bastante representativos têm o potencial de fornecer uma fonte de células tronco com diversidade racial;
- Transmissão de doenças infecciosas. Os transplantes de célula tronco do sangue do cordão umbilical têm menos risco de transmissão de doenças infecciosas de transmissão sanguínea em comparação às células tronco do sangue periférico ou de medula de doadores relacionados ou não relacionados.
Desvantagens do Uso do Sangue do Cordão Umbilical
Também pode haver desvantagens ao usar células tronco do cordão umbilical:
- Dados clínicos. Doenças genéticas podem estar presentes, mas não visíveis no momento do nascimento, podendo ser transplantadas a um paciente por meio das células tronco do sangue do cordão umbilical do doador. Os procedimentos para detectar esta possibilidade requerem o acompanhamento até o bebê doador ter meses ou até mesmo anos de vida, e esse tipo de acompanhamento tem provado ser difícil. Uma solução parcial usada por muitos bancos públicos de sangue do cordão umbilical é obter um histórico de saúde detalhado de possíveis doadores antes da coleta do sangue do cordão umbilical — como em procedimentos padrão usados para selecionar doadores voluntários de sangue;
- Armazenamento. Os pesquisadores não sabem por quanto tempo o sangue do cordão umbilical pode ser congelado e armazenado antes de perder a sua efetividade. No entanto, as amostras de sangue do cordão umbilical têm sido conservadas por até 10 anos e ainda foram transplantadas com sucesso;
- Enxerto. O número de células necessárias dar a um paciente de transplante as melhores chances para enxerto e sobrevida do transplante é baseado no peso, idade e no estado de doença do paciente. Uma unidade de sangue do cordão umbilical pode conter muito poucas células tronco para o tamanho do receptor. Devido ao menor número de células tronco, os transplantes de células tronco do sangue do cordão umbilical enxertam mais lentamente do que as células tronco da medula ou do sangue periférico. Até ocorrer o enxerto, os pacientes estão em risco de desenvolver infecções com risco à vida. Isto significa que os receptores de transplante de sangue do cordão umbilical podem ser vulneráveis a infecções por até um a dois meses mais do que os receptores de células tronco da medula e do sangue periférico.
Após o Tratamento:
O decréscimo na função da medula geralmente começa a ter efeito pelo segundo ou terceiro dia após uma infusão alogênica de células tronco. Você será mantido em um ambiente protegido para reduzir o contato com agentes infecciosos. Geralmente nas duas a quatro semanas após o transplante, o enxerto das células doadas estará visível com o aparecimento de células brancas normais em seu sangue. Você receberá transfusões periódicas de células vermelhas e plaquetas até a função da sua medula ser restaurada pelas células tronco transplantadas.
O seu médico irá monitorá-lo cuidadosamente com exames físicos, exames de bioquímica sérica, estudos de imagem e outros testes para assegurar que o seu coração, pulmões, rins, fígado e outros órgão importantes estejam funcionando normalmente. Você precisará de medicamentos para prevenir a GVHD, além das transfusões de sangue. Se tiver pouco apetite ou diarreia, você pode precisar ser alimentado intravenosamente ou por meio de um tubo duodenal (chamado hiperalimentação) para assegurar que você receba nutrição adequada.
Resultados do Tratamento
Os resultados do tratamento variam entre os pacientes. Terapias com novos tratamentos, progresso no transplante de células tronco, melhor cuidado de suporte e estudos de novos medicamentos em estudos clínicos estão todos contribuindo para melhora nos resultados e na qualidade de vida para pessoas diagnosticadas com cânceres do sangue.
Muitos pacientes com linfoma de Hodgkin são curados após o seu tratamento inicial. Para um pequeno número de pacientes que têm recorrência ou recidiva da doença, o tratamento adicional com quimioterapia, algumas vezes, combinado com o transplante de células tronco, é geralmente bem-sucedido. Um grande número desses pacientes é curado ou apresenta longos períodos livres de doença.
Linfoma de Hodgkin Refratário
Alguns pacientes ainda têm células cancerosas em sua medula óssea após o tratamento para linfoma de Hodgkin. O termo ‘linfoma de Hodgkin refratário’ é usado para descrever uma doença que não entra em remissão (mas pode estar estável) ou que piora nos seis meses desde o último tratamento.
Se tiver linfoma de Hodgkin refratário, você pode ser submetido a quimioterapia de alta dose com transplante de células tronco.
Linfoma de Hodgkin Recidivado
Se o linfoma na sua medula óssea voltar e o número de suas células sanguíneas reduzir após uma remissão de seis meses ou mais, você teve uma recidiva. Você precisará de mais quimioterapia, igual àquela que você recebeu quando foi recém-diagnosticado. O tratamento geralmente dá aos pacientes períodos muito longos livres de doença, e a doença é ainda potencialmente curável.
Um tratamento para pacientes com linfoma de Hodgkin recidivado está apresentado a seguir.
- Brentuximabe vedotina (Adcetris®)
LINFOMA DE HODGKIN INFANTIL
Devido a terapias novas e melhores, as taxas de sobrevida de crianças com câncer têm melhorado dramaticamente durante as últimas décadas. Os cientistas continuam a procurar pelas causas do linfoma infantil para que possam desenvolver melhores tratamentos com menos efeitos colaterais tóxicos.
Tratamento
O diagnóstico de câncer de uma criança pode trazer consigo sentimentos de incerteza para os pais e outros familiares. De repente, você é empurrado para um mundo de mudanças rápidas, com preocupações, medos e incertezas. Você terá que tomar decisões de tratamento enquanto estiver confortando o seu filho – e ao mesmo tempo tentará enfrentar as suas próprias emoções.
O tratamento do seu filho depende de determinados fatores:
- O estágio da doença;
- O subtipo da doença;
- Possíveis fatores de risco que podem ser encontrados durante os exames laboratoriais;
- A taxa de resposta para o tratamento mensurada por técnicas de imagem, como varreduras por tomografia de emissão de pósitrons (PET) e tomografia computadorizada (TC).
O oncologista hematologista (especialista em câncer) do seu filho deve desenvolver um plano de tratamento que limita a quantidade de terapia necessária para atingir a remissão. Certifique-se de perguntar o oncologista sobre possíveis efeitos colaterais e efeitos de longo prazo ao considerar as opções de tratamento.
Adultos em idade fértil e pais de crianças devem pedir aos seus médicos informações sobre como reduzir o risco de infertilidade. Vide a publicação gratuita da LLS sobre Fatos sobre Fertilidade para mais detalhes.
Combinações de Medicamentos Quimioterápicos
Crianças e adultos jovens com linfoma de Hodgkin são geralmente tratados com combinação de quimioterapia e radioterapia de campo envolvido. O principal avanço no tratamento nos últimos tempos é a capacidade dos médicos de desenvolver planos de tratamento que limitam a quantidade de terapia necessária para alcançar a remissão.
As combinações comuns de medicamentos quimioterápicos usadas para tratar crianças e adultos jovens incluem:
- COPP: ciclofosfamida (Cytoxan®), vincristina (Oncovin®), prednisona, procarbazina (Matulane®);
- ABVD: doxorrubicina (Adriamycin®), bleomicina (Blenoxane®), vinblastina (Cytoxan®), dacarbazina (DTIC-Dome®);
- COPP-ABV: Cytoxan, Oncovin, prednisona, Matulane, Adriamicina, Blenoxano, Cytoxan;
- CHOP: Cytoxan, hidroxidaunomicina, Oncovin, prednisone;
- Stanford V: mecloretamina (Mustargen®), Adriamicina, Cytoxan, Oncovin, Blenoxano, etoposida, prednisone.
Estudos Clínicos
Um estudo clínico pode ser uma opção quando se trata de encontrar o tratamento certo para o câncer do seu filho. O seu filho terá acesso a terapias novas ou melhoras em estudo e ainda não disponíveis no mercado. Discuta com o médico do seu filho sobre a possibilidade de participar de um estudo clínico, onde o tratamento é administrado em um ambiente seguro e criteriosamente monitorado.
Sobrevivência e Necessidades de Cuidado à Saúde Especiais
Após o tratamento, a maioria das crianças pode esperar ter vidas plenas e produtivas. Muitos sobreviventes voltam à escola, vão à faculdade, entram para a força de trabalho, casam-se e têm filhos. Você pode considerar um programa de sobrevivência para o seu filho que foca na vida após o câncer. A maioria dos principais hospitais em todo o mundo oferece esses programas.
Cuidado de Acompanhamento
O seu filho deve visitar o pediatra ou médico pelo menos uma vez por ano para um exame físico completo e testes adicionais necessários. O seu oncologista também deve examinar regularmente o seu filho.
As visitas regulares ao médico são encorajadas para:
- Permitir que os médicos avaliem o efeito completo da terapia;
- Detectar e tratar a recorrência da doença;
- Identificar e controlar efeitos de longo prazo e tardios do tratamento.
Efeitos de Longo Prazo e Tardios do Tratamento
Alguns efeitos colaterais do tratamento para câncer, como fadiga, podem durar meses ou anos após a terapia. Algumas condições médicas, como doença cardíaca e outros cânceres podem não aparecer até anos após o final do tratamento. Os efeitos de longo prazo e tardios podem impactar a saúde física mental e cognitiva (função cerebral) do seu filho.
A maioria dos sobreviventes do linfoma infantil não desenvolve efeitos significativos de longo prazo ou tardios do tratamento. No entanto, para alguns pacientes, os efeitos podem variar de leves a graves.
Efeitos de Longo Prazo e Tardios da Quimioterapia
As crianças tratadas para linfoma podem estar em risco aumentado para:
- Fadiga;
- Atraso no crescimento;
- Disfunção da tireoide;
- Perda na audição;
- Um câncer secundário.
Alguns efeitos de longo prazo e tardios se tornam visíveis com a maturação (puberdade), crescimento e o processo normal de envelhecimento. A intervenção precoce e práticas de estilo de vida saudável (não fumar, dieta equilibrada, prática de exercícios, check-ups e acompanhamento regulares) ajudam.
Efeitos de Longo Prazo e Tardios da Radioterapia
As meninas (e também mulheres com menos de 30 anos de idade) que recebem radiação na área das mamas estão em risco para desenvolver câncer de mama 15 a 20 anos após o tratamento. Os meninos sobreviventes do câncer infantil estão em risco de desenvolver um segundo câncer, mas não têm um risco tão alto para desenvolver câncer de mama que as meninas sobreviventes do câncer infantil.
As meninas que receberam radioterapia na área do tórax (mediastinal) devem:
- Realizar autoexames mensais da mama;
- Fazer uma mamografia basal com 25 a 30 anos de idade ou 10 anos após a radioterapia;
- Fazer um exame clínico anual da mama;
- Fazer uma mamografia a cada dois a três anos, dependendo da densidade do tecido mamário.
As meninas e meninos que tiverem recebido radioterapia mediastinal devem fazer o teste basal para a função cardíaca. Isto deve ser seguido pelo teste a cada três a cinco anos após o tratamento ou com mais regularidade se forem encontradas anormalidades.
Volta à Escola
Dificuldades no aprendizado podem começar durante o tratamento ou aparecer meses ou anos depois. Eduque os familiares, amigos, professores e profissionais de saúde sobre os possíveis efeitos de longo prazo e tardios do tratamento do seu filho. Conversar com os professores e profissionais de saúde do seu filho para desenvolver um programa personalizado às suas necessidades que apresente teste basal, acomodações especiais e planejamento de longo prazo.
- Estadiamento
-
Os médicos classificam o linfoma de Hodgkin (LH) por estadiamento. O estadiamento auxilia os médicos a prever a extensão da doença e criar um plano de tratamento apropriado. Os médicos usam comumente o Sistema de Estadiamento Ann Arbor Modificado, que categoriza a doença pela sua extensão e sintomas:
Estágios do Linfoma
Estágio I
Envolvimento de um grupo de linfonodo
Estágio II
Envolvimento de dois ou mais grupos de linfonodos do mesmo lado do diafragma (um músculo fino abaixo dos pulmões)
Estágio III
Envolvimento de grupos de linfonodos nos dois lados do diafragma
Estágio IV
Envolvimento de um ou mais órgãos, além dos linfonodos, e possível envolvimento dos linfonodos
Categorias A, B, X e E
Os quatro estágios do LH podem ser divididos em categorias:
- Categoria A: Sem febre, sem sudorese exagerada e sem perda de peso presente;
- Categoria B: Febre, sudorese excessiva e perda de peso presente;
- Categoria X: Doença volumosa (massas grandes de linfócitos) presente;
- Categoria E: O linfoma se espalhou para áreas ou órgãos fora dos linfonodos, ou para tecidos além, mas próximos, das principais áreas linfáticas.
Por exemplo, o estágio IIB indica que o paciente tem:
- Dois locais de linfonodos próximos um do outro com envolvimento da doença (por exemplo, linfonodos aumentados no pescoço e próximo à clavícula, ou no pescoço e na axila);
- Febre, sudorese excessiva e perda de peso.
O seu tratamento depende do seu estágio e categoria. Os pacientes que se enquadrarem na categoria B geralmente precisam de tratamento mais agressivo do que os pacientes da categoria A.
Linfoma é um tipo de câncer que se inicia nas células que fazem parte do sistema imunológico do nosso corpo – o Sistema linfático. O linfoma é um câncer do sangue e é a patologia que tem maiores chances de CURA. É importante saber qual o tipo de linfoma você tem, pois cada tipo tem uma forma de tratamento e prognóstico. Existem dois tipos principais de linfoma: o LINFOMA HODGKIN (LH) e o LINFOMA NÃO-HODGKIN (LNH). Pergunte ao médico o seu tipo de linfoma e fique atento ao tratamento ideal!
O que é?
- É um tipo de câncer que afeta o sistema linfático;
- Geralmente se desenvolve nos linfonodos e nos tecidos linfáticos. Em alguns casos, o LNH envolve a medula óssea e o sangue;
- Não é apenas uma doença – é, na realidade, um grupo diverso de cânceres do sangue que compartilham uma única característica em como eles se desenvolvem;
- O LNH possui muitos subtipos diferentes que são indolentes (de crescimento lento) ou agressivo (crescimento rápido).
O Que Você Deve Saber:
- Os hematologistas e oncologistas são especialistas que tratam pessoas que têm LNH ou outros tipos de câncer do sangue;
- O tratamento de pessoas que têm o LNH pode incluir a terapia farmacológica e a radioterapia;
- É importante saber o seu subtipo de LNH;
- Procure tratamento em um centro de câncer em que os médicos são experientes no tratamento de pacientes com linfoma;
- Converse com o seu médico sobre seus testes diagnósticos e o significado dos resultados;
- Assegure que você saiba o seu subtipo de LNH – subtipos diferentes têm tratamentos diferentes.
Como o LNH se Desenvolve?
O LNH geralmente começa com uma alteração anormal em uma célula branca em um linfonodo ou tecido linfoide chamado linfócito. Pode começar em um de três tipos principais de linfócitos:
- Linfócitos B (células B), que produzem anticorpos para ajudar a combater infecções;
- Linfócitos T (células T), que têm diversas funções, incluindo auxiliar os linfócitos B a produzir anticorpos;
- Células ‘natural killer’ (NK), que atacam as células infectadas com vírus ou células tumorais
Cerca de 85% dos casos de LNH começam nas células B. O seu médico planeja o seu tratamento de acordo com o tipo de célula em que o seu LNH se desenvolveu.
O linfócito anormal cresce fora de controle e produz mais células anormais como ele.
- Esses linfócitos anormais (células do linfoma) se acumulam e formam massas (tumores). Se o LNH não for tratado, as células cancerosas se acumulam para fora das células brancas normais, e o sistema imunológico não pode deter a infecção de modo efetivo;
- O LNH que se desenvolve ou se dissemina para outras áreas do corpo em que o tecido linfoide é encontrado, como o baço, o trato digestivo e a medula óssea é chamado linfoma extranodal primário;
- O LNH é classificado em mais de 30 subtipos diferentes. Os médicos classificam os subtipos de LNH em categorias que descrevem com que rapidez ou lentidão a doença está progredindo:
- LNH agressivo;
- LNH indolente (crescimento lento).
SUBTIPOS DO LNH
O linfoma não Hodgkin (LNH) possui cerca de 60 subtipos classificados pela Organização Mundial de Saúde (OMS). É importante saber o seu subtipo, já que ele representa uma parte importante na determinação do tipo de tratamento que você receberá. Você deve considerar obter uma segunda opinião de um hematopatologista sobre seu diagnóstico.
Os subtipos de LNH são classificados por determinados fatores, como o tipo de linfócito em que eles se desenvolvem. Os dois principais subtipos são:
- linfoma de células B;
- linfoma de células T e de células ‘natural killer’ (NK).
A maioria das pessoas (85 por cento) tem o tipo de linfoma de células B. Uma pequena porcentagem de pessoas tem um tipo de LNH que se enquadra em um terceiro grupo: transtornos linfoproliferativos associados à imunodeficiência.
Alguns dos nomes de subtipos se relacionam às áreas dos linfonodos (“folículo,” “manto” e zonas “marginais”) que eles parecem se originar.
Estão listados abaixo alguns subtipos de linfomas de células B e células T e NK. O subtipo mais comum é o linfoma difuso de grandes células B (DLBCL), que constitui cerca de 30 por cento de todos os casos de LNH nos Estados Unidos.
Subtipos de Linfoma de Células B
- Linfoma de Burkitt – leucemia de Burkitt;
- Linfoma do sistema nervoso central (SNC);
- Linfoma difuso de grandes células B;
- Linfoma extranodal da zona marginal de células B;
- Linfoma folicular;
- Linfoma intravascular de grandes células B;
- Granulomatose linfomatoide;
- Linfoma linfoplasmacítico – macroglobulinemia de Waldenstrom;
- Linfoma de células do manto. (Vide ficha técnica gratuita da LLS, Fatos sobre o Linfoma de Células do Manto, para mais informações);
- Linfoma mediastinal (tímico) de grandes células B;
- Linfoma do tecido linfático associado a mucosa (MALT);
- Linfoma nodal da zona marginal de células B;
- Linfoma primário de cavidade pleural;
- Linfoma linfocítico de pequenas células –leucemia linfocítica crônica;
- Linfoma esplênico de zona marginal.
Subtipos de Linfoma de Células T e de Células ‘Natural Killer’
- Linfoma anaplásico de grandes células;
- Linfoma angioimunoblástico de células T;
- Linfoma cutâneo de células T (síndrome de Sézary e micose fungoide);
- Linfoma hepatoesplênico;
- Linfoma de células NK;
- Linfoma de células T periféricas, não especificado de outro modo.
Formas do LNH
Os médicos classificam os subtipos de LNH em categorias que descrevem com que rapidez ou lentidão a doença está progredindo:
- LNH Agressivo, também chamado de crescimento rápido ou de alto grau, constitui cerca de 60 por cento dos casos de LNH nos Estados Unidos. O subtipo agressivo mais comun é o linfoma difuso de grandes células B.
- LNH Indolente, também chamado de crescimento lento ou de baixo grau, constitui cerca de 40 por cento dos casos de LNH nos Estados Unidos. O subtipo indolente mais comun é o linfoma folicular.
Alguns pacientes têm a doença de “grau intermediário”, que se desenvolve a uma velocidade entre a forma indolente e agressiva. E algumas vezes, o LNH indolente pode “se transformar” para o LNH agressivo.
Os médicos não sabem por que algumas células se tornam linfoma não Hodgkin (LNH) e outras não. Para a maioria das pessoas que têm LNH, não existe motivos óbvios pelos quais elas desenvolveram a doença. Os pesquisadores identificaram determinados fatores de risco em potencial que podem aumentar as chances de desenvolver o LNH. Eles descobriram que pessoas que vivem e trabalham em comunidades agrícolas tendem a ter uma incidência maior de LNH. Estudos sugerem que pode haver uma ligação com alguns ingredientes encontrados em herbicidas e pesticidas. Os pesquisadores também acreditam que o LNH pode estar associado a exposição a determinadas bactérias e vírus, especialmente aquelas que suprimem o sistema imunológico, como:
- Vírus da imunodeficiência humana /síndrome da imunodeficiência adquirida (HIV/AIDS);
- Vírus Epstein-Barr;
- Vírus linfocitotrópico T humano (HTLV);
- Helicobacter pylori (a bactéria que causa as úlceras de estômago);
Você não pode pegar o LNH de alguém. Os especialistas descobriram que cerca de uma dúzia de síndromes herdadas – porém raras – podem aumentar o risco do LNH.
O sinal inicial mais comum de linfoma não Hodgkin (LNH) é o inchaço (aumento) indolor de um ou mais linfonodos no pescoço, axila ou virilha. A maioria das pessoas tem linfonodos afetados na parte superior do corpo, geralmente no pescoço ou do tórax superior. Algumas vezes, você pode sentir o linfonodo afetado na sua axila ou virilha.
Além dos linfonodos inchados, outros sinais e sintomas do LNH incluem:
- Febre sem uma causa óbvia;
- Sudorese excessiva especialmente à noite;
- Cansaço ou sem energia;
- Perda de apetite;
- Perda inexplicada de peso;
Se o LNH iniciar em uma área diferente dos linfonodos, como no osso, no pulmão, no trato digestivo (gastrintestinal) ou na pele, os sintomas podem incluir:
- Erupções cutâneas;
- Dor óssea;
- Tosse;
- Dor torácica;
- Dor abdominal (área do estômago);
- Caroços sob a pele.
Alguns sintomas do LNH estão associados a outras doenças menos sérias. Por exemplo, linfonodos aumentados podem resultar da inflamação e não são necessariamente um sinal de câncer. No entanto, se estiver incomodado com algum dos sintomas acima, procure o seu médico. Algumas vezes, você pode não apresentar sintomas. Neste caso, o seu médico pode ser o primeiro a notar os sinais, como linfonodos aumentados, durante um exame físico de rotina.
Biópsia do Linfonodo
O diagnóstico do linfoma não Hodgkin (LNH) geralmente envolve a realização de uma biópsia do linfonodo. Se a biópsia confirmar que você tem a doença, o seu médico realiza testes adicionais para estadiar o linfoma.
A finalidade de uma biópsia de linfonodo é confirmar o diagnóstico e:
- Identificar o subtipo do seu LNH;
- Desenvolver um plano de tratamento.
Exames Laboratoriais para Confirmar um Diagnóstico:
Após o seu médico coletar amostras do seu linfonodo e tecidos, um hematopatologista as examina sob um microscópio para procurar identificar características do LNH. Ele ou ela confirma um diagnóstico e identifica o subtipo do LNH. Um hematopatologista é um especialista que estuda doenças das células sanguíneas pela análise das amostras das células do sangue e da medula óssea e de outros tecidos.
O hematopatologista usa um ou mais exames laboratoriais, como os descritos a seguir para examinar as suas células:
- Imunofenotipagem confirma um diagnóstico do LNH e identifica as células do linfoma como células B, células T ou células ‘natural killer’;
- Análise citogenética procura por alterações nos cromossomos. As anormalidades ajudam a identificar o subtipo do LNH;
- Perfil de expressão gênica e análise por microarranjo identificam o subtipo e fatores de risco. Eles ajudam a prever a resposta ao tratamento e identificar os pacientes que podem estar em risco aumentado para recidiva;
- Reação em cadeia da polimerase (PCR) analisa determinados genes para ajudar a prever a resposta ao tratamento. Este teste é também usado para detectar células de linfoma residuais que são muito pequenas para serem vistas sob um microscópio.
Como o LNH é uma doença difícil de diagnosticar, você pode querer obter uma segunda opinião médica de um hematopatologista experiente antes de iniciar o tratamento. Alguns tipos de LNH podem ser confundidos entre eles. O tratamento apropriado depende de ter o diagnóstico correto.
TESTES DE ESTADIAMENTO
Assim que o seu médico confirmar o diagnóstico de LNH, ele ou ela faz mais testes para estadiar a sua doença. O estadiamento identifica a extensão da sua doença e onde ela está localizada no seu corpo.
Os testes de estadiamento incluem:
- Um exame físico;
- Exames de imagem;
- Exames de sangue;
- Exames da medula óssea.
Exames de Imagem
O seu médico conduz um ou mais exames de imagem (também chamado radiologia diagnóstica), juntamente com um exame físico, para verificar:
- A localização e distribuição dos linfonodos aumentados;
- Os efeitos da doença, se houver, em outros órgãos, como os pulmões ou fígado;
- Massas tumorais grandes.
Os exames de imagem podem incluir:
- Uma radiografia (raio-X);
- Uma varredura de tomografia computadorizada (TC) do pescoço, tórax, pelve e abdômen (área do estômago);
- Uma varredura de imagem por ressonância magnética (IRM);
- Uma varredura de tomografia de emissão de pósitrons (PET);
- Uma varredura de PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo (F-18).
Exames de Sangue
Após a coleta do seu sangue, ele é enviado a um laboratório para um hemograma completo (CBC) e exames adicionais. O seu sangue é dosado para:
- Níveis de células vermelhas (eritrócitos), células brancas (leucócitos) e plaquetas;
- A presença de células do linfoma;
- Anormalidades ou deficiências de imunoglobulinas causadas pelos linfócitos;
- Níveis séricos de proteína;
- Níveis de ácido úrico;
- Velocidade de hemossedimentação (a velocidade para as células vermelhas se depositarem no fundo de um tubo de ensaio – uma velocidade aumentada pode indicar câncer);
- Função hepática e renal;
- Evidência de hepatite A ou B;
- Dois marcadores biológicos, lactato desidrogenase (LDH) e beta 2-microglobulina.
Exames da Medula Óssea
O seu médico pode decidir examinar a sua medula óssea para ver se a doença se espalhou. Se a sua doença estiver em um estágio inicial e alguns sinais e sintomas não tiverem aparecido, você pode não precisar fazer o teste. O exame da medula óssea envolve duas etapas geralmente feitas ao mesmo tempo em um consultório médico ou no hospital:
- Uma aspiração da medula óssea para coletar uma amostra líquida da medula;
- Uma biópsia de medula óssea para retirar uma pequena quantidade de osso preenchido com medula.
O seu médico também pode coletar amostras de medula óssea durante o tratamento para determinar a efetividade da sua terapia.
Outros Exames para Subtipos Específicos
Determinados exames são realizados somente para subtipos específicos e não necessariamente para todos os pacientes com LNH. Eles incluem:
- Endoscopias alta e baixa para pacientes cuja doença envolve o trato digestivo (gastrintestinal);
- Colonoscopia para pacientes que têm linfoma de células do manto;
- Uma punção lombar para pacientes cujo sistema nervoso central pode ser afetado pelo LNH;
- Imagem do cérebro ou da coluna vertebral para pacientes cujo sistema nervoso ventral pode ser afetado pelo LNH.
É importante que o seu médico seja experiente no tratamento de pacientes com linfoma não Hodgkin (LNH) ou trabalhe em consulta com um especialista em LNH. Este tipo de especialista é geralmente chamado de oncologista hematologista.
Tipos de Tratamento
Os médicos usam diversos tipos de abordagens e combinações de tratamento para o LNH, alguns em estágios diferentes:
- Quimioterapia e outra terapia farmacológica;
- Radioterapia, geralmente combinada com a quimioterapia;
- Transplante de células tronco;
- Observar e esperar;
- O seu médico pode sugerir que você participe de um estudo clínico. Estudos clínicos podem envolver a terapia com novos medicamentos e novas combinações de medicamentos ou novas abordagens para o transplante de células tronco.
Também pode haver grandes diferenças entre o tratamento para o LNH agressivo e o tratamento para o LNH indolente. Leia sobre cada um em:
- Tratamento para o LNH agressivo;
- Tratamento para LNH indolente.
Considerações de Pré-Tratamento
Adultos em idade fértil e pais de crianças diagnosticados com LH devem pedir aos seus médicos informações sobre como reduzir o risco de infertilidade. Vide a publicação gratuita da LLS Fatos sobre Fertilidade para mais detalhes.
Encontrando a Melhor Abordagem de Tratamento
O objetivo do tratamento para LNH é destruir o maior número de células do linfoma possível para induzir a remissão completa (sem traço da doença). Os pacientes que entram em remissão são, algumas vezes, curados da doença.
O tratamento pode manter o LNH controlado por muitos anos, mesmo se os testes mostrarem algumas células do linfoma remanescentes. Isto é chamado remissão parcial.
O tratamento que o seu médico recomendar é baseado em diversos fatores, incluindo:
- O subtipo da sua doença;
- Se a sua doença é agressiva (crescimento rápido) ou indolente (crescimento lento);
- O estágio e categoria da sua doença;
- Se o linfoma está em áreas do corpo, diferente dos seus linfonodos (envolvimento extranodal);
- A sua saúde geral e se você tem alguma condição, como doença cardíaca, doença renal, doença pulmonar, diabetes ou anemia.
Enquanto você desenvolve um plano de tratamento com o seu médico, certifique-se de discutir:
- Os resultados que você pode esperar com o tratamento;
- Possíveis efeitos colaterais, incluindo efeitos de longo prazo e tardios;
- A possibilidade de participar de um estudo clínico, onde você terá acesso a tratamento médico avançado que pode ser mais benéfico a você do que o tratamento padrão.
Você pode achar útil levar alguém próximo a você às suas visitas com o seu médico para apoio, para tomar notas e fazer perguntas de acompanhamento. Uma sugestão é preparar as perguntas que gostaria de fazer quando visitar o seu médico. Você também pode registrar as suas conversas com o seu médico e ouvir com mais atenção ao chegar em casa.
Outras Considerações de Tratamento
Se você estiver em idade fértil, converse com o seu médico sobre os possíveis efeitos de longo prazo do tratamento na fertilidade;
Se o seu filho estiver sendo tratado para LNH, a terapia pode diferir daquela do adulto normal. Você também precisa pensar sobre os efeitos de longo prazo do tratamento, incluindo os efeitos na fertilidade;
Se tiver 60 anos ou mais de idade, o seu tratamento pode variar das abordagens padrão. Por exemplo, o seu corpo pode não ser capaz de tolerar os medicamentos quimioterápicos tóxicos ou você pode ter outras enfermidades que são mais comuns à medida que envelhecemos. Esses fatores, entre outros, podem tornar mais complicada a escolha de um tratamento. No entanto, a idade mais avançada não é um fator determinante no tratamento para a maioria dos pacientes.
Para muitas pessoas com linfoma não Hodgkin (LNH), iniciar o tratamento os auxilia a focar em seguir adiante e buscar pela remissão de sua doença.
QUIMIOTERAPIA E TERAPIA FARMACOLÓGICA
Durante a quimioterapia, você recebe medicamentos potentes que devem ser tóxicos o suficiente para danificar ou matar as células leucêmicas. Ao mesmo tempo, eles têm como alvo as células normais e causam efeitos colaterais. Porém, nem todos apresentam efeitos colaterais da mesma maneira.
Os médicos combinam comumente quatro ou mais medicamentos quimioterápicos para tratar o linfoma não Hodgkin (LNH). Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. Combinar tipos de medicamento pode aumentar a sua efetividade. Você pode receber os medicamentos em pílulas para engolir, por injeção ou através de um cateter (um tubo fino, flexível ou linha intravenosa) colocado cirurgicamente em uma veia, normalmente no seu tórax superior.
A quimioterapia é administrada em ciclos, geralmente com várias semanas de intervalo, em um contexto ambulatorial. Você precisará de uma série de ciclos durante seis a 10 meses. Você pode precisar permanecer no hospital por um período curto durante o tratamento se a sua terapia for particularmente intensiva ou se ela levar à infecção ou a decréscimos prolongados ou graves nos hemogramas.
CHOP
Um regime de medicamentos quimioterápicos comum para o LNH é chamado CHOP. Os nomes das combinações são geralmente abreviações para a primeira letra dos medicamentos usados. Os medicamentos em CHOP são:
- Ciclofosfamida (Cytoxan®);
- Doxorrubicina (hidroxidoxorrubicina);
- Vincristina (Oncovin®);
- Prednisona.
Os médicos podem adicionar o anticorpo monoclonal, rituximabe (Rituxan®), a esta mistura, que pode ajudar na efetividade do tratamento ao direcionar moléculas específicas para as células cancerosas. Denominado R-CHOP, esta é a combinação mais comumente usada de quimioterapia e anticorpo monoclonal para o LNH agressivo. Ela pode ser muito efetiva e, algumas vezes, cura o LNH.
Outras Terapias Farmacológicas
Os médicos usam um vasto arranjo de medicamentos para tratar os subtipos diferentes do LNH, atacando-os de muitos ângulos diferentes:
- Medicamentos que danificam o DNA interrompem o crescimento de células cancerosas ao modificar quimicamente o DNA que está ajudando o LNH a se desenvolver;
- Anticorpos antitumorais interagem com o DNA para interferir com a sobrevida de células cancerosas;
- Antimetabólitos são substâncias químicas que bloqueiam a capacidade das células de formar o DNA ou RNA, o que previne o crescimento celular;
- Medicamentos inibidores do proteassoma limitam os efeitos de uma estrutura celular chamada proteassoma, o que torna mais difícil para as células cancerosas sobreviverem;
- Inibidores da enzima de reparo do DNA atacam determinadas enzimas (proteínas) em células que tornam o DNA mais suscetível a dano;
- Medicamentos quimioterápicos bloqueiam um processo chamado mitose, que interrompe as células de se dividirem, limitando assim a produção de células cancerosas;
- Hormônios destruidores de linfócitos, relacionados ao hormônio natural, cortisol, são usados em doses altas para destruir as células cancerosas;
- Anticorpos monoclonais, usados durante a imunoterapia, são uma classe de agentes que tem como alvo e destroem células cancerosas com menos efeitos colaterais do que a quimioterapia tradicional.
RADIOTERAPIA
A radioterapia é, algumas vezes, usada para destruir as células do linfoma não Hodgkin (LNH) que se acumularam em uma área do corpo. Poucos casos de LNH são tratados somente com a radioterapia porque é provável que as células do linfoma estejam espalhadas por todo o corpo. Porém, ela pode ser usada com outras terapias, como a quimioterapia se você tiver massas particularmente grandes de linfoma em uma área. Ela é também usada quando linfonodos grandes estão pressionando ou invadindo órgãos ou estruturas e a quimioterapia isolada não pode controlar o problema.
Durante a terapia, a radiação é dirigida somente às áreas do seu corpo afetadas pelo LNH. Uma máquina chamada acelerador linear, ou linac, aplica feixe de radiação a área(s) alvo(s) do seu corpo enquanto você está deitado em uma mesa móvel. Partes do seu corpo não afetadas pelo linfoma de Hodgkin, como os órgãos reprodutores são protegidos para ajudar a reduzir os efeitos colaterais do tratamento. O procedimento em si é indolor, embora algumas pessoas possam sentir desconforto ao permanecer na mesma posição por vários minutos durante a sessão.
TRANSPLANTE DE CÉLULAS TRONCO
Alguns pacientes podem ter linfoma que resiste ao tratamento ou que volta após um período de remissão. Se você se enquadra em uma dessas categorias o seu médico pode recomendar um transplante autólogo de células tronco para que você possa tolerar melhor a quimioterapia intensiva. Devido aos altos riscos, por vezes, com risco à vida, do transplante de células tronco, os médicos não o recomendam para o tratamento inicial. No entanto, o transplante autólogo de células tronco pode curar alguns pacientes, cujo linfoma está na primeira recidiva (o linfoma voltou após um período sem sinal da doença). O transplante para a primeira remissão está sendo feito apenas em estudos clínicos, com algumas exceções, como no tratamento do linfoma de células do manto. Existem vários tipos de transplante de células tronco. Os pacientes com linfoma não Hodgkin (LNH) mais comumente são submetidos ao transplante autólogo de células tronco, quando as suas próprias células tronco não cancerosas são “coletadas”, ou recuperadas, do seu corpo e congeladas. As suas células são devolvidas ao seu corpo por injeção após receber a terapia farmacológica intensiva.
O transplante autólogo não apresenta tanto risco quanto o transplante alogênico de células tronco quando as células tronco são provenientes de um doador compatível. O transplante alogênico de células tronco é usado para tratar somente pacientes selecionados com LNH.
OBSERVAR E ESPERAR
Algumas pessoas podem controlar o seu linfoma não Hodgkin (LNH) com seus médicos por anos usando a abordagem observar e esperar. Ao usar o método observar e esperar, o seu médico pode monitorar a sua condição com exames físicos e exames laboratoriais regulares. Você não tomará medicamentos ou será submetido a algum tratamento para LNH durante este período. Observar e esperar é uma abordagem de tratamento usada para o LNH indolente.
Você pode se sentir desconfortável porque sabe que tem câncer, porém não está sendo imediatamente tratado. Tenha certeza que a abordagem observar e esperar é o cuidado padrão para pessoas cuja doença não se espalhou e que não têm sintomas. A abordagem observar e esperar permite que você evite os efeitos colaterais da terapia até que precise de tratamento. O tratamento do LNH durante este estágio inicial não provou ser útil.
Você deve visitar o seu médico regularmente para que ele ou ela possa examiná-lo para qualquer alteração à saúde, especificamente observar se a sua doença permanece estável ou começa a progredir. O seu médico monitora os resultados do seu teste para decidir quando é hora de iniciar o tratamento e qual é a melhor opção de tratamento para você. Cerca da metade de todos os pacientes pode adiar o tratamento por pelo menos três anos. Alguns pacientes que permaneceram no modo observar e esperar por mais de 10 anos nunca precisaram de tratamento.
Observar e esperar também pode ser a melhor abordagem para alguns pacientes diagnosticados com LNH disseminado que o tratamento provavelmente não curará. A doença, embora disseminada, pode permanecer estável por anos, permitindo que eles evitem os efeitos colaterais da terapia desnecessária.
Quando Iniciar o Tratamento
O seu médico pode aconselhá-lo a iniciar o tratamento se tiver:
- Linfonodos que estão aumentando de tamanho;
- Linfonodos recém-afetados;
- Ossos ou outros órgãos que foram afetados pelo LNH;
- Um decréscimo no número de células sanguíneas.
Pesquisa e Estudos Clínicos Atuais no LNH
A seguir estão alguns dos tipos de pesquisa e estudos em andamento no LNH:
Medicamentos em Estudo
- O agente quimioterápico bendamustina (Treanda®), aprovado para a leucemia linfocítica crônica (LLC) e LNH indolente recidivado, está sendo estudado no linfoma de células do manto recém-diagnosticado, com rituximabe (Rituxan®) e lenalidomida (Revlimid®);
- Bortezomibe (Velcade®), um medicamento chamado “inibidor do proteassoma” que está aprovado para tratar pacientes com linfoma de células do manto que receberam pelo menos uma terapia prévia, está agora sendo investigado para efetividade como parte do tratamento inicial para o linfoma de células do manto. Os pesquisadores estão também explorando o uso de Velcade combinado a outros agentes, como Treanda e lenalidomida (Revlimid®);
- Agentes chamados “inibidores da histona desacetilase (HDAC)” são uma classe de medicamentos que tratam alterações “epigenéticas” no DNA. Um inibidor da HDAC, vorinostat (Zolinza®), que controla como o DNA é regulado, está aprovado para o tratamento de pacientes com linfoma cutâneo de células T que têm a doença progressiva, persistente ou recorrente durante ou após o tratamento com duas terapias sistêmicas. Este agente está agora sendo estudado para tratar o linfoma de células T e de células B isoladamente e em combinação com outros medicamentos;
- O medicamento imunomodulatório, Revlimid, está sendo estudado como tratamento para o linfoma difuso de grandes células B, linfoma de células do manto, linfoma folicular e leucemia linfocítica crônica (LLC);
- A terapia com o anticorpo monoclonal, ítrio-90-ibritumomabe tiuxetano (Zevalin®) foi aprovada para o linfoma de baixo grau recidivado e para pacientes com LNH folicular anteriormente não tratado que atingem uma resposta parcial ou completa à quimioterapia de primeira linha. A efetividade deste agente está agora sendo estudada no retratamento do linfoma, como terapia para o linfoma indolente recém-diagnosticado, como terapia para as formas agressivas do LNH combinado com ou após outros regimes farmacológicos e como parte de programas de terapia de alta dose juntamente com o transplante autólogo de células tronco;
- Ofatumumabe (Arzerra®) é um anticorpo monoclonal aprovado para o LLC recidivado e está agora sendo estudado em estudos clínicos em diversas combinações para o tratamento da leucemia linfocítica crônica, do linfoma difuso de grandes células B e do linfoma folicular;
- Pralatrexato (Foloytn®), aprovado para diversos subtipos de linfoma de células T, está sendo estudado em combinação com outros medicamentos quimioterápicos. Pralatrexato é um tipo de quimioterapia que interrompe processos em que as células são necessárias para a replicação celular.
- Existem diversos outros medicamentos em investigação que tem como alvo as vias de sinalização do receptor da células B dentro das células do linfoma. Alguns desses medicamentos incluem:
- Everolimo, um inibidor de mTOR, está sendo estudado em combinação com outros tratamentos para o LNH anteriormente tratado.
- Ibrutinibe (ImbruvicaTM), um inibidor de BTK que está sendo estudado em pacientes com LLC/LLS e linfoma de células do manto anteriormente não tratados.
- Idelalisibe, um inibidor oral da PI3K, que está sendo estudado para o tratamento de pacientes com LNH indolente que é refratário ao Rituxan e a uma quimioterapia contendo agente alquilante. Este medicamento está sendo desenvolvido como um agente único e em combinação com outra terapia.
- Tensirolimo, um inibidor de mTOR, está sendo atualmente estudado em combinação com outros tratamentos para o LNH anteriormente tratado.
Perfil por Expressão Gênica (GEP) e Microarranjos de Tecido (TMAs)
Essas são ferramentas que nos ajudam a entender melhor a biologia do linfoma. GEP e TMAs nos ajudam a caracterizar o linfoma com mais cuidado. Por exemplo, determinados biomarcadores em células tumorais estão associados a uma maior ou menor resposta à terapia e podem servir como preditores, indicando se alguém irá recidivar com a terapia ou se a sua doença se comportará de modo mais ou menos agressivo. Alguns dos mais importantes desses biomarcadores são baseados em gene. Uma ferramenta usada para analisar a atividade dos genes é chamada de “microarranjo”.
Microambiente
Existe um foco crescente na análise do microambiente tumoral; ou seja, as células que estão associadas ao tumor, ao invés do tumor em si. No linfoma folicular, determinadas células que são encontradas na realidade próximas às células tumorais têm demonstrado predizer um resultado melhor ou pior.
Transplante de Células Tronco de Intensidade Reduzida (Transplante Alogênico Não Mieloablativo)
Estudos clínicos estão em andamento para determinar a utilidade desta abordagem em pacientes com mais idade e mais enfermos para muitos cânceres do sangue, incluindo alguns subtipos do LNH. Consequentemente, o transplante pode ser uma opção para pacientes com idade entre 60 e 70 anos. Os pacientes que são condicionados para um transplante de intensidade reduzida recebem doses mais baixas de medicamentos quimioterápicos e/ou radiação em preparação para o transplante. Medicamentos imunossupressivos são usados para prevenir a rejeição do enxerto (as células imunológicas do doador), permitindo que as células imunológicas enxertadas ataquem a doença do receptor. A efetividade do transplante de intensidade reduzida é graças ao efeito enxerto versus linfoma dos linfócitos do doador e não às altas doses de quimioterapia.
Vacinas
Os cientistas estão desenvolvendo vacinas que estimulam o sistema imunológico a combater e suprimir o crescimento de células do linfoma. Diferente das vacinas clássicas, elas não previnem a doença; mas, se usadas durante a remissão, estimulam o sistema imunológico a atacar as células residuais do linfoma e impede-as de causar uma recidiva.
TRATAMENTO PARA SUBTIPOS AGRESSIVOS DO LNH
O linfoma não Hodgkin (LNH) agressivo progride rapidamente. Ele constitui cerca de 60 por cento de todos os casos de LNH nos Estados Unidos. Os subtipos agressivos incluem:
- Linfoma associado a AIDS;
- Linfoma anaplásico de grandes células;
- Linfoma de Burkitt;
- Linfoma do sistema nervoso central (SNC);
- Linfoma difuso de grandes células B (LDCBG);
- Linfoma hepatoesplênico;
- Linfoma de células do manto;
- Linfoma do tecido linfoide associado a mucosa (MALT) (transformado);
- Linfoma de células T periférico (a maioria dos tipos);
- Linfoma folicular transformado.
O objetivo do tratamento para muitos subtipos é a cura. O tratamento para o LNH agressivo começa no momento do diagnóstico.
A quimioterapia provou ser geralmente uma abordagem efetiva para tratar os subtipos agressivos. O cuidado padrão para cada subtipo varia. A seguir estão alguns exemplos de abordagens específicas à terapia:
- Doença de estágio inicial. O tratamento pode incluir a combinação quimioterápica CHOP ou a radioterapia de campo envolvido, ou ambos. Às vezes, o anticorpo monoclonal, rituximabe (Rituxan®), é adicionado ao regime CHOP (R-CHOP);
- Doença de estágio avançado. O tratamento de primeira linha é CHOP com Rituxan (R-CHOP);
- Doença que se espalhou para outras áreas ou órgãos. Se o linfoma está na medula óssea, nos seios nasais ou nos testículos ou próximo à coluna vertebral, existe o risco que ela possa se espalhar para o sistema nervoso central. Nessas circunstâncias, a quimioterapia pode ser administrada diretamente no líquor;
- Doença de alto risco. Fatores associados a um alto risco para recidiva após a terapia padrão incluem altos níveis ou a presença de determinadas proteínas no sangue e a mutação do gene p53. Nesses casos, é necessário um tratamento inicial mais agressivo do que o normal. Um estudo clínico pode ser uma opção de tratamento efetiva.
Tratando os Subtipos Agressivos Específicos
Linfoma Associado à AIDS
Determinados tipos de LNH são vistos com mais frequência em pessoas que têm a síndrome da imunodeficiência adquirida (AIDS), incluindo o linfoma difuso de grandes células B, linfoma de Burkitt e linfoma primário do sistema nervoso central. O resultado do tratamento depende de como a AIDS está respondendo à terapia. Como a AIDS já leva a baixas contagens de células brancas, a quimioterapia deve ser considerada cuidadosamente para determinar se o efeito adicional do tratamento nos níveis sanguíneos pode ser controlado. A melhora do tratamento para o vírus da imunodeficiência humana (HIV) nos últimos anos tem ajudado a reduzir o número de pessoas diagnosticadas com LNH associado à AIDS.
Linfoma Anaplásico de Grandes células
O linfoma anaplásico de grandes células, mais comum em pessoas jovens, geralmente começa nos linfonodos e pode se espalhar para a pele. Porém, também pode começar na pele. Uma combinação de radioterapia e quimioterapia tem provado ser uma abordagem efetiva de duas vertentes para tratar este subtipo. Brentuximabe vedotina, (Adcetris(R)), também conhecido como SGN-35, está aprovado pela FDA no tratamento de pacientes com linfoma anaplásico sistêmico de grandes células (LACG) após falha de pelo menos um regime quimioterápico prévio de múltiplos agentes. Brentuximabe vedotina é administrado por injeção. Cerca de 80 por cento dos pacientes com linfoma anaplásico de grandes células apresenta cura. A terapia combinada é mais efetiva se as células tumorais de um paciente apresentarem uma proteína chamada ALK-1.
Linfoma de Burkitt
Este subtipo de células B é considerado como sendo altamente agressivo. Ele geralmente aparece como uma massa de linfoma na área abdominal (estômago). Ele também pode aparecer na medula óssea, no sangue, no sistema nervoso central e em outros órgãos. O linfoma de Burkitt, que tem essa denominação em homenagem ao cirurgião que identificou a doença pela primeira vez em crianças na África, afeta, em grande parte, adultos com mais idade. Na África, a doença geralmente aparece em crianças como uma massa no osso facial, especialmente na mandíbula. Os médicos usam tipicamente a quimioterapia para tratar a doença. Os medicamentos usados incluem a prednisona, a ciclofosfamida (Cytoxan®), a vincristina (Oncovin®), a citarabina (Cytosar-U®, citosina arabinosida, ara-C), a doxorrubicina (Adriamycin® PFS, Adriamycin®) e o metotrexato (Rheumatrex®, Trexall®).
Linfoma do Sistema Nervoso Central
Existem dois tipos deste linfoma raro no sistema nervoso central (SNC): primário e secundário. O Linfoma primário do SNC começa no cérebro ou na coluna vertebral e é um linfoma associado a AIDS, embora possa estar relacionado a outros subtipos de LNH também. O linfoma secundário do SNC começa em outra área do corpo e se dissemina para o cérebro e/ou coluna vertebral. Os pesquisadores estão atualmente estudando tratamentos efetivos para ambos os tipos em estudos clínicos. O tratamento padrão pode incluir a quimioterapia, medicamentos glicocorticoides e/ou a radioterapia. O tratamento em estudos clínicos inclui a imunoterapia e a quimioterapia de alta dose com o transplante de células tronco.
Linfoma Difuso de Grandes células B
O linfoma difuso de grandes células B (LDCBG) é o tipo mais comum do subtipo agressivo do LNH, constituindo 30 por cento de todos os casos de LNH nos Estados Unidos. Ele afeta, em geral, adultos na meia idade e com mais idade. Embora ele se enquadre na categoria agressiva, o LDCBG pode, algumas vezes, começar como um linfoma indolente, como o linfoma de células B pequenas ou um linfoma folicular. O regime quimioterápico R-CHOP tem provado ser bem-sucedido ao curar 50 por cento a 60 por cento dos pacientes com LDCBG e é o cuidado padrão para a doença de estágio avançado.
Linfoma Hepatoesplênico
Este tipo de linfoma de células T é uma doença extremamente rara e agressiva que começa no fígado ou baço e geralmente afeta adultos jovens na faixa dos 20 e 30 anos de idade. O tratamento para pacientes com linfoma hepatoesplênico de células T inclui a quimioterapia baseada em antraciclina e, em alguns casos, o transplante de células tronco.
Linfoma de Células do Manto
Pelo momento em que o linfoma de células do manto é diagnosticado, ele geralmente já se espalhou para os linfonodos e medula óssea e, algumas vezes, no fígado, intestinos e baço. O LNH se desenvolve em um linfócito na área de um linfonodo conhecido como a zona do manto. O linfoma de células do manto é mais comumente diagnosticado em homens com mais de 50 anos de idade. Os médicos geralmente tratam o linfoma de células do manto com medicamentos quimioterápicos e o anticorpo monoclonal rituximabe (Rituxan®).
Linfoma do Tecido Linfoide Associado a Mucosa (MALT) (Transformado)
O linfoma do tecido linfoide associado a mucosa (MALT), que afeta locais fora dos linfonodos, como o trato gastrintestinal, olhos, glândula da tireoide, glândula salivares, pulmões ou pele, e representa cerca de 7,5 por cento dos casos de LNH. Os pacientes com linfoma MALT podem ter um histórico de doença autoimune. Uma maior incidência de linfoma MALT, envolvendo o estômago, é vista em pacientes que foram infectados com a bactéria Helicobacter pylori (H. pylori). As bactérias também têm sido implicadas em outras formas do linfoma MALT. O tratamento geralmente inclui combinações potentes de antibióticos, que erradicam a infecção por H. pylori e causam a regressão do linfoma. Muitos pacientes com H. pylori foram curados do linfoma MALT sem a radioterapia ou a quimioterapia.
O linfoma MALT transformado é um linfoma agressivo e é incomum. Para este pequeno subconjunto de pacientes, o linfoma MALT pode se transformar em linfoma difuso de grandes células B (LDCBG). Esses pacientes mostraram se beneficiar com os tratamentos usados para o LDCBG.
Linfoma de Células T Periférico
O linfoma de células T periférico é um dos linfomas mais difíceis de tratar. Existem diversas formas deste subtipo:
- Linfoma agudo adulto de células T (o mais comum);
- Linfoma extranodal de células T ou de células ‘natural killer’ (células NK);
- Linfoma do tipo nasal, que geralmente afeta as vias aéreas superiores, como o nariz e a nasofaringe, e a pele e o trato digestivo;
- Linfoma de células T associado a enteropatia, que pode afetar pessoas sensíveis ao glúten;
- Linfoma subcutâneo de células T paniculite-símile, que invade as camadas mais profundas da pele, causando a formação de nódulos sob a pele.
O linfoma de células T periférico é geralmente tratado como o linfoma difuso de grandes células B, geralmente com R-CHOP. No entanto, estudos estão em andamento para desenvolver abordagens terapêuticas mais efetivas.
O que é tratamento para PTCL recidivada ou refratária?
Não existe consenso sobre a melhor estratégia terapêutica para o PTCL recidivado/refratário. ‘Recidivado’ significa que, embora o seu tumor fosse inicialmente sensível à quimioterapia e não houvesse encolhimento tumoral inicial, as células do seu câncer não apresentam mais encolhimento com a quimioterapia que você recebeu. Você pode ser refratário ao primeiro tratamento que recebeu ou pode ser refratário após o seu câncer ter recidivado. ‘Recidivado’ e ‘refratário’ significam que as células do seu tumor desenvolveram resistência à quimioterapia que você estava recebendo e ela não é mais efetiva.
Desde 2009, existem dois agentes aprovados para pessoas com PTCL pela Agência Regulatória de Alimentos e Medicamentos dos Estados Unidos. Pralatrexato (Difolta) foi aprovado em setembro de 2009 para o tratamento de pacientes com PTCL recidivado ou refratário. Romidepsina (Istodax) recebeu aprovação acelerada como um tratamento para pessoas com PTCL que receberam pelo menos uma terapia prévia em junho de 2011.
Linfoma Folicular Transformado
O linfoma folicular começa como um subtipo indolente do LNH. No entanto, ele geralmente se transforma em um linfoma agressivo de grandes células B. A quimioterapia de alta dose seguida pelo transplante autólogo de células tronco pode ser um tratamento efetivo para controlar a doença.
Um estudo clínico também pode ser uma boa opção para os pacientes com linfoma folicular, cuja doença se transformou, apesar de diversas abordagens diferentes de tratamento terem sido tentadas. Outras escolhas de tratamento são:
- Quimioterapia com ou sem o anticorpo monoclonal, rituximabe (Rituxan®);
- Um anticorpo monoclonal radioimunoterapêutico, como Zevalin®;
- Radioterapia;
- Cuidado de suporte;
- Combinação de quimioterapia com Rituxan e possivelmente radioterapia para pacientes cujo LF se transformou antes de uma quantidade significativa de tratamento e está em uma única área;
- Infusão autóloga de células tronco (em um estudo clínico).
TRATAMENTO PARA SUBTIPOS INDOLENTES DO LNH
Subtipos indolentes do linfoma não Hodgkin (LNH) progridem lentamente. Eles constituem cerca de 30 por cento de todos os casos de LNH nos Estados Unidos. Os subtipos indolentes incluem:
- Linfoma cutâneo de células T (micose fungoide e síndrome de Sézary);
- Linfoma folicular;
- Linfoma linfoplásico e macroglobulinemia de Waldenstrom;
- Linfoma de zona marginal;
- Linfoma linfocítico de pequenas células (LLPC) e leucemia linfocítica crônica (LLC).
O tratamento para o LNH indolente varia de uma abordagem observar e esperar à terapia agressiva. O controle ou tratamento do LNH indolente é altamente individual. O seu médico considera uma série de fatores, como:
- Sua perspectiva para recuperação;
- O estágio da doença;
- A sua saúde geral.
Se não tiver sintomas e a sua doença não estiver progredindo, o seu médico pode recomendar a abordagem observar e esperar. Você não receberá terapia imediata, mas o seu médico o monitorará de perto para qualquer alteração. Mas ter um LNH indolente não qualifica você automaticamente para o observar e esperar: Alguns tipos de LNH indolente precisam de terapia inicial agressiva.
Medicamentos Usados para o Linfoma Não Hodgkin Indolente
Se precisar de tratamento imediato, você será geralmente submetido à quimioterapia. Os médicos combinam comumente até cinco medicamentos quimioterápicos para tratar o LNH indolente. Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. A combinação de tipos de medicamentos pode aumentar a sua efetividade.
Um regime quimioterápico comum é um grupo de medicamentos conhecido como CVP. (Os nomes das combinações são geralmente abreviações para a primeira letra dos medicamentos usados.) CVP combina os seguintes medicamentos:
- Ciclofosfamida (Cytoxan ®);
- Vincristina (Oncovin ®);
- Prednisona.
Para determinados subtipos, os médicos normalmente adicionam o anticorpo monoclonal, rituximabe (Rituxan®) a esta mistura, combinado ao CVP ou administrado posteriormente, o que pode ajudar na efetividade do tratamento.
Tratando Subtipos Indolentes Específicos
Linfoma Cutâneo de Células T (Micose Fungoide e Síndrome de Sézary)
O linfoma cutâneo de células T geralmente começa em uma célula T na pele. Pode se tornar mais avançado se ele se espalhar para outros órgãos. Dois tipos comuns de linfoma cutâneo de células T são a micose fungoide e a síndrome de Sézary. Este subtipo de LNH pode ser difícil de diagnosticar em suas fases iniciais. O tratamento depende de ele estar ainda presente nos linfonodos e da gravidade das lesões cutâneas. Pode incluir medicamentos quimioterápicos tópicos que você aplica diretamente à pele afetada combinados à fototerapia com ultravioleta e à terapia com feixes de elétrons. O medicamento comumente usado com a fototerapia com ultravioleta é psoraleno. Esta combinação de tratamento é abreviada e referida como PUVA. Se a doença estiver disseminada, o seu médico pode usar a quimioterapia com um ou mais medicamentos ou a fotoférese extracorpórea, um método que retira o sangue do seu corpo e o trata com luz ultravioleta antes de ser devolvido ao seu corpo.
Linfoma Folicular
O linfoma folicular (LF) é o segundo subtipo mais comum de linfoma não Hodgkin (LNH), constituindo cerca de 20 por cento de todos os casos de LNH. O linfoma começa nas células em que ocorre uma translocação entre os cromossomos 14 e 18. Isto causa a produção excessiva (superexpressão) do gene BCL-2, que pode tornar as células resistentes à terapia. No entanto, o tratamento pode manter a doença indolente controlada por vários anos.
O LF tem um alto risco de se transformar em uma doença agressiva. O LF pode ser tratado com:
- Radioterapia;
- Quimioterapia seguida por radioterapia;
- Uma abordagem de observar e esperar;
- Um anticorpo monoclonal radioativo;
- Transplante de células tronco.
A participação em um estudo clínico também pode ser uma boa opção de tratamento.
Os médicos desenvolveram um sistema de pontuação chamado Índice de Prognóstico Internacional para Linfoma Folicular que pode ajudá-los a predizer quais pacientes têm um maior risco de a doença voltar (recorrência). Os médicos elaboram um plano de tratamento em torno da pontuação dos pacientes. Os fatores que aumentam o risco para pacientes com LF incluem:
- Idade acima de 60 anos;
- Doença de estágio III ou IV;
- Mais de quatro linfonodos envolvidos;
- Um nível elevado de lactato desidrogenase (um tipo de proteína) no sangue;
- Uma baixa concentração de hemoglobina (menos de 12 gramas por decilitro) no sangue;
- Opções de tratamento para o LF transformado estão descritas no Tratamento para Subtipos Agressivos do LNH.
Linfoma Linfoplasmacítico e Macroglobulinemia de Waldenström
O linfoma linfoplasmacítico e macroglobulinemia de Waldenström são dois subtipos de LNH proximamente relacionados que começam em uma célula B. Ambos podem se tornar mais avançados se o linfoma se espalhar para outros órgãos, como os pulmões e o trato digestivo. O seu médico pode sugerir uma abordagem observar e esperar se a doença estiver em seus estágios iniciais. Do contrário, você pode ser tratado com regimes terapêuticos que incluem uma combinação de agentes biológicos (tratamento que estimula o sistema imunológico a combater o câncer), inibidores de sinalização (medicamentos que bloqueiam os sinais de pró-crescimento e sobrevida), e a quimioterapia. Recentemente, o ibrutinibe (Imbruvica®) passou a ser o primeiro medicamento aprovado para o tratamento de pacientes sintomáticos com MW.
Uma complicação séria das duas doenças é chamada síndrome da hiperviscosidade, em que há o espessamento do sangue. Isto leva a um fluxo sanguíneo inadequado, causando sintomas como cefaleia, visão turva e confusão mental. Para tratar a síndrome, o seu médico pode fazer com que você passe por uma plasmaférese, um método que retira do seu sangue o excesso de anticorpos que causam a condição. Isto é seguido por tratamento para controlar o linfoma.
Linfoma de Zona Marginal
O linfoma de zona marginal pode se desenvolver nos linfonodos (nodal) ou em outro local do corpo (extranodal), porém geralmente não se espalha. O linfoma nodal de zona marginal de células B (também chamado linfoma monocitoide de células B) é uma forma rara da doença que é encontrada no baço e no sangue.
O linfoma do tecido linfoide associado a mucosa (MALT) é um tipo mais comum que se desenvolve fora dos linfonodos, incluindo o trato digestivo (gastrintestinal), olhos, glândula da tireoide, glândulas salivares, pulmões e pele. MALT tem sido associado a um histórico de doença autoimune e infecção bacteriana, incluindo Helicobacter pylori (H. pylori). Os médicos tratam MALT com combinações potentes de antibióticos, resultando em curas para alguns pacientes sem ter que passar pela radioterapia ou quimioterapia.
Linfoma Linfocítica de Pequenas Células e Leucemia Linfocítica Crônica
O linfoma linfocítico de pequenas células (LLPC) e a leucemia linfocítica crônica (LLC) são subtipos semelhantes de LNH. Eles tendem a afetar as mesmas faixas etárias (a idade mediana dos pacientes é de 65 anos), têm sinais e sintomas comuns e são de crescimento lento. As diferenças estão em onde eles se desenvolvem: LLPC geralmente afeta os linfonodos e o tecido linfoide; o LLC geralmente afeta o sangue e a medula óssea, mas pode se espalhar para os linfonodos. O tratamento para ambos é o mesmo: quimioterapia com o medicamento, bendamustina (Treanda®), que é usado para tratar o LLC. Ele provou ser efetivo em pacientes com LLPC em estudos clínicos após o tratamento com rituximabe (Rituxan®) isoladamente ou com outros medicamentos.
EFEITOS COLATERAIS
A terapia para câncer no linfoma não Hodgkin (LNH) pode, algumas vezes, produzir efeitos colaterais. Para a maioria dos pacientes, os efeitos colaterais do tratamento são temporários e desaparecem assim que a terapia termina. Para outros pacientes, os efeitos colaterais podem ser mais graves, algumas vezes, necessitando de hospitalização. Alguns pacientes nunca têm efeitos colaterais. Antes de receber o tratamento, converse com o seu médico sobre os possíveis efeitos colaterais. Medicamentos e outras terapias podem prevenir ou controlar muitos efeitos colaterais. Converse também com o seu médico sobre efeitos de longo prazo e tardios do tratamento. Alguns tratamentos para LNH têm um alto risco de infertilidade.
Efeitos Colaterais Comuns
Os medicamentos quimioterápicos são os principais responsáveis quando se trata de causar efeitos colaterais indesejados. Esses medicamentos matam as células cancerosas, mas também danificam células normais. O revestimento da boca, garganta, estômago e intestinos são particularmente vulneráveis ao dano.
Os efeitos colaterais que você pode apresentar dependem de:
- A intensidade da quimioterapia;
- Os medicamentos usados durante a terapia;
- A localização da radioterapia;
- A sua idade;
- A saúde geral e se você tem alguma condição de saúde crônica, como diabetes ou doença renal.
Os efeitos colaterais a seguir são comuns à quimioterapia, radioterapia e ao transplante de células tronco.
- Infecções;
- Contagens baixas de células sanguíneas;
- Feridas na boca;
- Náusea e vômito;
- Diarreia;
- Constipação;
- Irritação da bexiga urinária;
- Sangue na urina;
- Fadiga extrema;
- Anemia;
- Febre;
- Tosse;
- Erupções cutâneas;
- Queda de cabelo;
- Fraqueza;
- Sensações de formigamento;
- Problemas no pulmão, coração, rins ou no nervo;
- Infertilidade;
- Doença do enxerto versus hospedeiro (se você passou por um transplante alogênico de células tronco).
REFRATÁRIO E RECIDIVADO
Alguns pacientes ainda têm células do linfoma em sua medula óssea após o tratamento para LNH. Isto é chamado ‘linfoma não Hodgkin refratário’. Alguns pacientes têm um retorno das células do linfoma na medula e um decréscimo nas células sanguíneas normais após a remissão. Isto é chamado ‘recidiva’.
Medicamentos Usados para o LNH Refratário e Recidivado
A maioria dos pacientes com LNH refratário ou recidivado recebe a terapia de segunda linha – tratamento diferente do tipo usado da primeira vez. Os regimes farmacológicos comuns de segunda linha, algumas vezes, seguidos pelo transplante de células tronco, incluem:
- ICE: ifosfamida (Ifex®), carboplatina (Paraplatin®), etoposida (Etopophos®, Toposar®, VePesid®, VP-16);
- RICE: rituximabe (Rituxan®), Ifex, carboplatina (Paraplatin®), etoposida;
- DHAP: dexametasona (Decadron®), citarabina (Cytosar-U®, citosina arabinosida, ara-C), cisplatina (Platinol®-AQ);
- ESHAP: etoposida, metilprednisolona (Medrol®), citarabina de alta dose, Platinol-AQ;
- R-ESHAP: Rituxan, etoposida, Medrol, citarabina de alta dose, Platinol-AQ.
Linfoma Não Hodgkin Refratário
O termo ‘linfoma não Hodgkin refratário’ é usado para descrever uma doença que não entra em remissão (mas pode estar estável) ou que piora nos seis meses desde o último tratamento.
Linfoma Não Hodgkin Recidivado
Se o seu linfoma voltar após uma remissão (sem sinal da doença) de seis meses ou mais, você apresentou uma recaída (recidiva). Você pode apresentar uma recaída (recidiva) meses ou anos após o tratamento. Se você tiver uma recaída muito tempo após o tratamento, você pode passar por tratamento semelhante ao que recebeu quando recebeu o diagnóstico. Os pacientes com LNH refratário normalmente são submetidos a quimioterapia de alta dose com transplante de células tronco.
Para pacientes com linfoma folicular de estágio avançado, o tratamento depende dos sintomas e da extensão de disseminação da doença. Para pacientes que já foram tratados com quimioterapia usando o regime CHOP, um transplante autólogo de células tronco pode ser uma opção.
LINFOMA NÃO HODGKIN INFANTIL
Tratamento
O diagnóstico de câncer de uma criança pode trazer consigo sentimentos de incerteza para os pais e outros familiares. De repente, você é empurrado para um mundo de mudanças rápidas, com preocupações, medos e incertezas. Você terá que tomar decisões de tratamento enquanto estiver confortando o seu filho – e ao mesmo tempo tentará enfrentar as suas próprias emoções.
O tratamento do seu filho depende de determinados fatores:
- O estágio da doença;
- O subtipo da doença;
- Se a doença é agressiva (crescimento rápido) ou indolente (crescimento lento);
- Se o linfoma está em áreas do corpo diferentes dos linfonodos (envolvimento extranodal);
- Possíveis fatores de risco que podem ser encontrados durante os exames laboratoriais.
O oncologista (especialista em câncer) do seu filho deve desenvolver um plano de tratamento que limita a quantidade de terapia necessária para atingir a remissão. Certifique-se de perguntar o oncologista sobre possíveis efeitos colaterais e efeitos de longo prazo ao considerar as opções de tratamento. Alguns efeitos de longo prazo, como infertilidade, podem ser sérios. Baixe ou peça a ficha técnica gratuita da Sociedade de Leucemia e Linfoma Fatos sobre Fertilidade.
Crianças com LNH podem, algumas vezes, ser tratadas de maneira diferente dos adultos. Escolher a terapia mais efetiva para adolescentes e adultos jovens (idade entre 15 e 29 anos) pode ser um desafio e é um tópico de pesquisa em andamento. De fato, o tratamento usado em adultos para determinados subtipos de LNH, incluindo o linfoma de Burkitt e o linfoma linfoblástico, já é, na realidade, uma terapia pediátrica.
Estudos Clínicos
Um estudo clínico pode ser uma opção quando se trata de encontrar o tratamento certo para o câncer do seu filho. Estudos clínicos para crianças, adolescentes e adultos jovens com câncer são geralmente projetados para comparar potencialmente a terapia mais efetiva com a terapia que é atualmente aceita como padrão. O seu filho terá acesso a terapias novas ou melhoradas em estudo e ainda não disponíveis no mercado. Discuta com o médico do seu filho sobre a possibilidade de participar de um estudo clínico, onde o tratamento é administrado em um ambiente seguro e criteriosamente monitorado.
Sobrevivência e Necessidades de Cuidado à Saúde Especiais
Após o tratamento, a maioria das crianças pode esperar ter vidas plenas e produtivas. Muitos sobreviventes voltam à escola, vão à faculdade, entram para a força de trabalho, casam-se e têm filhos. Você pode considerar um programa de sobrevivência para o seu filho que foca na vida após o câncer. A maioria dos principais hospitais em todo o mundo oferece esses programas.
Cuidado de Acompanhamento
O seu filho deve visitar o pediatra ou médico pelo menos uma vez por ano para um exame físico completo e testes adicionais necessários. O seu oncologista também deve examinar regularmente o seu filho.
As visitas regulares ao médico são encorajadas para:
- Permitir que os médicos avaliem o efeito completo da terapia;
- Detectar e tratar a recorrência da doença;
- dentificar e controlar efeitos de longo prazo e tardios do tratamento.
O seu pediatra deve recomendar um cronograma para avaliar as habilidades de aprendizado do seu filho. Se parecer que o seu filho está apresentando dificuldades de aprendizado, métodos de educação especial podem ajudar. É importante a coordenação entre o pediatra e o oncologista do seu filho para o melhor cuidado possível. Alguns centros de tratamento oferecem clínicas de cuidado abrangente de acompanhamento para crianças sobreviventes do câncer.
Efeitos de Longo Prazo e Tardios do Tratamento
Alguns efeitos colaterais do tratamento para câncer, como fadiga, podem durar meses ou anos após a terapia. Algumas condições médicas, como doença cardíaca e outros cânceres podem não aparecer até anos após o final do tratamento. Os efeitos de longo prazo e tardios podem impactar a saúde física mental e cognitiva (função cerebral) do seu filho.
A maioria dos sobreviventes do linfoma infantil não desenvolve efeitos significativos de longo prazo ou tardios do tratamento. No entanto, para alguns pacientes, os efeitos podem variar de leves a graves.
Efeitos de Longo Prazo e Tardios da Quimioterapia
As crianças tratadas para linfoma podem estar em risco aumentado para:
- Fadiga;
- Atraso no crescimento;
- Disfunção da tireoide;
- Perda na audição;
- Um câncer secundário.
Alguns efeitos de longo prazo e tardios se tornam visíveis com a maturação (puberdade), crescimento e o processo normal de envelhecimento. A intervenção precoce e práticas de estilo de vida saudável (não fumar, dieta equilibrada, prática de exercícios, check-ups e acompanhamento regulares) ajudam.
Efeitos de Longo Prazo e Tardios da Radioterapia
As meninas (e também mulheres com menos de 30 anos de idade) que recebem radiação na área das mamas estão em risco para desenvolver câncer de mama 15 a 20 anos após o tratamento. Os meninos sobreviventes do câncer infantil estão em risco de desenvolver um segundo câncer, mas não têm um risco tão alto para desenvolver câncer de mama que as meninas sobreviventes do câncer infantil.
As meninas que receberam radioterapia na área do tórax (mediastinal) devem:
- Realizar autoexames mensais da mama;
- Fazer uma mamografia basal com 25 a 30 anos de idade ou 10 anos após a radioterapia;
- Fazer um exame clínico anual da mama;
- Fazer uma mamografia a cada dois a três anos, dependendo da densidade do tecido mamário.
As meninas e meninos que tiverem recebido radioterapia mediastinal devem fazer o teste basal para a função cardíaca. Isto deve ser seguido pelo teste a cada três a cinco anos após o tratamento ou com mais regularidade se forem encontradas anormalidades.
Volta à Escola
Dificuldades no aprendizado podem começar durante o tratamento ou aparecer meses ou anos depois. Educar os familiares, amigos, professores e profissionais de saúde sobre os possíveis efeitos de longo prazo e tardios do tratamento do seu filho. Conversar com os professores e profissionais de saúde do seu filho para desenvolver um programa personalizado às suas necessidades que apresente teste basal, acomodações especiais e planejamento no longo prazo.
O seu médico determinará a extensão de progressão da sua doença pelo estadiamento. O estadiamento ajuda o seu médico a calcular a progressão da doença e a desenvolver um plano de tratamento.
O LNH nem sempre começa no estágio I e se espalha para estágios mais avançados. Mais da metade de todos os pacientes com doença intermediária ou agressiva e mais de 80 por cento de todos os pacientes com doença indolente são diagnosticados com LNH de estágio III ou IV. E, se alguém for diagnosticado no estágio IV, não significa que a doença é incurável – ela pode ser altamente curável dependendo do subtipo.
Estágio I
Envolvimento de um grupo de linfonodos
Estágio II
Envolvimento de dois ou mais grupos de linfonodos do mesmo lado do diafragma (um músculo fino abaixo dos pulmões)
Estágio III
Envolvimento de grupos de linfonodos em ambos os lados do diafragma
Estágio IV
Envolvimento de um ou mais órgãos, diferente dos linfonodos, e possível envolvimento dos linfonodos
Categorias A, B, X e E
Os quatro estágios do LNH podem ser divididos em categorias:
- Categoria A: Sem febre, sem sudorese exagerada ou sem perda de peso presentes;
- Categoria B: Febre, sudorese excessiva e perda de peso presentes;
- Categoria X: Doença volumosa (massas grandes de linfócitos) presente;
- Categoria E: O linfoma se espalhou para áreas ou órgão foram dos linfonodos, ou para tecidos além, mas próximos, das principais áreas linfáticas.
Por exemplo, o estágio IIB indica que o paciente tem:
- Dois locais de linfonodos próximos um do outro com envolvimento da doença (por exemplo, linfonodos aumentados no pescoço e próximos à clavícula, ou no pescoço e axila);
- Febre, sudorese excessiva e perda de peso.
O seu tratamento depende do seu estágio e categoria. Os pacientes que se enquadram na categoria B geralmente precisam de tratamento mais agressivo do que os pacientes na categoria A.
Linfoma é um tipo de câncer que se inicia nas células que fazem parte do sistema imunológico do nosso corpo – o Sistema linfático. O linfoma é um câncer do sangue e é a patologia que tem maiores chances de CURA. É importante saber qual o tipo de linfoma você tem, pois cada tipo tem uma forma de tratamento e prognóstico. Existem dois tipos principais de linfoma: o LINFOMA HODGKIN (LH) e o LINFOMA NÃO-HODGKIN (LNH). Pergunte ao médico o seu tipo de linfoma e fique atento ao tratamento ideal!
O que é?
- É um tipo de câncer que afeta o sistema linfático;
- Geralmente se desenvolve nos linfonodos e nos tecidos linfáticos. Em alguns casos, o LNH envolve a medula óssea e o sangue;
- Não é apenas uma doença – é, na realidade, um grupo diverso de cânceres do sangue que compartilham uma única característica em como eles se desenvolvem;
- O LNH possui muitos subtipos diferentes que são indolentes (de crescimento lento) ou agressivo (crescimento rápido).
O Que Você Deve Saber:
- Os hematologistas e oncologistas são especialistas que tratam pessoas que têm LNH ou outros tipos de câncer do sangue;
- O tratamento de pessoas que têm o LNH pode incluir a terapia farmacológica e a radioterapia;
- É importante saber o seu subtipo de LNH;
- Procure tratamento em um centro de câncer em que os médicos são experientes no tratamento de pacientes com linfoma;
- Converse com o seu médico sobre seus testes diagnósticos e o significado dos resultados;
- Assegure que você saiba o seu subtipo de LNH – subtipos diferentes têm tratamentos diferentes.
Como o LNH se Desenvolve?
O LNH geralmente começa com uma alteração anormal em uma célula branca em um linfonodo ou tecido linfoide chamado linfócito. Pode começar em um de três tipos principais de linfócitos:
- Linfócitos B (células B), que produzem anticorpos para ajudar a combater infecções;
- Linfócitos T (células T), que têm diversas funções, incluindo auxiliar os linfócitos B a produzir anticorpos;
- Células ‘natural killer’ (NK), que atacam as células infectadas com vírus ou células tumorais
Cerca de 85% dos casos de LNH começam nas células B. O seu médico planeja o seu tratamento de acordo com o tipo de célula em que o seu LNH se desenvolveu.
O linfócito anormal cresce fora de controle e produz mais células anormais como ele.
- Esses linfócitos anormais (células do linfoma) se acumulam e formam massas (tumores). Se o LNH não for tratado, as células cancerosas se acumulam para fora das células brancas normais, e o sistema imunológico não pode deter a infecção de modo efetivo;
- O LNH que se desenvolve ou se dissemina para outras áreas do corpo em que o tecido linfoide é encontrado, como o baço, o trato digestivo e a medula óssea é chamado linfoma extranodal primário;
- O LNH é classificado em mais de 30 subtipos diferentes. Os médicos classificam os subtipos de LNH em categorias que descrevem com que rapidez ou lentidão a doença está progredindo:
- LNH agressivo;
- LNH indolente (crescimento lento).
SUBTIPOS DO LNH
O linfoma não Hodgkin (LNH) possui cerca de 60 subtipos classificados pela Organização Mundial de Saúde (OMS). É importante saber o seu subtipo, já que ele representa uma parte importante na determinação do tipo de tratamento que você receberá. Você deve considerar obter uma segunda opinião de um hematopatologista sobre seu diagnóstico.
Os subtipos de LNH são classificados por determinados fatores, como o tipo de linfócito em que eles se desenvolvem. Os dois principais subtipos são:
- linfoma de células B;
- linfoma de células T e de células ‘natural killer’ (NK).
A maioria das pessoas (85 por cento) tem o tipo de linfoma de células B. Uma pequena porcentagem de pessoas tem um tipo de LNH que se enquadra em um terceiro grupo: transtornos linfoproliferativos associados à imunodeficiência.
Alguns dos nomes de subtipos se relacionam às áreas dos linfonodos (“folículo,” “manto” e zonas “marginais”) que eles parecem se originar.
Estão listados abaixo alguns subtipos de linfomas de células B e células T e NK. O subtipo mais comum é o linfoma difuso de grandes células B (DLBCL), que constitui cerca de 30 por cento de todos os casos de LNH nos Estados Unidos.
Subtipos de Linfoma de Células B
- Linfoma de Burkitt – leucemia de Burkitt;
- Linfoma do sistema nervoso central (SNC);
- Linfoma difuso de grandes células B;
- Linfoma extranodal da zona marginal de células B;
- Linfoma folicular;
- Linfoma intravascular de grandes células B;
- Granulomatose linfomatoide;
- Linfoma linfoplasmacítico – macroglobulinemia de Waldenstrom;
- Linfoma de células do manto. (Vide ficha técnica gratuita da LLS, Fatos sobre o Linfoma de Células do Manto, para mais informações);
- Linfoma mediastinal (tímico) de grandes células B;
- Linfoma do tecido linfático associado a mucosa (MALT);
- Linfoma nodal da zona marginal de células B;
- Linfoma primário de cavidade pleural;
- Linfoma linfocítico de pequenas células –leucemia linfocítica crônica;
- Linfoma esplênico de zona marginal.
Subtipos de Linfoma de Células T e de Células ‘Natural Killer’
- Linfoma anaplásico de grandes células;
- Linfoma angioimunoblástico de células T;
- Linfoma cutâneo de células T (síndrome de Sézary e micose fungoide);
- Linfoma hepatoesplênico;
- Linfoma de células NK;
- Linfoma de células T periféricas, não especificado de outro modo.
Formas do LNH
Os médicos classificam os subtipos de LNH em categorias que descrevem com que rapidez ou lentidão a doença está progredindo:
- LNH Agressivo, também chamado de crescimento rápido ou de alto grau, constitui cerca de 60 por cento dos casos de LNH nos Estados Unidos. O subtipo agressivo mais comun é o linfoma difuso de grandes células B.
- LNH Indolente, também chamado de crescimento lento ou de baixo grau, constitui cerca de 40 por cento dos casos de LNH nos Estados Unidos. O subtipo indolente mais comun é o linfoma folicular.
Alguns pacientes têm a doença de “grau intermediário”, que se desenvolve a uma velocidade entre a forma indolente e agressiva. E algumas vezes, o LNH indolente pode “se transformar” para o LNH agressivo.
Os médicos não sabem por que algumas células se tornam linfoma não Hodgkin (LNH) e outras não. Para a maioria das pessoas que têm LNH, não existe motivos óbvios pelos quais elas desenvolveram a doença. Os pesquisadores identificaram determinados fatores de risco em potencial que podem aumentar as chances de desenvolver o LNH. Eles descobriram que pessoas que vivem e trabalham em comunidades agrícolas tendem a ter uma incidência maior de LNH. Estudos sugerem que pode haver uma ligação com alguns ingredientes encontrados em herbicidas e pesticidas. Os pesquisadores também acreditam que o LNH pode estar associado a exposição a determinadas bactérias e vírus, especialmente aquelas que suprimem o sistema imunológico, como:
- Vírus da imunodeficiência humana /síndrome da imunodeficiência adquirida (HIV/AIDS);
- Vírus Epstein-Barr;
- Vírus linfocitotrópico T humano (HTLV);
- Helicobacter pylori (a bactéria que causa as úlceras de estômago);
Você não pode pegar o LNH de alguém. Os especialistas descobriram que cerca de uma dúzia de síndromes herdadas – porém raras – podem aumentar o risco do LNH.
O sinal inicial mais comum de linfoma não Hodgkin (LNH) é o inchaço (aumento) indolor de um ou mais linfonodos no pescoço, axila ou virilha. A maioria das pessoas tem linfonodos afetados na parte superior do corpo, geralmente no pescoço ou do tórax superior. Algumas vezes, você pode sentir o linfonodo afetado na sua axila ou virilha.
Além dos linfonodos inchados, outros sinais e sintomas do LNH incluem:
- Febre sem uma causa óbvia;
- Sudorese excessiva especialmente à noite;
- Cansaço ou sem energia;
- Perda de apetite;
- Perda inexplicada de peso;
Se o LNH iniciar em uma área diferente dos linfonodos, como no osso, no pulmão, no trato digestivo (gastrintestinal) ou na pele, os sintomas podem incluir:
- Erupções cutâneas;
- Dor óssea;
- Tosse;
- Dor torácica;
- Dor abdominal (área do estômago);
- Caroços sob a pele.
Alguns sintomas do LNH estão associados a outras doenças menos sérias. Por exemplo, linfonodos aumentados podem resultar da inflamação e não são necessariamente um sinal de câncer. No entanto, se estiver incomodado com algum dos sintomas acima, procure o seu médico. Algumas vezes, você pode não apresentar sintomas. Neste caso, o seu médico pode ser o primeiro a notar os sinais, como linfonodos aumentados, durante um exame físico de rotina.
Biópsia do Linfonodo
O diagnóstico do linfoma não Hodgkin (LNH) geralmente envolve a realização de uma biópsia do linfonodo. Se a biópsia confirmar que você tem a doença, o seu médico realiza testes adicionais para estadiar o linfoma.
A finalidade de uma biópsia de linfonodo é confirmar o diagnóstico e:
- Identificar o subtipo do seu LNH;
- Desenvolver um plano de tratamento.
Exames Laboratoriais para Confirmar um Diagnóstico:
Após o seu médico coletar amostras do seu linfonodo e tecidos, um hematopatologista as examina sob um microscópio para procurar identificar características do LNH. Ele ou ela confirma um diagnóstico e identifica o subtipo do LNH. Um hematopatologista é um especialista que estuda doenças das células sanguíneas pela análise das amostras das células do sangue e da medula óssea e de outros tecidos.
O hematopatologista usa um ou mais exames laboratoriais, como os descritos a seguir para examinar as suas células:
- Imunofenotipagem confirma um diagnóstico do LNH e identifica as células do linfoma como células B, células T ou células ‘natural killer’;
- Análise citogenética procura por alterações nos cromossomos. As anormalidades ajudam a identificar o subtipo do LNH;
- Perfil de expressão gênica e análise por microarranjo identificam o subtipo e fatores de risco. Eles ajudam a prever a resposta ao tratamento e identificar os pacientes que podem estar em risco aumentado para recidiva;
- Reação em cadeia da polimerase (PCR) analisa determinados genes para ajudar a prever a resposta ao tratamento. Este teste é também usado para detectar células de linfoma residuais que são muito pequenas para serem vistas sob um microscópio.
Como o LNH é uma doença difícil de diagnosticar, você pode querer obter uma segunda opinião médica de um hematopatologista experiente antes de iniciar o tratamento. Alguns tipos de LNH podem ser confundidos entre eles. O tratamento apropriado depende de ter o diagnóstico correto.
TESTES DE ESTADIAMENTO
Assim que o seu médico confirmar o diagnóstico de LNH, ele ou ela faz mais testes para estadiar a sua doença. O estadiamento identifica a extensão da sua doença e onde ela está localizada no seu corpo.
Os testes de estadiamento incluem:
- Um exame físico;
- Exames de imagem;
- Exames de sangue;
- Exames da medula óssea.
Exames de Imagem
O seu médico conduz um ou mais exames de imagem (também chamado radiologia diagnóstica), juntamente com um exame físico, para verificar:
- A localização e distribuição dos linfonodos aumentados;
- Os efeitos da doença, se houver, em outros órgãos, como os pulmões ou fígado;
- Massas tumorais grandes.
Os exames de imagem podem incluir:
- Uma radiografia (raio-X);
- Uma varredura de tomografia computadorizada (TC) do pescoço, tórax, pelve e abdômen (área do estômago);
- Uma varredura de imagem por ressonância magnética (IRM);
- Uma varredura de tomografia de emissão de pósitrons (PET);
- Uma varredura de PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo (F-18).
Exames de Sangue
Após a coleta do seu sangue, ele é enviado a um laboratório para um hemograma completo (CBC) e exames adicionais. O seu sangue é dosado para:
- Níveis de células vermelhas (eritrócitos), células brancas (leucócitos) e plaquetas;
- A presença de células do linfoma;
- Anormalidades ou deficiências de imunoglobulinas causadas pelos linfócitos;
- Níveis séricos de proteína;
- Níveis de ácido úrico;
- Velocidade de hemossedimentação (a velocidade para as células vermelhas se depositarem no fundo de um tubo de ensaio – uma velocidade aumentada pode indicar câncer);
- Função hepática e renal;
- Evidência de hepatite A ou B;
- Dois marcadores biológicos, lactato desidrogenase (LDH) e beta 2-microglobulina.
Exames da Medula Óssea
O seu médico pode decidir examinar a sua medula óssea para ver se a doença se espalhou. Se a sua doença estiver em um estágio inicial e alguns sinais e sintomas não tiverem aparecido, você pode não precisar fazer o teste. O exame da medula óssea envolve duas etapas geralmente feitas ao mesmo tempo em um consultório médico ou no hospital:
- Uma aspiração da medula óssea para coletar uma amostra líquida da medula;
- Uma biópsia de medula óssea para retirar uma pequena quantidade de osso preenchido com medula.
O seu médico também pode coletar amostras de medula óssea durante o tratamento para determinar a efetividade da sua terapia.
Outros Exames para Subtipos Específicos
Determinados exames são realizados somente para subtipos específicos e não necessariamente para todos os pacientes com LNH. Eles incluem:
- Endoscopias alta e baixa para pacientes cuja doença envolve o trato digestivo (gastrintestinal);
- Colonoscopia para pacientes que têm linfoma de células do manto;
- Uma punção lombar para pacientes cujo sistema nervoso central pode ser afetado pelo LNH;
- Imagem do cérebro ou da coluna vertebral para pacientes cujo sistema nervoso ventral pode ser afetado pelo LNH.
É importante que o seu médico seja experiente no tratamento de pacientes com linfoma não Hodgkin (LNH) ou trabalhe em consulta com um especialista em LNH. Este tipo de especialista é geralmente chamado de oncologista hematologista.
Tipos de Tratamento
Os médicos usam diversos tipos de abordagens e combinações de tratamento para o LNH, alguns em estágios diferentes:
- Quimioterapia e outra terapia farmacológica;
- Radioterapia, geralmente combinada com a quimioterapia;
- Transplante de células tronco;
- Observar e esperar;
- O seu médico pode sugerir que você participe de um estudo clínico. Estudos clínicos podem envolver a terapia com novos medicamentos e novas combinações de medicamentos ou novas abordagens para o transplante de células tronco.
Também pode haver grandes diferenças entre o tratamento para o LNH agressivo e o tratamento para o LNH indolente. Leia sobre cada um em:
- Tratamento para o LNH agressivo;
- Tratamento para LNH indolente.
Considerações de Pré-Tratamento
Adultos em idade fértil e pais de crianças diagnosticados com LH devem pedir aos seus médicos informações sobre como reduzir o risco de infertilidade. Vide a publicação gratuita da LLS Fatos sobre Fertilidade para mais detalhes.
Encontrando a Melhor Abordagem de Tratamento
O objetivo do tratamento para LNH é destruir o maior número de células do linfoma possível para induzir a remissão completa (sem traço da doença). Os pacientes que entram em remissão são, algumas vezes, curados da doença.
O tratamento pode manter o LNH controlado por muitos anos, mesmo se os testes mostrarem algumas células do linfoma remanescentes. Isto é chamado remissão parcial.
O tratamento que o seu médico recomendar é baseado em diversos fatores, incluindo:
- O subtipo da sua doença;
- Se a sua doença é agressiva (crescimento rápido) ou indolente (crescimento lento);
- O estágio e categoria da sua doença;
- Se o linfoma está em áreas do corpo, diferente dos seus linfonodos (envolvimento extranodal);
- A sua saúde geral e se você tem alguma condição, como doença cardíaca, doença renal, doença pulmonar, diabetes ou anemia.
Enquanto você desenvolve um plano de tratamento com o seu médico, certifique-se de discutir:
- Os resultados que você pode esperar com o tratamento;
- Possíveis efeitos colaterais, incluindo efeitos de longo prazo e tardios;
- A possibilidade de participar de um estudo clínico, onde você terá acesso a tratamento médico avançado que pode ser mais benéfico a você do que o tratamento padrão.
Você pode achar útil levar alguém próximo a você às suas visitas com o seu médico para apoio, para tomar notas e fazer perguntas de acompanhamento. Uma sugestão é preparar as perguntas que gostaria de fazer quando visitar o seu médico. Você também pode registrar as suas conversas com o seu médico e ouvir com mais atenção ao chegar em casa.
Outras Considerações de Tratamento
Se você estiver em idade fértil, converse com o seu médico sobre os possíveis efeitos de longo prazo do tratamento na fertilidade;
Se o seu filho estiver sendo tratado para LNH, a terapia pode diferir daquela do adulto normal. Você também precisa pensar sobre os efeitos de longo prazo do tratamento, incluindo os efeitos na fertilidade;
Se tiver 60 anos ou mais de idade, o seu tratamento pode variar das abordagens padrão. Por exemplo, o seu corpo pode não ser capaz de tolerar os medicamentos quimioterápicos tóxicos ou você pode ter outras enfermidades que são mais comuns à medida que envelhecemos. Esses fatores, entre outros, podem tornar mais complicada a escolha de um tratamento. No entanto, a idade mais avançada não é um fator determinante no tratamento para a maioria dos pacientes.
Para muitas pessoas com linfoma não Hodgkin (LNH), iniciar o tratamento os auxilia a focar em seguir adiante e buscar pela remissão de sua doença.
QUIMIOTERAPIA E TERAPIA FARMACOLÓGICA
Durante a quimioterapia, você recebe medicamentos potentes que devem ser tóxicos o suficiente para danificar ou matar as células leucêmicas. Ao mesmo tempo, eles têm como alvo as células normais e causam efeitos colaterais. Porém, nem todos apresentam efeitos colaterais da mesma maneira.
Os médicos combinam comumente quatro ou mais medicamentos quimioterápicos para tratar o linfoma não Hodgkin (LNH). Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. Combinar tipos de medicamento pode aumentar a sua efetividade. Você pode receber os medicamentos em pílulas para engolir, por injeção ou através de um cateter (um tubo fino, flexível ou linha intravenosa) colocado cirurgicamente em uma veia, normalmente no seu tórax superior.
A quimioterapia é administrada em ciclos, geralmente com várias semanas de intervalo, em um contexto ambulatorial. Você precisará de uma série de ciclos durante seis a 10 meses. Você pode precisar permanecer no hospital por um período curto durante o tratamento se a sua terapia for particularmente intensiva ou se ela levar à infecção ou a decréscimos prolongados ou graves nos hemogramas.
CHOP
Um regime de medicamentos quimioterápicos comum para o LNH é chamado CHOP. Os nomes das combinações são geralmente abreviações para a primeira letra dos medicamentos usados. Os medicamentos em CHOP são:
- Ciclofosfamida (Cytoxan®);
- Doxorrubicina (hidroxidoxorrubicina);
- Vincristina (Oncovin®);
- Prednisona.
Os médicos podem adicionar o anticorpo monoclonal, rituximabe (Rituxan®), a esta mistura, que pode ajudar na efetividade do tratamento ao direcionar moléculas específicas para as células cancerosas. Denominado R-CHOP, esta é a combinação mais comumente usada de quimioterapia e anticorpo monoclonal para o LNH agressivo. Ela pode ser muito efetiva e, algumas vezes, cura o LNH.
Outras Terapias Farmacológicas
Os médicos usam um vasto arranjo de medicamentos para tratar os subtipos diferentes do LNH, atacando-os de muitos ângulos diferentes:
- Medicamentos que danificam o DNA interrompem o crescimento de células cancerosas ao modificar quimicamente o DNA que está ajudando o LNH a se desenvolver;
- Anticorpos antitumorais interagem com o DNA para interferir com a sobrevida de células cancerosas;
- Antimetabólitos são substâncias químicas que bloqueiam a capacidade das células de formar o DNA ou RNA, o que previne o crescimento celular;
- Medicamentos inibidores do proteassoma limitam os efeitos de uma estrutura celular chamada proteassoma, o que torna mais difícil para as células cancerosas sobreviverem;
- Inibidores da enzima de reparo do DNA atacam determinadas enzimas (proteínas) em células que tornam o DNA mais suscetível a dano;
- Medicamentos quimioterápicos bloqueiam um processo chamado mitose, que interrompe as células de se dividirem, limitando assim a produção de células cancerosas;
- Hormônios destruidores de linfócitos, relacionados ao hormônio natural, cortisol, são usados em doses altas para destruir as células cancerosas;
- Anticorpos monoclonais, usados durante a imunoterapia, são uma classe de agentes que tem como alvo e destroem células cancerosas com menos efeitos colaterais do que a quimioterapia tradicional.
RADIOTERAPIA
A radioterapia é, algumas vezes, usada para destruir as células do linfoma não Hodgkin (LNH) que se acumularam em uma área do corpo. Poucos casos de LNH são tratados somente com a radioterapia porque é provável que as células do linfoma estejam espalhadas por todo o corpo. Porém, ela pode ser usada com outras terapias, como a quimioterapia se você tiver massas particularmente grandes de linfoma em uma área. Ela é também usada quando linfonodos grandes estão pressionando ou invadindo órgãos ou estruturas e a quimioterapia isolada não pode controlar o problema.
Durante a terapia, a radiação é dirigida somente às áreas do seu corpo afetadas pelo LNH. Uma máquina chamada acelerador linear, ou linac, aplica feixe de radiação a área(s) alvo(s) do seu corpo enquanto você está deitado em uma mesa móvel. Partes do seu corpo não afetadas pelo linfoma de Hodgkin, como os órgãos reprodutores são protegidos para ajudar a reduzir os efeitos colaterais do tratamento. O procedimento em si é indolor, embora algumas pessoas possam sentir desconforto ao permanecer na mesma posição por vários minutos durante a sessão.
TRANSPLANTE DE CÉLULAS TRONCO
Alguns pacientes podem ter linfoma que resiste ao tratamento ou que volta após um período de remissão. Se você se enquadra em uma dessas categorias o seu médico pode recomendar um transplante autólogo de células tronco para que você possa tolerar melhor a quimioterapia intensiva. Devido aos altos riscos, por vezes, com risco à vida, do transplante de células tronco, os médicos não o recomendam para o tratamento inicial. No entanto, o transplante autólogo de células tronco pode curar alguns pacientes, cujo linfoma está na primeira recidiva (o linfoma voltou após um período sem sinal da doença). O transplante para a primeira remissão está sendo feito apenas em estudos clínicos, com algumas exceções, como no tratamento do linfoma de células do manto. Existem vários tipos de transplante de células tronco. Os pacientes com linfoma não Hodgkin (LNH) mais comumente são submetidos ao transplante autólogo de células tronco, quando as suas próprias células tronco não cancerosas são “coletadas”, ou recuperadas, do seu corpo e congeladas. As suas células são devolvidas ao seu corpo por injeção após receber a terapia farmacológica intensiva.
O transplante autólogo não apresenta tanto risco quanto o transplante alogênico de células tronco quando as células tronco são provenientes de um doador compatível. O transplante alogênico de células tronco é usado para tratar somente pacientes selecionados com LNH.
OBSERVAR E ESPERAR
Algumas pessoas podem controlar o seu linfoma não Hodgkin (LNH) com seus médicos por anos usando a abordagem observar e esperar. Ao usar o método observar e esperar, o seu médico pode monitorar a sua condição com exames físicos e exames laboratoriais regulares. Você não tomará medicamentos ou será submetido a algum tratamento para LNH durante este período. Observar e esperar é uma abordagem de tratamento usada para o LNH indolente.
Você pode se sentir desconfortável porque sabe que tem câncer, porém não está sendo imediatamente tratado. Tenha certeza que a abordagem observar e esperar é o cuidado padrão para pessoas cuja doença não se espalhou e que não têm sintomas. A abordagem observar e esperar permite que você evite os efeitos colaterais da terapia até que precise de tratamento. O tratamento do LNH durante este estágio inicial não provou ser útil.
Você deve visitar o seu médico regularmente para que ele ou ela possa examiná-lo para qualquer alteração à saúde, especificamente observar se a sua doença permanece estável ou começa a progredir. O seu médico monitora os resultados do seu teste para decidir quando é hora de iniciar o tratamento e qual é a melhor opção de tratamento para você. Cerca da metade de todos os pacientes pode adiar o tratamento por pelo menos três anos. Alguns pacientes que permaneceram no modo observar e esperar por mais de 10 anos nunca precisaram de tratamento.
Observar e esperar também pode ser a melhor abordagem para alguns pacientes diagnosticados com LNH disseminado que o tratamento provavelmente não curará. A doença, embora disseminada, pode permanecer estável por anos, permitindo que eles evitem os efeitos colaterais da terapia desnecessária.
Quando Iniciar o Tratamento
O seu médico pode aconselhá-lo a iniciar o tratamento se tiver:
- Linfonodos que estão aumentando de tamanho;
- Linfonodos recém-afetados;
- Ossos ou outros órgãos que foram afetados pelo LNH;
- Um decréscimo no número de células sanguíneas.
Pesquisa e Estudos Clínicos Atuais no LNH
A seguir estão alguns dos tipos de pesquisa e estudos em andamento no LNH:
Medicamentos em Estudo
- O agente quimioterápico bendamustina (Treanda®), aprovado para a leucemia linfocítica crônica (LLC) e LNH indolente recidivado, está sendo estudado no linfoma de células do manto recém-diagnosticado, com rituximabe (Rituxan®) e lenalidomida (Revlimid®);
- Bortezomibe (Velcade®), um medicamento chamado “inibidor do proteassoma” que está aprovado para tratar pacientes com linfoma de células do manto que receberam pelo menos uma terapia prévia, está agora sendo investigado para efetividade como parte do tratamento inicial para o linfoma de células do manto. Os pesquisadores estão também explorando o uso de Velcade combinado a outros agentes, como Treanda e lenalidomida (Revlimid®);
- Agentes chamados “inibidores da histona desacetilase (HDAC)” são uma classe de medicamentos que tratam alterações “epigenéticas” no DNA. Um inibidor da HDAC, vorinostat (Zolinza®), que controla como o DNA é regulado, está aprovado para o tratamento de pacientes com linfoma cutâneo de células T que têm a doença progressiva, persistente ou recorrente durante ou após o tratamento com duas terapias sistêmicas. Este agente está agora sendo estudado para tratar o linfoma de células T e de células B isoladamente e em combinação com outros medicamentos;
- O medicamento imunomodulatório, Revlimid, está sendo estudado como tratamento para o linfoma difuso de grandes células B, linfoma de células do manto, linfoma folicular e leucemia linfocítica crônica (LLC);
- A terapia com o anticorpo monoclonal, ítrio-90-ibritumomabe tiuxetano (Zevalin®) foi aprovada para o linfoma de baixo grau recidivado e para pacientes com LNH folicular anteriormente não tratado que atingem uma resposta parcial ou completa à quimioterapia de primeira linha. A efetividade deste agente está agora sendo estudada no retratamento do linfoma, como terapia para o linfoma indolente recém-diagnosticado, como terapia para as formas agressivas do LNH combinado com ou após outros regimes farmacológicos e como parte de programas de terapia de alta dose juntamente com o transplante autólogo de células tronco;
- Ofatumumabe (Arzerra®) é um anticorpo monoclonal aprovado para o LLC recidivado e está agora sendo estudado em estudos clínicos em diversas combinações para o tratamento da leucemia linfocítica crônica, do linfoma difuso de grandes células B e do linfoma folicular;
- Pralatrexato (Foloytn®), aprovado para diversos subtipos de linfoma de células T, está sendo estudado em combinação com outros medicamentos quimioterápicos. Pralatrexato é um tipo de quimioterapia que interrompe processos em que as células são necessárias para a replicação celular.
- Existem diversos outros medicamentos em investigação que tem como alvo as vias de sinalização do receptor da células B dentro das células do linfoma. Alguns desses medicamentos incluem:
- Everolimo, um inibidor de mTOR, está sendo estudado em combinação com outros tratamentos para o LNH anteriormente tratado.
- Ibrutinibe (ImbruvicaTM), um inibidor de BTK que está sendo estudado em pacientes com LLC/LLS e linfoma de células do manto anteriormente não tratados.
- Idelalisibe, um inibidor oral da PI3K, que está sendo estudado para o tratamento de pacientes com LNH indolente que é refratário ao Rituxan e a uma quimioterapia contendo agente alquilante. Este medicamento está sendo desenvolvido como um agente único e em combinação com outra terapia.
- Tensirolimo, um inibidor de mTOR, está sendo atualmente estudado em combinação com outros tratamentos para o LNH anteriormente tratado.
Perfil por Expressão Gênica (GEP) e Microarranjos de Tecido (TMAs)
Essas são ferramentas que nos ajudam a entender melhor a biologia do linfoma. GEP e TMAs nos ajudam a caracterizar o linfoma com mais cuidado. Por exemplo, determinados biomarcadores em células tumorais estão associados a uma maior ou menor resposta à terapia e podem servir como preditores, indicando se alguém irá recidivar com a terapia ou se a sua doença se comportará de modo mais ou menos agressivo. Alguns dos mais importantes desses biomarcadores são baseados em gene. Uma ferramenta usada para analisar a atividade dos genes é chamada de “microarranjo”.
Microambiente
Existe um foco crescente na análise do microambiente tumoral; ou seja, as células que estão associadas ao tumor, ao invés do tumor em si. No linfoma folicular, determinadas células que são encontradas na realidade próximas às células tumorais têm demonstrado predizer um resultado melhor ou pior.
Transplante de Células Tronco de Intensidade Reduzida (Transplante Alogênico Não Mieloablativo)
Estudos clínicos estão em andamento para determinar a utilidade desta abordagem em pacientes com mais idade e mais enfermos para muitos cânceres do sangue, incluindo alguns subtipos do LNH. Consequentemente, o transplante pode ser uma opção para pacientes com idade entre 60 e 70 anos. Os pacientes que são condicionados para um transplante de intensidade reduzida recebem doses mais baixas de medicamentos quimioterápicos e/ou radiação em preparação para o transplante. Medicamentos imunossupressivos são usados para prevenir a rejeição do enxerto (as células imunológicas do doador), permitindo que as células imunológicas enxertadas ataquem a doença do receptor. A efetividade do transplante de intensidade reduzida é graças ao efeito enxerto versus linfoma dos linfócitos do doador e não às altas doses de quimioterapia.
Vacinas
Os cientistas estão desenvolvendo vacinas que estimulam o sistema imunológico a combater e suprimir o crescimento de células do linfoma. Diferente das vacinas clássicas, elas não previnem a doença; mas, se usadas durante a remissão, estimulam o sistema imunológico a atacar as células residuais do linfoma e impede-as de causar uma recidiva.
TRATAMENTO PARA SUBTIPOS AGRESSIVOS DO LNH
O linfoma não Hodgkin (LNH) agressivo progride rapidamente. Ele constitui cerca de 60 por cento de todos os casos de LNH nos Estados Unidos. Os subtipos agressivos incluem:
- Linfoma associado a AIDS;
- Linfoma anaplásico de grandes células;
- Linfoma de Burkitt;
- Linfoma do sistema nervoso central (SNC);
- Linfoma difuso de grandes células B (LDCBG);
- Linfoma hepatoesplênico;
- Linfoma de células do manto;
- Linfoma do tecido linfoide associado a mucosa (MALT) (transformado);
- Linfoma de células T periférico (a maioria dos tipos);
- Linfoma folicular transformado.
O objetivo do tratamento para muitos subtipos é a cura. O tratamento para o LNH agressivo começa no momento do diagnóstico.
A quimioterapia provou ser geralmente uma abordagem efetiva para tratar os subtipos agressivos. O cuidado padrão para cada subtipo varia. A seguir estão alguns exemplos de abordagens específicas à terapia:
- Doença de estágio inicial. O tratamento pode incluir a combinação quimioterápica CHOP ou a radioterapia de campo envolvido, ou ambos. Às vezes, o anticorpo monoclonal, rituximabe (Rituxan®), é adicionado ao regime CHOP (R-CHOP);
- Doença de estágio avançado. O tratamento de primeira linha é CHOP com Rituxan (R-CHOP);
- Doença que se espalhou para outras áreas ou órgãos. Se o linfoma está na medula óssea, nos seios nasais ou nos testículos ou próximo à coluna vertebral, existe o risco que ela possa se espalhar para o sistema nervoso central. Nessas circunstâncias, a quimioterapia pode ser administrada diretamente no líquor;
- Doença de alto risco. Fatores associados a um alto risco para recidiva após a terapia padrão incluem altos níveis ou a presença de determinadas proteínas no sangue e a mutação do gene p53. Nesses casos, é necessário um tratamento inicial mais agressivo do que o normal. Um estudo clínico pode ser uma opção de tratamento efetiva.
Tratando os Subtipos Agressivos Específicos
Linfoma Associado à AIDS
Determinados tipos de LNH são vistos com mais frequência em pessoas que têm a síndrome da imunodeficiência adquirida (AIDS), incluindo o linfoma difuso de grandes células B, linfoma de Burkitt e linfoma primário do sistema nervoso central. O resultado do tratamento depende de como a AIDS está respondendo à terapia. Como a AIDS já leva a baixas contagens de células brancas, a quimioterapia deve ser considerada cuidadosamente para determinar se o efeito adicional do tratamento nos níveis sanguíneos pode ser controlado. A melhora do tratamento para o vírus da imunodeficiência humana (HIV) nos últimos anos tem ajudado a reduzir o número de pessoas diagnosticadas com LNH associado à AIDS.
Linfoma Anaplásico de Grandes células
O linfoma anaplásico de grandes células, mais comum em pessoas jovens, geralmente começa nos linfonodos e pode se espalhar para a pele. Porém, também pode começar na pele. Uma combinação de radioterapia e quimioterapia tem provado ser uma abordagem efetiva de duas vertentes para tratar este subtipo. Brentuximabe vedotina, (Adcetris(R)), também conhecido como SGN-35, está aprovado pela FDA no tratamento de pacientes com linfoma anaplásico sistêmico de grandes células (LACG) após falha de pelo menos um regime quimioterápico prévio de múltiplos agentes. Brentuximabe vedotina é administrado por injeção. Cerca de 80 por cento dos pacientes com linfoma anaplásico de grandes células apresenta cura. A terapia combinada é mais efetiva se as células tumorais de um paciente apresentarem uma proteína chamada ALK-1.
Linfoma de Burkitt
Este subtipo de células B é considerado como sendo altamente agressivo. Ele geralmente aparece como uma massa de linfoma na área abdominal (estômago). Ele também pode aparecer na medula óssea, no sangue, no sistema nervoso central e em outros órgãos. O linfoma de Burkitt, que tem essa denominação em homenagem ao cirurgião que identificou a doença pela primeira vez em crianças na África, afeta, em grande parte, adultos com mais idade. Na África, a doença geralmente aparece em crianças como uma massa no osso facial, especialmente na mandíbula. Os médicos usam tipicamente a quimioterapia para tratar a doença. Os medicamentos usados incluem a prednisona, a ciclofosfamida (Cytoxan®), a vincristina (Oncovin®), a citarabina (Cytosar-U®, citosina arabinosida, ara-C), a doxorrubicina (Adriamycin® PFS, Adriamycin®) e o metotrexato (Rheumatrex®, Trexall®).
Linfoma do Sistema Nervoso Central
Existem dois tipos deste linfoma raro no sistema nervoso central (SNC): primário e secundário. O Linfoma primário do SNC começa no cérebro ou na coluna vertebral e é um linfoma associado a AIDS, embora possa estar relacionado a outros subtipos de LNH também. O linfoma secundário do SNC começa em outra área do corpo e se dissemina para o cérebro e/ou coluna vertebral. Os pesquisadores estão atualmente estudando tratamentos efetivos para ambos os tipos em estudos clínicos. O tratamento padrão pode incluir a quimioterapia, medicamentos glicocorticoides e/ou a radioterapia. O tratamento em estudos clínicos inclui a imunoterapia e a quimioterapia de alta dose com o transplante de células tronco.
Linfoma Difuso de Grandes células B
O linfoma difuso de grandes células B (LDCBG) é o tipo mais comum do subtipo agressivo do LNH, constituindo 30 por cento de todos os casos de LNH nos Estados Unidos. Ele afeta, em geral, adultos na meia idade e com mais idade. Embora ele se enquadre na categoria agressiva, o LDCBG pode, algumas vezes, começar como um linfoma indolente, como o linfoma de células B pequenas ou um linfoma folicular. O regime quimioterápico R-CHOP tem provado ser bem-sucedido ao curar 50 por cento a 60 por cento dos pacientes com LDCBG e é o cuidado padrão para a doença de estágio avançado.
Linfoma Hepatoesplênico
Este tipo de linfoma de células T é uma doença extremamente rara e agressiva que começa no fígado ou baço e geralmente afeta adultos jovens na faixa dos 20 e 30 anos de idade. O tratamento para pacientes com linfoma hepatoesplênico de células T inclui a quimioterapia baseada em antraciclina e, em alguns casos, o transplante de células tronco.
Linfoma de Células do Manto
Pelo momento em que o linfoma de células do manto é diagnosticado, ele geralmente já se espalhou para os linfonodos e medula óssea e, algumas vezes, no fígado, intestinos e baço. O LNH se desenvolve em um linfócito na área de um linfonodo conhecido como a zona do manto. O linfoma de células do manto é mais comumente diagnosticado em homens com mais de 50 anos de idade. Os médicos geralmente tratam o linfoma de células do manto com medicamentos quimioterápicos e o anticorpo monoclonal rituximabe (Rituxan®).
Linfoma do Tecido Linfoide Associado a Mucosa (MALT) (Transformado)
O linfoma do tecido linfoide associado a mucosa (MALT), que afeta locais fora dos linfonodos, como o trato gastrintestinal, olhos, glândula da tireoide, glândula salivares, pulmões ou pele, e representa cerca de 7,5 por cento dos casos de LNH. Os pacientes com linfoma MALT podem ter um histórico de doença autoimune. Uma maior incidência de linfoma MALT, envolvendo o estômago, é vista em pacientes que foram infectados com a bactéria Helicobacter pylori (H. pylori). As bactérias também têm sido implicadas em outras formas do linfoma MALT. O tratamento geralmente inclui combinações potentes de antibióticos, que erradicam a infecção por H. pylori e causam a regressão do linfoma. Muitos pacientes com H. pylori foram curados do linfoma MALT sem a radioterapia ou a quimioterapia.
O linfoma MALT transformado é um linfoma agressivo e é incomum. Para este pequeno subconjunto de pacientes, o linfoma MALT pode se transformar em linfoma difuso de grandes células B (LDCBG). Esses pacientes mostraram se beneficiar com os tratamentos usados para o LDCBG.
Linfoma de Células T Periférico
O linfoma de células T periférico é um dos linfomas mais difíceis de tratar. Existem diversas formas deste subtipo:
- Linfoma agudo adulto de células T (o mais comum);
- Linfoma extranodal de células T ou de células ‘natural killer’ (células NK);
- Linfoma do tipo nasal, que geralmente afeta as vias aéreas superiores, como o nariz e a nasofaringe, e a pele e o trato digestivo;
- Linfoma de células T associado a enteropatia, que pode afetar pessoas sensíveis ao glúten;
- Linfoma subcutâneo de células T paniculite-símile, que invade as camadas mais profundas da pele, causando a formação de nódulos sob a pele.
O linfoma de células T periférico é geralmente tratado como o linfoma difuso de grandes células B, geralmente com R-CHOP. No entanto, estudos estão em andamento para desenvolver abordagens terapêuticas mais efetivas.
O que é tratamento para PTCL recidivada ou refratária?
Não existe consenso sobre a melhor estratégia terapêutica para o PTCL recidivado/refratário. ‘Recidivado’ significa que, embora o seu tumor fosse inicialmente sensível à quimioterapia e não houvesse encolhimento tumoral inicial, as células do seu câncer não apresentam mais encolhimento com a quimioterapia que você recebeu. Você pode ser refratário ao primeiro tratamento que recebeu ou pode ser refratário após o seu câncer ter recidivado. ‘Recidivado’ e ‘refratário’ significam que as células do seu tumor desenvolveram resistência à quimioterapia que você estava recebendo e ela não é mais efetiva.
Desde 2009, existem dois agentes aprovados para pessoas com PTCL pela Agência Regulatória de Alimentos e Medicamentos dos Estados Unidos. Pralatrexato (Difolta) foi aprovado em setembro de 2009 para o tratamento de pacientes com PTCL recidivado ou refratário. Romidepsina (Istodax) recebeu aprovação acelerada como um tratamento para pessoas com PTCL que receberam pelo menos uma terapia prévia em junho de 2011.
Linfoma Folicular Transformado
O linfoma folicular começa como um subtipo indolente do LNH. No entanto, ele geralmente se transforma em um linfoma agressivo de grandes células B. A quimioterapia de alta dose seguida pelo transplante autólogo de células tronco pode ser um tratamento efetivo para controlar a doença.
Um estudo clínico também pode ser uma boa opção para os pacientes com linfoma folicular, cuja doença se transformou, apesar de diversas abordagens diferentes de tratamento terem sido tentadas. Outras escolhas de tratamento são:
- Quimioterapia com ou sem o anticorpo monoclonal, rituximabe (Rituxan®);
- Um anticorpo monoclonal radioimunoterapêutico, como Zevalin®;
- Radioterapia;
- Cuidado de suporte;
- Combinação de quimioterapia com Rituxan e possivelmente radioterapia para pacientes cujo LF se transformou antes de uma quantidade significativa de tratamento e está em uma única área;
- Infusão autóloga de células tronco (em um estudo clínico).
TRATAMENTO PARA SUBTIPOS INDOLENTES DO LNH
Subtipos indolentes do linfoma não Hodgkin (LNH) progridem lentamente. Eles constituem cerca de 30 por cento de todos os casos de LNH nos Estados Unidos. Os subtipos indolentes incluem:
- Linfoma cutâneo de células T (micose fungoide e síndrome de Sézary);
- Linfoma folicular;
- Linfoma linfoplásico e macroglobulinemia de Waldenstrom;
- Linfoma de zona marginal;
- Linfoma linfocítico de pequenas células (LLPC) e leucemia linfocítica crônica (LLC).
O tratamento para o LNH indolente varia de uma abordagem observar e esperar à terapia agressiva. O controle ou tratamento do LNH indolente é altamente individual. O seu médico considera uma série de fatores, como:
- Sua perspectiva para recuperação;
- O estágio da doença;
- A sua saúde geral.
Se não tiver sintomas e a sua doença não estiver progredindo, o seu médico pode recomendar a abordagem observar e esperar. Você não receberá terapia imediata, mas o seu médico o monitorará de perto para qualquer alteração. Mas ter um LNH indolente não qualifica você automaticamente para o observar e esperar: Alguns tipos de LNH indolente precisam de terapia inicial agressiva.
Medicamentos Usados para o Linfoma Não Hodgkin Indolente
Se precisar de tratamento imediato, você será geralmente submetido à quimioterapia. Os médicos combinam comumente até cinco medicamentos quimioterápicos para tratar o LNH indolente. Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. A combinação de tipos de medicamentos pode aumentar a sua efetividade.
Um regime quimioterápico comum é um grupo de medicamentos conhecido como CVP. (Os nomes das combinações são geralmente abreviações para a primeira letra dos medicamentos usados.) CVP combina os seguintes medicamentos:
- Ciclofosfamida (Cytoxan ®);
- Vincristina (Oncovin ®);
- Prednisona.
Para determinados subtipos, os médicos normalmente adicionam o anticorpo monoclonal, rituximabe (Rituxan®) a esta mistura, combinado ao CVP ou administrado posteriormente, o que pode ajudar na efetividade do tratamento.
Tratando Subtipos Indolentes Específicos
Linfoma Cutâneo de Células T (Micose Fungoide e Síndrome de Sézary)
O linfoma cutâneo de células T geralmente começa em uma célula T na pele. Pode se tornar mais avançado se ele se espalhar para outros órgãos. Dois tipos comuns de linfoma cutâneo de células T são a micose fungoide e a síndrome de Sézary. Este subtipo de LNH pode ser difícil de diagnosticar em suas fases iniciais. O tratamento depende de ele estar ainda presente nos linfonodos e da gravidade das lesões cutâneas. Pode incluir medicamentos quimioterápicos tópicos que você aplica diretamente à pele afetada combinados à fototerapia com ultravioleta e à terapia com feixes de elétrons. O medicamento comumente usado com a fototerapia com ultravioleta é psoraleno. Esta combinação de tratamento é abreviada e referida como PUVA. Se a doença estiver disseminada, o seu médico pode usar a quimioterapia com um ou mais medicamentos ou a fotoférese extracorpórea, um método que retira o sangue do seu corpo e o trata com luz ultravioleta antes de ser devolvido ao seu corpo.
Linfoma Folicular
O linfoma folicular (LF) é o segundo subtipo mais comum de linfoma não Hodgkin (LNH), constituindo cerca de 20 por cento de todos os casos de LNH. O linfoma começa nas células em que ocorre uma translocação entre os cromossomos 14 e 18. Isto causa a produção excessiva (superexpressão) do gene BCL-2, que pode tornar as células resistentes à terapia. No entanto, o tratamento pode manter a doença indolente controlada por vários anos.
O LF tem um alto risco de se transformar em uma doença agressiva. O LF pode ser tratado com:
- Radioterapia;
- Quimioterapia seguida por radioterapia;
- Uma abordagem de observar e esperar;
- Um anticorpo monoclonal radioativo;
- Transplante de células tronco.
A participação em um estudo clínico também pode ser uma boa opção de tratamento.
Os médicos desenvolveram um sistema de pontuação chamado Índice de Prognóstico Internacional para Linfoma Folicular que pode ajudá-los a predizer quais pacientes têm um maior risco de a doença voltar (recorrência). Os médicos elaboram um plano de tratamento em torno da pontuação dos pacientes. Os fatores que aumentam o risco para pacientes com LF incluem:
- Idade acima de 60 anos;
- Doença de estágio III ou IV;
- Mais de quatro linfonodos envolvidos;
- Um nível elevado de lactato desidrogenase (um tipo de proteína) no sangue;
- Uma baixa concentração de hemoglobina (menos de 12 gramas por decilitro) no sangue;
- Opções de tratamento para o LF transformado estão descritas no Tratamento para Subtipos Agressivos do LNH.
Linfoma Linfoplasmacítico e Macroglobulinemia de Waldenström
O linfoma linfoplasmacítico e macroglobulinemia de Waldenström são dois subtipos de LNH proximamente relacionados que começam em uma célula B. Ambos podem se tornar mais avançados se o linfoma se espalhar para outros órgãos, como os pulmões e o trato digestivo. O seu médico pode sugerir uma abordagem observar e esperar se a doença estiver em seus estágios iniciais. Do contrário, você pode ser tratado com regimes terapêuticos que incluem uma combinação de agentes biológicos (tratamento que estimula o sistema imunológico a combater o câncer), inibidores de sinalização (medicamentos que bloqueiam os sinais de pró-crescimento e sobrevida), e a quimioterapia. Recentemente, o ibrutinibe (Imbruvica®) passou a ser o primeiro medicamento aprovado para o tratamento de pacientes sintomáticos com MW.
Uma complicação séria das duas doenças é chamada síndrome da hiperviscosidade, em que há o espessamento do sangue. Isto leva a um fluxo sanguíneo inadequado, causando sintomas como cefaleia, visão turva e confusão mental. Para tratar a síndrome, o seu médico pode fazer com que você passe por uma plasmaférese, um método que retira do seu sangue o excesso de anticorpos que causam a condição. Isto é seguido por tratamento para controlar o linfoma.
Linfoma de Zona Marginal
O linfoma de zona marginal pode se desenvolver nos linfonodos (nodal) ou em outro local do corpo (extranodal), porém geralmente não se espalha. O linfoma nodal de zona marginal de células B (também chamado linfoma monocitoide de células B) é uma forma rara da doença que é encontrada no baço e no sangue.
O linfoma do tecido linfoide associado a mucosa (MALT) é um tipo mais comum que se desenvolve fora dos linfonodos, incluindo o trato digestivo (gastrintestinal), olhos, glândula da tireoide, glândulas salivares, pulmões e pele. MALT tem sido associado a um histórico de doença autoimune e infecção bacteriana, incluindo Helicobacter pylori (H. pylori). Os médicos tratam MALT com combinações potentes de antibióticos, resultando em curas para alguns pacientes sem ter que passar pela radioterapia ou quimioterapia.
Linfoma Linfocítica de Pequenas Células e Leucemia Linfocítica Crônica
O linfoma linfocítico de pequenas células (LLPC) e a leucemia linfocítica crônica (LLC) são subtipos semelhantes de LNH. Eles tendem a afetar as mesmas faixas etárias (a idade mediana dos pacientes é de 65 anos), têm sinais e sintomas comuns e são de crescimento lento. As diferenças estão em onde eles se desenvolvem: LLPC geralmente afeta os linfonodos e o tecido linfoide; o LLC geralmente afeta o sangue e a medula óssea, mas pode se espalhar para os linfonodos. O tratamento para ambos é o mesmo: quimioterapia com o medicamento, bendamustina (Treanda®), que é usado para tratar o LLC. Ele provou ser efetivo em pacientes com LLPC em estudos clínicos após o tratamento com rituximabe (Rituxan®) isoladamente ou com outros medicamentos.
EFEITOS COLATERAIS
A terapia para câncer no linfoma não Hodgkin (LNH) pode, algumas vezes, produzir efeitos colaterais. Para a maioria dos pacientes, os efeitos colaterais do tratamento são temporários e desaparecem assim que a terapia termina. Para outros pacientes, os efeitos colaterais podem ser mais graves, algumas vezes, necessitando de hospitalização. Alguns pacientes nunca têm efeitos colaterais. Antes de receber o tratamento, converse com o seu médico sobre os possíveis efeitos colaterais. Medicamentos e outras terapias podem prevenir ou controlar muitos efeitos colaterais. Converse também com o seu médico sobre efeitos de longo prazo e tardios do tratamento. Alguns tratamentos para LNH têm um alto risco de infertilidade.
Efeitos Colaterais Comuns
Os medicamentos quimioterápicos são os principais responsáveis quando se trata de causar efeitos colaterais indesejados. Esses medicamentos matam as células cancerosas, mas também danificam células normais. O revestimento da boca, garganta, estômago e intestinos são particularmente vulneráveis ao dano.
Os efeitos colaterais que você pode apresentar dependem de:
- A intensidade da quimioterapia;
- Os medicamentos usados durante a terapia;
- A localização da radioterapia;
- A sua idade;
- A saúde geral e se você tem alguma condição de saúde crônica, como diabetes ou doença renal.
Os efeitos colaterais a seguir são comuns à quimioterapia, radioterapia e ao transplante de células tronco.
- Infecções;
- Contagens baixas de células sanguíneas;
- Feridas na boca;
- Náusea e vômito;
- Diarreia;
- Constipação;
- Irritação da bexiga urinária;
- Sangue na urina;
- Fadiga extrema;
- Anemia;
- Febre;
- Tosse;
- Erupções cutâneas;
- Queda de cabelo;
- Fraqueza;
- Sensações de formigamento;
- Problemas no pulmão, coração, rins ou no nervo;
- Infertilidade;
- Doença do enxerto versus hospedeiro (se você passou por um transplante alogênico de células tronco).
REFRATÁRIO E RECIDIVADO
Alguns pacientes ainda têm células do linfoma em sua medula óssea após o tratamento para LNH. Isto é chamado ‘linfoma não Hodgkin refratário’. Alguns pacientes têm um retorno das células do linfoma na medula e um decréscimo nas células sanguíneas normais após a remissão. Isto é chamado ‘recidiva’.
Medicamentos Usados para o LNH Refratário e Recidivado
A maioria dos pacientes com LNH refratário ou recidivado recebe a terapia de segunda linha – tratamento diferente do tipo usado da primeira vez. Os regimes farmacológicos comuns de segunda linha, algumas vezes, seguidos pelo transplante de células tronco, incluem:
- ICE: ifosfamida (Ifex®), carboplatina (Paraplatin®), etoposida (Etopophos®, Toposar®, VePesid®, VP-16);
- RICE: rituximabe (Rituxan®), Ifex, carboplatina (Paraplatin®), etoposida;
- DHAP: dexametasona (Decadron®), citarabina (Cytosar-U®, citosina arabinosida, ara-C), cisplatina (Platinol®-AQ);
- ESHAP: etoposida, metilprednisolona (Medrol®), citarabina de alta dose, Platinol-AQ;
- R-ESHAP: Rituxan, etoposida, Medrol, citarabina de alta dose, Platinol-AQ.
Linfoma Não Hodgkin Refratário
O termo ‘linfoma não Hodgkin refratário’ é usado para descrever uma doença que não entra em remissão (mas pode estar estável) ou que piora nos seis meses desde o último tratamento.
Linfoma Não Hodgkin Recidivado
Se o seu linfoma voltar após uma remissão (sem sinal da doença) de seis meses ou mais, você apresentou uma recaída (recidiva). Você pode apresentar uma recaída (recidiva) meses ou anos após o tratamento. Se você tiver uma recaída muito tempo após o tratamento, você pode passar por tratamento semelhante ao que recebeu quando recebeu o diagnóstico. Os pacientes com LNH refratário normalmente são submetidos a quimioterapia de alta dose com transplante de células tronco.
Para pacientes com linfoma folicular de estágio avançado, o tratamento depende dos sintomas e da extensão de disseminação da doença. Para pacientes que já foram tratados com quimioterapia usando o regime CHOP, um transplante autólogo de células tronco pode ser uma opção.
LINFOMA NÃO HODGKIN INFANTIL
Tratamento
O diagnóstico de câncer de uma criança pode trazer consigo sentimentos de incerteza para os pais e outros familiares. De repente, você é empurrado para um mundo de mudanças rápidas, com preocupações, medos e incertezas. Você terá que tomar decisões de tratamento enquanto estiver confortando o seu filho – e ao mesmo tempo tentará enfrentar as suas próprias emoções.
O tratamento do seu filho depende de determinados fatores:
- O estágio da doença;
- O subtipo da doença;
- Se a doença é agressiva (crescimento rápido) ou indolente (crescimento lento);
- Se o linfoma está em áreas do corpo diferentes dos linfonodos (envolvimento extranodal);
- Possíveis fatores de risco que podem ser encontrados durante os exames laboratoriais.
O oncologista (especialista em câncer) do seu filho deve desenvolver um plano de tratamento que limita a quantidade de terapia necessária para atingir a remissão. Certifique-se de perguntar o oncologista sobre possíveis efeitos colaterais e efeitos de longo prazo ao considerar as opções de tratamento. Alguns efeitos de longo prazo, como infertilidade, podem ser sérios. Baixe ou peça a ficha técnica gratuita da Sociedade de Leucemia e Linfoma Fatos sobre Fertilidade.
Crianças com LNH podem, algumas vezes, ser tratadas de maneira diferente dos adultos. Escolher a terapia mais efetiva para adolescentes e adultos jovens (idade entre 15 e 29 anos) pode ser um desafio e é um tópico de pesquisa em andamento. De fato, o tratamento usado em adultos para determinados subtipos de LNH, incluindo o linfoma de Burkitt e o linfoma linfoblástico, já é, na realidade, uma terapia pediátrica.
Estudos Clínicos
Um estudo clínico pode ser uma opção quando se trata de encontrar o tratamento certo para o câncer do seu filho. Estudos clínicos para crianças, adolescentes e adultos jovens com câncer são geralmente projetados para comparar potencialmente a terapia mais efetiva com a terapia que é atualmente aceita como padrão. O seu filho terá acesso a terapias novas ou melhoradas em estudo e ainda não disponíveis no mercado. Discuta com o médico do seu filho sobre a possibilidade de participar de um estudo clínico, onde o tratamento é administrado em um ambiente seguro e criteriosamente monitorado.
Sobrevivência e Necessidades de Cuidado à Saúde Especiais
Após o tratamento, a maioria das crianças pode esperar ter vidas plenas e produtivas. Muitos sobreviventes voltam à escola, vão à faculdade, entram para a força de trabalho, casam-se e têm filhos. Você pode considerar um programa de sobrevivência para o seu filho que foca na vida após o câncer. A maioria dos principais hospitais em todo o mundo oferece esses programas.
Cuidado de Acompanhamento
O seu filho deve visitar o pediatra ou médico pelo menos uma vez por ano para um exame físico completo e testes adicionais necessários. O seu oncologista também deve examinar regularmente o seu filho.
As visitas regulares ao médico são encorajadas para:
- Permitir que os médicos avaliem o efeito completo da terapia;
- Detectar e tratar a recorrência da doença;
- dentificar e controlar efeitos de longo prazo e tardios do tratamento.
O seu pediatra deve recomendar um cronograma para avaliar as habilidades de aprendizado do seu filho. Se parecer que o seu filho está apresentando dificuldades de aprendizado, métodos de educação especial podem ajudar. É importante a coordenação entre o pediatra e o oncologista do seu filho para o melhor cuidado possível. Alguns centros de tratamento oferecem clínicas de cuidado abrangente de acompanhamento para crianças sobreviventes do câncer.
Efeitos de Longo Prazo e Tardios do Tratamento
Alguns efeitos colaterais do tratamento para câncer, como fadiga, podem durar meses ou anos após a terapia. Algumas condições médicas, como doença cardíaca e outros cânceres podem não aparecer até anos após o final do tratamento. Os efeitos de longo prazo e tardios podem impactar a saúde física mental e cognitiva (função cerebral) do seu filho.
A maioria dos sobreviventes do linfoma infantil não desenvolve efeitos significativos de longo prazo ou tardios do tratamento. No entanto, para alguns pacientes, os efeitos podem variar de leves a graves.
Efeitos de Longo Prazo e Tardios da Quimioterapia
As crianças tratadas para linfoma podem estar em risco aumentado para:
- Fadiga;
- Atraso no crescimento;
- Disfunção da tireoide;
- Perda na audição;
- Um câncer secundário.
Alguns efeitos de longo prazo e tardios se tornam visíveis com a maturação (puberdade), crescimento e o processo normal de envelhecimento. A intervenção precoce e práticas de estilo de vida saudável (não fumar, dieta equilibrada, prática de exercícios, check-ups e acompanhamento regulares) ajudam.
Efeitos de Longo Prazo e Tardios da Radioterapia
As meninas (e também mulheres com menos de 30 anos de idade) que recebem radiação na área das mamas estão em risco para desenvolver câncer de mama 15 a 20 anos após o tratamento. Os meninos sobreviventes do câncer infantil estão em risco de desenvolver um segundo câncer, mas não têm um risco tão alto para desenvolver câncer de mama que as meninas sobreviventes do câncer infantil.
As meninas que receberam radioterapia na área do tórax (mediastinal) devem:
- Realizar autoexames mensais da mama;
- Fazer uma mamografia basal com 25 a 30 anos de idade ou 10 anos após a radioterapia;
- Fazer um exame clínico anual da mama;
- Fazer uma mamografia a cada dois a três anos, dependendo da densidade do tecido mamário.
As meninas e meninos que tiverem recebido radioterapia mediastinal devem fazer o teste basal para a função cardíaca. Isto deve ser seguido pelo teste a cada três a cinco anos após o tratamento ou com mais regularidade se forem encontradas anormalidades.
Volta à Escola
Dificuldades no aprendizado podem começar durante o tratamento ou aparecer meses ou anos depois. Educar os familiares, amigos, professores e profissionais de saúde sobre os possíveis efeitos de longo prazo e tardios do tratamento do seu filho. Conversar com os professores e profissionais de saúde do seu filho para desenvolver um programa personalizado às suas necessidades que apresente teste basal, acomodações especiais e planejamento no longo prazo.
O seu médico determinará a extensão de progressão da sua doença pelo estadiamento. O estadiamento ajuda o seu médico a calcular a progressão da doença e a desenvolver um plano de tratamento.
O LNH nem sempre começa no estágio I e se espalha para estágios mais avançados. Mais da metade de todos os pacientes com doença intermediária ou agressiva e mais de 80 por cento de todos os pacientes com doença indolente são diagnosticados com LNH de estágio III ou IV. E, se alguém for diagnosticado no estágio IV, não significa que a doença é incurável – ela pode ser altamente curável dependendo do subtipo.
Estágio I
Envolvimento de um grupo de linfonodos
Estágio II
Envolvimento de dois ou mais grupos de linfonodos do mesmo lado do diafragma (um músculo fino abaixo dos pulmões)
Estágio III
Envolvimento de grupos de linfonodos em ambos os lados do diafragma
Estágio IV
Envolvimento de um ou mais órgãos, diferente dos linfonodos, e possível envolvimento dos linfonodos
Categorias A, B, X e E
Os quatro estágios do LNH podem ser divididos em categorias:
- Categoria A: Sem febre, sem sudorese exagerada ou sem perda de peso presentes;
- Categoria B: Febre, sudorese excessiva e perda de peso presentes;
- Categoria X: Doença volumosa (massas grandes de linfócitos) presente;
- Categoria E: O linfoma se espalhou para áreas ou órgão foram dos linfonodos, ou para tecidos além, mas próximos, das principais áreas linfáticas.
Por exemplo, o estágio IIB indica que o paciente tem:
- Dois locais de linfonodos próximos um do outro com envolvimento da doença (por exemplo, linfonodos aumentados no pescoço e próximos à clavícula, ou no pescoço e axila);
- Febre, sudorese excessiva e perda de peso.
O seu tratamento depende do seu estágio e categoria. Os pacientes que se enquadram na categoria B geralmente precisam de tratamento mais agressivo do que os pacientes na categoria A.
- O que é?
-
Linfoma é um tipo de câncer que se inicia nas células que fazem parte do sistema imunológico do nosso corpo – o Sistema linfático. O linfoma é um câncer do sangue e é a patologia que tem maiores chances de CURA. É importante saber qual o tipo de linfoma você tem, pois cada tipo tem uma forma de tratamento e prognóstico. Existem dois tipos principais de linfoma: o LINFOMA HODGKIN (LH) e o LINFOMA NÃO-HODGKIN (LNH). Pergunte ao médico o seu tipo de linfoma e fique atento ao tratamento ideal!
O que é?
- É um tipo de câncer que afeta o sistema linfático;
- Geralmente se desenvolve nos linfonodos e nos tecidos linfáticos. Em alguns casos, o LNH envolve a medula óssea e o sangue;
- Não é apenas uma doença – é, na realidade, um grupo diverso de cânceres do sangue que compartilham uma única característica em como eles se desenvolvem;
- O LNH possui muitos subtipos diferentes que são indolentes (de crescimento lento) ou agressivo (crescimento rápido).
O Que Você Deve Saber:
- Os hematologistas e oncologistas são especialistas que tratam pessoas que têm LNH ou outros tipos de câncer do sangue;
- O tratamento de pessoas que têm o LNH pode incluir a terapia farmacológica e a radioterapia;
- É importante saber o seu subtipo de LNH;
- Procure tratamento em um centro de câncer em que os médicos são experientes no tratamento de pacientes com linfoma;
- Converse com o seu médico sobre seus testes diagnósticos e o significado dos resultados;
- Assegure que você saiba o seu subtipo de LNH – subtipos diferentes têm tratamentos diferentes.
Como o LNH se Desenvolve?
O LNH geralmente começa com uma alteração anormal em uma célula branca em um linfonodo ou tecido linfoide chamado linfócito. Pode começar em um de três tipos principais de linfócitos:
- Linfócitos B (células B), que produzem anticorpos para ajudar a combater infecções;
- Linfócitos T (células T), que têm diversas funções, incluindo auxiliar os linfócitos B a produzir anticorpos;
- Células ‘natural killer’ (NK), que atacam as células infectadas com vírus ou células tumorais
Cerca de 85% dos casos de LNH começam nas células B. O seu médico planeja o seu tratamento de acordo com o tipo de célula em que o seu LNH se desenvolveu.
O linfócito anormal cresce fora de controle e produz mais células anormais como ele.
- Esses linfócitos anormais (células do linfoma) se acumulam e formam massas (tumores). Se o LNH não for tratado, as células cancerosas se acumulam para fora das células brancas normais, e o sistema imunológico não pode deter a infecção de modo efetivo;
- O LNH que se desenvolve ou se dissemina para outras áreas do corpo em que o tecido linfoide é encontrado, como o baço, o trato digestivo e a medula óssea é chamado linfoma extranodal primário;
- O LNH é classificado em mais de 30 subtipos diferentes. Os médicos classificam os subtipos de LNH em categorias que descrevem com que rapidez ou lentidão a doença está progredindo:
- LNH agressivo;
- LNH indolente (crescimento lento).
SUBTIPOS DO LNH
O linfoma não Hodgkin (LNH) possui cerca de 60 subtipos classificados pela Organização Mundial de Saúde (OMS). É importante saber o seu subtipo, já que ele representa uma parte importante na determinação do tipo de tratamento que você receberá. Você deve considerar obter uma segunda opinião de um hematopatologista sobre seu diagnóstico.
Os subtipos de LNH são classificados por determinados fatores, como o tipo de linfócito em que eles se desenvolvem. Os dois principais subtipos são:
- linfoma de células B;
- linfoma de células T e de células ‘natural killer’ (NK).
A maioria das pessoas (85 por cento) tem o tipo de linfoma de células B. Uma pequena porcentagem de pessoas tem um tipo de LNH que se enquadra em um terceiro grupo: transtornos linfoproliferativos associados à imunodeficiência.
Alguns dos nomes de subtipos se relacionam às áreas dos linfonodos (“folículo,” “manto” e zonas “marginais”) que eles parecem se originar.
Estão listados abaixo alguns subtipos de linfomas de células B e células T e NK. O subtipo mais comum é o linfoma difuso de grandes células B (DLBCL), que constitui cerca de 30 por cento de todos os casos de LNH nos Estados Unidos.
Subtipos de Linfoma de Células B
- Linfoma de Burkitt – leucemia de Burkitt;
- Linfoma do sistema nervoso central (SNC);
- Linfoma difuso de grandes células B;
- Linfoma extranodal da zona marginal de células B;
- Linfoma folicular;
- Linfoma intravascular de grandes células B;
- Granulomatose linfomatoide;
- Linfoma linfoplasmacítico – macroglobulinemia de Waldenstrom;
- Linfoma de células do manto. (Vide ficha técnica gratuita da LLS, Fatos sobre o Linfoma de Células do Manto, para mais informações);
- Linfoma mediastinal (tímico) de grandes células B;
- Linfoma do tecido linfático associado a mucosa (MALT);
- Linfoma nodal da zona marginal de células B;
- Linfoma primário de cavidade pleural;
- Linfoma linfocítico de pequenas células –leucemia linfocítica crônica;
- Linfoma esplênico de zona marginal.
Subtipos de Linfoma de Células T e de Células ‘Natural Killer’
- Linfoma anaplásico de grandes células;
- Linfoma angioimunoblástico de células T;
- Linfoma cutâneo de células T (síndrome de Sézary e micose fungoide);
- Linfoma hepatoesplênico;
- Linfoma de células NK;
- Linfoma de células T periféricas, não especificado de outro modo.
Formas do LNH
Os médicos classificam os subtipos de LNH em categorias que descrevem com que rapidez ou lentidão a doença está progredindo:
- LNH Agressivo, também chamado de crescimento rápido ou de alto grau, constitui cerca de 60 por cento dos casos de LNH nos Estados Unidos. O subtipo agressivo mais comun é o linfoma difuso de grandes células B.
- LNH Indolente, também chamado de crescimento lento ou de baixo grau, constitui cerca de 40 por cento dos casos de LNH nos Estados Unidos. O subtipo indolente mais comun é o linfoma folicular.
Alguns pacientes têm a doença de “grau intermediário”, que se desenvolve a uma velocidade entre a forma indolente e agressiva. E algumas vezes, o LNH indolente pode “se transformar” para o LNH agressivo.
- Fatores de Risco
-
Os médicos não sabem por que algumas células se tornam linfoma não Hodgkin (LNH) e outras não. Para a maioria das pessoas que têm LNH, não existe motivos óbvios pelos quais elas desenvolveram a doença. Os pesquisadores identificaram determinados fatores de risco em potencial que podem aumentar as chances de desenvolver o LNH. Eles descobriram que pessoas que vivem e trabalham em comunidades agrícolas tendem a ter uma incidência maior de LNH. Estudos sugerem que pode haver uma ligação com alguns ingredientes encontrados em herbicidas e pesticidas. Os pesquisadores também acreditam que o LNH pode estar associado a exposição a determinadas bactérias e vírus, especialmente aquelas que suprimem o sistema imunológico, como:
- Vírus da imunodeficiência humana /síndrome da imunodeficiência adquirida (HIV/AIDS);
- Vírus Epstein-Barr;
- Vírus linfocitotrópico T humano (HTLV);
- Helicobacter pylori (a bactéria que causa as úlceras de estômago);
Você não pode pegar o LNH de alguém. Os especialistas descobriram que cerca de uma dúzia de síndromes herdadas – porém raras – podem aumentar o risco do LNH.
- Sintomas
-
O sinal inicial mais comum de linfoma não Hodgkin (LNH) é o inchaço (aumento) indolor de um ou mais linfonodos no pescoço, axila ou virilha. A maioria das pessoas tem linfonodos afetados na parte superior do corpo, geralmente no pescoço ou do tórax superior. Algumas vezes, você pode sentir o linfonodo afetado na sua axila ou virilha.
Além dos linfonodos inchados, outros sinais e sintomas do LNH incluem:
- Febre sem uma causa óbvia;
- Sudorese excessiva especialmente à noite;
- Cansaço ou sem energia;
- Perda de apetite;
- Perda inexplicada de peso;
Se o LNH iniciar em uma área diferente dos linfonodos, como no osso, no pulmão, no trato digestivo (gastrintestinal) ou na pele, os sintomas podem incluir:
- Erupções cutâneas;
- Dor óssea;
- Tosse;
- Dor torácica;
- Dor abdominal (área do estômago);
- Caroços sob a pele.
Alguns sintomas do LNH estão associados a outras doenças menos sérias. Por exemplo, linfonodos aumentados podem resultar da inflamação e não são necessariamente um sinal de câncer. No entanto, se estiver incomodado com algum dos sintomas acima, procure o seu médico. Algumas vezes, você pode não apresentar sintomas. Neste caso, o seu médico pode ser o primeiro a notar os sinais, como linfonodos aumentados, durante um exame físico de rotina.
- Diagnóstico
-
Biópsia do Linfonodo
O diagnóstico do linfoma não Hodgkin (LNH) geralmente envolve a realização de uma biópsia do linfonodo. Se a biópsia confirmar que você tem a doença, o seu médico realiza testes adicionais para estadiar o linfoma.
A finalidade de uma biópsia de linfonodo é confirmar o diagnóstico e:
- Identificar o subtipo do seu LNH;
- Desenvolver um plano de tratamento.
Exames Laboratoriais para Confirmar um Diagnóstico:
Após o seu médico coletar amostras do seu linfonodo e tecidos, um hematopatologista as examina sob um microscópio para procurar identificar características do LNH. Ele ou ela confirma um diagnóstico e identifica o subtipo do LNH. Um hematopatologista é um especialista que estuda doenças das células sanguíneas pela análise das amostras das células do sangue e da medula óssea e de outros tecidos.
O hematopatologista usa um ou mais exames laboratoriais, como os descritos a seguir para examinar as suas células:
- Imunofenotipagem confirma um diagnóstico do LNH e identifica as células do linfoma como células B, células T ou células ‘natural killer’;
- Análise citogenética procura por alterações nos cromossomos. As anormalidades ajudam a identificar o subtipo do LNH;
- Perfil de expressão gênica e análise por microarranjo identificam o subtipo e fatores de risco. Eles ajudam a prever a resposta ao tratamento e identificar os pacientes que podem estar em risco aumentado para recidiva;
- Reação em cadeia da polimerase (PCR) analisa determinados genes para ajudar a prever a resposta ao tratamento. Este teste é também usado para detectar células de linfoma residuais que são muito pequenas para serem vistas sob um microscópio.
Como o LNH é uma doença difícil de diagnosticar, você pode querer obter uma segunda opinião médica de um hematopatologista experiente antes de iniciar o tratamento. Alguns tipos de LNH podem ser confundidos entre eles. O tratamento apropriado depende de ter o diagnóstico correto.
TESTES DE ESTADIAMENTO
Assim que o seu médico confirmar o diagnóstico de LNH, ele ou ela faz mais testes para estadiar a sua doença. O estadiamento identifica a extensão da sua doença e onde ela está localizada no seu corpo.
Os testes de estadiamento incluem:
- Um exame físico;
- Exames de imagem;
- Exames de sangue;
- Exames da medula óssea.
Exames de Imagem
O seu médico conduz um ou mais exames de imagem (também chamado radiologia diagnóstica), juntamente com um exame físico, para verificar:
- A localização e distribuição dos linfonodos aumentados;
- Os efeitos da doença, se houver, em outros órgãos, como os pulmões ou fígado;
- Massas tumorais grandes.
Os exames de imagem podem incluir:
- Uma radiografia (raio-X);
- Uma varredura de tomografia computadorizada (TC) do pescoço, tórax, pelve e abdômen (área do estômago);
- Uma varredura de imagem por ressonância magnética (IRM);
- Uma varredura de tomografia de emissão de pósitrons (PET);
- Uma varredura de PET com fluorodesoxiglicose (FDG-PET) de todo o corpo com um marcador radioativo (F-18).
Exames de Sangue
Após a coleta do seu sangue, ele é enviado a um laboratório para um hemograma completo (CBC) e exames adicionais. O seu sangue é dosado para:
- Níveis de células vermelhas (eritrócitos), células brancas (leucócitos) e plaquetas;
- A presença de células do linfoma;
- Anormalidades ou deficiências de imunoglobulinas causadas pelos linfócitos;
- Níveis séricos de proteína;
- Níveis de ácido úrico;
- Velocidade de hemossedimentação (a velocidade para as células vermelhas se depositarem no fundo de um tubo de ensaio – uma velocidade aumentada pode indicar câncer);
- Função hepática e renal;
- Evidência de hepatite A ou B;
- Dois marcadores biológicos, lactato desidrogenase (LDH) e beta 2-microglobulina.
Exames da Medula Óssea
O seu médico pode decidir examinar a sua medula óssea para ver se a doença se espalhou. Se a sua doença estiver em um estágio inicial e alguns sinais e sintomas não tiverem aparecido, você pode não precisar fazer o teste. O exame da medula óssea envolve duas etapas geralmente feitas ao mesmo tempo em um consultório médico ou no hospital:
- Uma aspiração da medula óssea para coletar uma amostra líquida da medula;
- Uma biópsia de medula óssea para retirar uma pequena quantidade de osso preenchido com medula.
O seu médico também pode coletar amostras de medula óssea durante o tratamento para determinar a efetividade da sua terapia.
Outros Exames para Subtipos Específicos
Determinados exames são realizados somente para subtipos específicos e não necessariamente para todos os pacientes com LNH. Eles incluem:
- Endoscopias alta e baixa para pacientes cuja doença envolve o trato digestivo (gastrintestinal);
- Colonoscopia para pacientes que têm linfoma de células do manto;
- Uma punção lombar para pacientes cujo sistema nervoso central pode ser afetado pelo LNH;
- Imagem do cérebro ou da coluna vertebral para pacientes cujo sistema nervoso ventral pode ser afetado pelo LNH.
- Tratamento
-
É importante que o seu médico seja experiente no tratamento de pacientes com linfoma não Hodgkin (LNH) ou trabalhe em consulta com um especialista em LNH. Este tipo de especialista é geralmente chamado de oncologista hematologista.
Tipos de Tratamento
Os médicos usam diversos tipos de abordagens e combinações de tratamento para o LNH, alguns em estágios diferentes:
- Quimioterapia e outra terapia farmacológica;
- Radioterapia, geralmente combinada com a quimioterapia;
- Transplante de células tronco;
- Observar e esperar;
- O seu médico pode sugerir que você participe de um estudo clínico. Estudos clínicos podem envolver a terapia com novos medicamentos e novas combinações de medicamentos ou novas abordagens para o transplante de células tronco.
Também pode haver grandes diferenças entre o tratamento para o LNH agressivo e o tratamento para o LNH indolente. Leia sobre cada um em:
- Tratamento para o LNH agressivo;
- Tratamento para LNH indolente.
Considerações de Pré-Tratamento
Adultos em idade fértil e pais de crianças diagnosticados com LH devem pedir aos seus médicos informações sobre como reduzir o risco de infertilidade. Vide a publicação gratuita da LLS Fatos sobre Fertilidade para mais detalhes.
Encontrando a Melhor Abordagem de Tratamento
O objetivo do tratamento para LNH é destruir o maior número de células do linfoma possível para induzir a remissão completa (sem traço da doença). Os pacientes que entram em remissão são, algumas vezes, curados da doença.
O tratamento pode manter o LNH controlado por muitos anos, mesmo se os testes mostrarem algumas células do linfoma remanescentes. Isto é chamado remissão parcial.
O tratamento que o seu médico recomendar é baseado em diversos fatores, incluindo:
- O subtipo da sua doença;
- Se a sua doença é agressiva (crescimento rápido) ou indolente (crescimento lento);
- O estágio e categoria da sua doença;
- Se o linfoma está em áreas do corpo, diferente dos seus linfonodos (envolvimento extranodal);
- A sua saúde geral e se você tem alguma condição, como doença cardíaca, doença renal, doença pulmonar, diabetes ou anemia.
Enquanto você desenvolve um plano de tratamento com o seu médico, certifique-se de discutir:
- Os resultados que você pode esperar com o tratamento;
- Possíveis efeitos colaterais, incluindo efeitos de longo prazo e tardios;
- A possibilidade de participar de um estudo clínico, onde você terá acesso a tratamento médico avançado que pode ser mais benéfico a você do que o tratamento padrão.
Você pode achar útil levar alguém próximo a você às suas visitas com o seu médico para apoio, para tomar notas e fazer perguntas de acompanhamento. Uma sugestão é preparar as perguntas que gostaria de fazer quando visitar o seu médico. Você também pode registrar as suas conversas com o seu médico e ouvir com mais atenção ao chegar em casa.
Outras Considerações de Tratamento
Se você estiver em idade fértil, converse com o seu médico sobre os possíveis efeitos de longo prazo do tratamento na fertilidade;
Se o seu filho estiver sendo tratado para LNH, a terapia pode diferir daquela do adulto normal. Você também precisa pensar sobre os efeitos de longo prazo do tratamento, incluindo os efeitos na fertilidade;
Se tiver 60 anos ou mais de idade, o seu tratamento pode variar das abordagens padrão. Por exemplo, o seu corpo pode não ser capaz de tolerar os medicamentos quimioterápicos tóxicos ou você pode ter outras enfermidades que são mais comuns à medida que envelhecemos. Esses fatores, entre outros, podem tornar mais complicada a escolha de um tratamento. No entanto, a idade mais avançada não é um fator determinante no tratamento para a maioria dos pacientes.
Para muitas pessoas com linfoma não Hodgkin (LNH), iniciar o tratamento os auxilia a focar em seguir adiante e buscar pela remissão de sua doença.
QUIMIOTERAPIA E TERAPIA FARMACOLÓGICA
Durante a quimioterapia, você recebe medicamentos potentes que devem ser tóxicos o suficiente para danificar ou matar as células leucêmicas. Ao mesmo tempo, eles têm como alvo as células normais e causam efeitos colaterais. Porém, nem todos apresentam efeitos colaterais da mesma maneira.
Os médicos combinam comumente quatro ou mais medicamentos quimioterápicos para tratar o linfoma não Hodgkin (LNH). Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. Combinar tipos de medicamento pode aumentar a sua efetividade. Você pode receber os medicamentos em pílulas para engolir, por injeção ou através de um cateter (um tubo fino, flexível ou linha intravenosa) colocado cirurgicamente em uma veia, normalmente no seu tórax superior.
A quimioterapia é administrada em ciclos, geralmente com várias semanas de intervalo, em um contexto ambulatorial. Você precisará de uma série de ciclos durante seis a 10 meses. Você pode precisar permanecer no hospital por um período curto durante o tratamento se a sua terapia for particularmente intensiva ou se ela levar à infecção ou a decréscimos prolongados ou graves nos hemogramas.
CHOP
Um regime de medicamentos quimioterápicos comum para o LNH é chamado CHOP. Os nomes das combinações são geralmente abreviações para a primeira letra dos medicamentos usados. Os medicamentos em CHOP são:
- Ciclofosfamida (Cytoxan®);
- Doxorrubicina (hidroxidoxorrubicina);
- Vincristina (Oncovin®);
- Prednisona.
Os médicos podem adicionar o anticorpo monoclonal, rituximabe (Rituxan®), a esta mistura, que pode ajudar na efetividade do tratamento ao direcionar moléculas específicas para as células cancerosas. Denominado R-CHOP, esta é a combinação mais comumente usada de quimioterapia e anticorpo monoclonal para o LNH agressivo. Ela pode ser muito efetiva e, algumas vezes, cura o LNH.
Outras Terapias Farmacológicas
Os médicos usam um vasto arranjo de medicamentos para tratar os subtipos diferentes do LNH, atacando-os de muitos ângulos diferentes:
- Medicamentos que danificam o DNA interrompem o crescimento de células cancerosas ao modificar quimicamente o DNA que está ajudando o LNH a se desenvolver;
- Anticorpos antitumorais interagem com o DNA para interferir com a sobrevida de células cancerosas;
- Antimetabólitos são substâncias químicas que bloqueiam a capacidade das células de formar o DNA ou RNA, o que previne o crescimento celular;
- Medicamentos inibidores do proteassoma limitam os efeitos de uma estrutura celular chamada proteassoma, o que torna mais difícil para as células cancerosas sobreviverem;
- Inibidores da enzima de reparo do DNA atacam determinadas enzimas (proteínas) em células que tornam o DNA mais suscetível a dano;
- Medicamentos quimioterápicos bloqueiam um processo chamado mitose, que interrompe as células de se dividirem, limitando assim a produção de células cancerosas;
- Hormônios destruidores de linfócitos, relacionados ao hormônio natural, cortisol, são usados em doses altas para destruir as células cancerosas;
- Anticorpos monoclonais, usados durante a imunoterapia, são uma classe de agentes que tem como alvo e destroem células cancerosas com menos efeitos colaterais do que a quimioterapia tradicional.
RADIOTERAPIA
A radioterapia é, algumas vezes, usada para destruir as células do linfoma não Hodgkin (LNH) que se acumularam em uma área do corpo. Poucos casos de LNH são tratados somente com a radioterapia porque é provável que as células do linfoma estejam espalhadas por todo o corpo. Porém, ela pode ser usada com outras terapias, como a quimioterapia se você tiver massas particularmente grandes de linfoma em uma área. Ela é também usada quando linfonodos grandes estão pressionando ou invadindo órgãos ou estruturas e a quimioterapia isolada não pode controlar o problema.
Durante a terapia, a radiação é dirigida somente às áreas do seu corpo afetadas pelo LNH. Uma máquina chamada acelerador linear, ou linac, aplica feixe de radiação a área(s) alvo(s) do seu corpo enquanto você está deitado em uma mesa móvel. Partes do seu corpo não afetadas pelo linfoma de Hodgkin, como os órgãos reprodutores são protegidos para ajudar a reduzir os efeitos colaterais do tratamento. O procedimento em si é indolor, embora algumas pessoas possam sentir desconforto ao permanecer na mesma posição por vários minutos durante a sessão.
TRANSPLANTE DE CÉLULAS TRONCO
Alguns pacientes podem ter linfoma que resiste ao tratamento ou que volta após um período de remissão. Se você se enquadra em uma dessas categorias o seu médico pode recomendar um transplante autólogo de células tronco para que você possa tolerar melhor a quimioterapia intensiva. Devido aos altos riscos, por vezes, com risco à vida, do transplante de células tronco, os médicos não o recomendam para o tratamento inicial. No entanto, o transplante autólogo de células tronco pode curar alguns pacientes, cujo linfoma está na primeira recidiva (o linfoma voltou após um período sem sinal da doença). O transplante para a primeira remissão está sendo feito apenas em estudos clínicos, com algumas exceções, como no tratamento do linfoma de células do manto. Existem vários tipos de transplante de células tronco. Os pacientes com linfoma não Hodgkin (LNH) mais comumente são submetidos ao transplante autólogo de células tronco, quando as suas próprias células tronco não cancerosas são “coletadas”, ou recuperadas, do seu corpo e congeladas. As suas células são devolvidas ao seu corpo por injeção após receber a terapia farmacológica intensiva.
O transplante autólogo não apresenta tanto risco quanto o transplante alogênico de células tronco quando as células tronco são provenientes de um doador compatível. O transplante alogênico de células tronco é usado para tratar somente pacientes selecionados com LNH.
OBSERVAR E ESPERAR
Algumas pessoas podem controlar o seu linfoma não Hodgkin (LNH) com seus médicos por anos usando a abordagem observar e esperar. Ao usar o método observar e esperar, o seu médico pode monitorar a sua condição com exames físicos e exames laboratoriais regulares. Você não tomará medicamentos ou será submetido a algum tratamento para LNH durante este período. Observar e esperar é uma abordagem de tratamento usada para o LNH indolente.
Você pode se sentir desconfortável porque sabe que tem câncer, porém não está sendo imediatamente tratado. Tenha certeza que a abordagem observar e esperar é o cuidado padrão para pessoas cuja doença não se espalhou e que não têm sintomas. A abordagem observar e esperar permite que você evite os efeitos colaterais da terapia até que precise de tratamento. O tratamento do LNH durante este estágio inicial não provou ser útil.
Você deve visitar o seu médico regularmente para que ele ou ela possa examiná-lo para qualquer alteração à saúde, especificamente observar se a sua doença permanece estável ou começa a progredir. O seu médico monitora os resultados do seu teste para decidir quando é hora de iniciar o tratamento e qual é a melhor opção de tratamento para você. Cerca da metade de todos os pacientes pode adiar o tratamento por pelo menos três anos. Alguns pacientes que permaneceram no modo observar e esperar por mais de 10 anos nunca precisaram de tratamento.
Observar e esperar também pode ser a melhor abordagem para alguns pacientes diagnosticados com LNH disseminado que o tratamento provavelmente não curará. A doença, embora disseminada, pode permanecer estável por anos, permitindo que eles evitem os efeitos colaterais da terapia desnecessária.
Quando Iniciar o Tratamento
O seu médico pode aconselhá-lo a iniciar o tratamento se tiver:
- Linfonodos que estão aumentando de tamanho;
- Linfonodos recém-afetados;
- Ossos ou outros órgãos que foram afetados pelo LNH;
- Um decréscimo no número de células sanguíneas.
Pesquisa e Estudos Clínicos Atuais no LNH
A seguir estão alguns dos tipos de pesquisa e estudos em andamento no LNH:
Medicamentos em Estudo
- O agente quimioterápico bendamustina (Treanda®), aprovado para a leucemia linfocítica crônica (LLC) e LNH indolente recidivado, está sendo estudado no linfoma de células do manto recém-diagnosticado, com rituximabe (Rituxan®) e lenalidomida (Revlimid®);
- Bortezomibe (Velcade®), um medicamento chamado “inibidor do proteassoma” que está aprovado para tratar pacientes com linfoma de células do manto que receberam pelo menos uma terapia prévia, está agora sendo investigado para efetividade como parte do tratamento inicial para o linfoma de células do manto. Os pesquisadores estão também explorando o uso de Velcade combinado a outros agentes, como Treanda e lenalidomida (Revlimid®);
- Agentes chamados “inibidores da histona desacetilase (HDAC)” são uma classe de medicamentos que tratam alterações “epigenéticas” no DNA. Um inibidor da HDAC, vorinostat (Zolinza®), que controla como o DNA é regulado, está aprovado para o tratamento de pacientes com linfoma cutâneo de células T que têm a doença progressiva, persistente ou recorrente durante ou após o tratamento com duas terapias sistêmicas. Este agente está agora sendo estudado para tratar o linfoma de células T e de células B isoladamente e em combinação com outros medicamentos;
- O medicamento imunomodulatório, Revlimid, está sendo estudado como tratamento para o linfoma difuso de grandes células B, linfoma de células do manto, linfoma folicular e leucemia linfocítica crônica (LLC);
- A terapia com o anticorpo monoclonal, ítrio-90-ibritumomabe tiuxetano (Zevalin®) foi aprovada para o linfoma de baixo grau recidivado e para pacientes com LNH folicular anteriormente não tratado que atingem uma resposta parcial ou completa à quimioterapia de primeira linha. A efetividade deste agente está agora sendo estudada no retratamento do linfoma, como terapia para o linfoma indolente recém-diagnosticado, como terapia para as formas agressivas do LNH combinado com ou após outros regimes farmacológicos e como parte de programas de terapia de alta dose juntamente com o transplante autólogo de células tronco;
- Ofatumumabe (Arzerra®) é um anticorpo monoclonal aprovado para o LLC recidivado e está agora sendo estudado em estudos clínicos em diversas combinações para o tratamento da leucemia linfocítica crônica, do linfoma difuso de grandes células B e do linfoma folicular;
- Pralatrexato (Foloytn®), aprovado para diversos subtipos de linfoma de células T, está sendo estudado em combinação com outros medicamentos quimioterápicos. Pralatrexato é um tipo de quimioterapia que interrompe processos em que as células são necessárias para a replicação celular.
- Existem diversos outros medicamentos em investigação que tem como alvo as vias de sinalização do receptor da células B dentro das células do linfoma. Alguns desses medicamentos incluem:
- Everolimo, um inibidor de mTOR, está sendo estudado em combinação com outros tratamentos para o LNH anteriormente tratado.
- Ibrutinibe (ImbruvicaTM), um inibidor de BTK que está sendo estudado em pacientes com LLC/LLS e linfoma de células do manto anteriormente não tratados.
- Idelalisibe, um inibidor oral da PI3K, que está sendo estudado para o tratamento de pacientes com LNH indolente que é refratário ao Rituxan e a uma quimioterapia contendo agente alquilante. Este medicamento está sendo desenvolvido como um agente único e em combinação com outra terapia.
- Tensirolimo, um inibidor de mTOR, está sendo atualmente estudado em combinação com outros tratamentos para o LNH anteriormente tratado.
Perfil por Expressão Gênica (GEP) e Microarranjos de Tecido (TMAs)
Essas são ferramentas que nos ajudam a entender melhor a biologia do linfoma. GEP e TMAs nos ajudam a caracterizar o linfoma com mais cuidado. Por exemplo, determinados biomarcadores em células tumorais estão associados a uma maior ou menor resposta à terapia e podem servir como preditores, indicando se alguém irá recidivar com a terapia ou se a sua doença se comportará de modo mais ou menos agressivo. Alguns dos mais importantes desses biomarcadores são baseados em gene. Uma ferramenta usada para analisar a atividade dos genes é chamada de “microarranjo”.
Microambiente
Existe um foco crescente na análise do microambiente tumoral; ou seja, as células que estão associadas ao tumor, ao invés do tumor em si. No linfoma folicular, determinadas células que são encontradas na realidade próximas às células tumorais têm demonstrado predizer um resultado melhor ou pior.
Transplante de Células Tronco de Intensidade Reduzida (Transplante Alogênico Não Mieloablativo)
Estudos clínicos estão em andamento para determinar a utilidade desta abordagem em pacientes com mais idade e mais enfermos para muitos cânceres do sangue, incluindo alguns subtipos do LNH. Consequentemente, o transplante pode ser uma opção para pacientes com idade entre 60 e 70 anos. Os pacientes que são condicionados para um transplante de intensidade reduzida recebem doses mais baixas de medicamentos quimioterápicos e/ou radiação em preparação para o transplante. Medicamentos imunossupressivos são usados para prevenir a rejeição do enxerto (as células imunológicas do doador), permitindo que as células imunológicas enxertadas ataquem a doença do receptor. A efetividade do transplante de intensidade reduzida é graças ao efeito enxerto versus linfoma dos linfócitos do doador e não às altas doses de quimioterapia.
Vacinas
Os cientistas estão desenvolvendo vacinas que estimulam o sistema imunológico a combater e suprimir o crescimento de células do linfoma. Diferente das vacinas clássicas, elas não previnem a doença; mas, se usadas durante a remissão, estimulam o sistema imunológico a atacar as células residuais do linfoma e impede-as de causar uma recidiva.
TRATAMENTO PARA SUBTIPOS AGRESSIVOS DO LNH
O linfoma não Hodgkin (LNH) agressivo progride rapidamente. Ele constitui cerca de 60 por cento de todos os casos de LNH nos Estados Unidos. Os subtipos agressivos incluem:
- Linfoma associado a AIDS;
- Linfoma anaplásico de grandes células;
- Linfoma de Burkitt;
- Linfoma do sistema nervoso central (SNC);
- Linfoma difuso de grandes células B (LDCBG);
- Linfoma hepatoesplênico;
- Linfoma de células do manto;
- Linfoma do tecido linfoide associado a mucosa (MALT) (transformado);
- Linfoma de células T periférico (a maioria dos tipos);
- Linfoma folicular transformado.
O objetivo do tratamento para muitos subtipos é a cura. O tratamento para o LNH agressivo começa no momento do diagnóstico.
A quimioterapia provou ser geralmente uma abordagem efetiva para tratar os subtipos agressivos. O cuidado padrão para cada subtipo varia. A seguir estão alguns exemplos de abordagens específicas à terapia:
- Doença de estágio inicial. O tratamento pode incluir a combinação quimioterápica CHOP ou a radioterapia de campo envolvido, ou ambos. Às vezes, o anticorpo monoclonal, rituximabe (Rituxan®), é adicionado ao regime CHOP (R-CHOP);
- Doença de estágio avançado. O tratamento de primeira linha é CHOP com Rituxan (R-CHOP);
- Doença que se espalhou para outras áreas ou órgãos. Se o linfoma está na medula óssea, nos seios nasais ou nos testículos ou próximo à coluna vertebral, existe o risco que ela possa se espalhar para o sistema nervoso central. Nessas circunstâncias, a quimioterapia pode ser administrada diretamente no líquor;
- Doença de alto risco. Fatores associados a um alto risco para recidiva após a terapia padrão incluem altos níveis ou a presença de determinadas proteínas no sangue e a mutação do gene p53. Nesses casos, é necessário um tratamento inicial mais agressivo do que o normal. Um estudo clínico pode ser uma opção de tratamento efetiva.
Tratando os Subtipos Agressivos Específicos
Linfoma Associado à AIDS
Determinados tipos de LNH são vistos com mais frequência em pessoas que têm a síndrome da imunodeficiência adquirida (AIDS), incluindo o linfoma difuso de grandes células B, linfoma de Burkitt e linfoma primário do sistema nervoso central. O resultado do tratamento depende de como a AIDS está respondendo à terapia. Como a AIDS já leva a baixas contagens de células brancas, a quimioterapia deve ser considerada cuidadosamente para determinar se o efeito adicional do tratamento nos níveis sanguíneos pode ser controlado. A melhora do tratamento para o vírus da imunodeficiência humana (HIV) nos últimos anos tem ajudado a reduzir o número de pessoas diagnosticadas com LNH associado à AIDS.
Linfoma Anaplásico de Grandes células
O linfoma anaplásico de grandes células, mais comum em pessoas jovens, geralmente começa nos linfonodos e pode se espalhar para a pele. Porém, também pode começar na pele. Uma combinação de radioterapia e quimioterapia tem provado ser uma abordagem efetiva de duas vertentes para tratar este subtipo. Brentuximabe vedotina, (Adcetris(R)), também conhecido como SGN-35, está aprovado pela FDA no tratamento de pacientes com linfoma anaplásico sistêmico de grandes células (LACG) após falha de pelo menos um regime quimioterápico prévio de múltiplos agentes. Brentuximabe vedotina é administrado por injeção. Cerca de 80 por cento dos pacientes com linfoma anaplásico de grandes células apresenta cura. A terapia combinada é mais efetiva se as células tumorais de um paciente apresentarem uma proteína chamada ALK-1.
Linfoma de Burkitt
Este subtipo de células B é considerado como sendo altamente agressivo. Ele geralmente aparece como uma massa de linfoma na área abdominal (estômago). Ele também pode aparecer na medula óssea, no sangue, no sistema nervoso central e em outros órgãos. O linfoma de Burkitt, que tem essa denominação em homenagem ao cirurgião que identificou a doença pela primeira vez em crianças na África, afeta, em grande parte, adultos com mais idade. Na África, a doença geralmente aparece em crianças como uma massa no osso facial, especialmente na mandíbula. Os médicos usam tipicamente a quimioterapia para tratar a doença. Os medicamentos usados incluem a prednisona, a ciclofosfamida (Cytoxan®), a vincristina (Oncovin®), a citarabina (Cytosar-U®, citosina arabinosida, ara-C), a doxorrubicina (Adriamycin® PFS, Adriamycin®) e o metotrexato (Rheumatrex®, Trexall®).
Linfoma do Sistema Nervoso Central
Existem dois tipos deste linfoma raro no sistema nervoso central (SNC): primário e secundário. O Linfoma primário do SNC começa no cérebro ou na coluna vertebral e é um linfoma associado a AIDS, embora possa estar relacionado a outros subtipos de LNH também. O linfoma secundário do SNC começa em outra área do corpo e se dissemina para o cérebro e/ou coluna vertebral. Os pesquisadores estão atualmente estudando tratamentos efetivos para ambos os tipos em estudos clínicos. O tratamento padrão pode incluir a quimioterapia, medicamentos glicocorticoides e/ou a radioterapia. O tratamento em estudos clínicos inclui a imunoterapia e a quimioterapia de alta dose com o transplante de células tronco.
Linfoma Difuso de Grandes células B
O linfoma difuso de grandes células B (LDCBG) é o tipo mais comum do subtipo agressivo do LNH, constituindo 30 por cento de todos os casos de LNH nos Estados Unidos. Ele afeta, em geral, adultos na meia idade e com mais idade. Embora ele se enquadre na categoria agressiva, o LDCBG pode, algumas vezes, começar como um linfoma indolente, como o linfoma de células B pequenas ou um linfoma folicular. O regime quimioterápico R-CHOP tem provado ser bem-sucedido ao curar 50 por cento a 60 por cento dos pacientes com LDCBG e é o cuidado padrão para a doença de estágio avançado.
Linfoma Hepatoesplênico
Este tipo de linfoma de células T é uma doença extremamente rara e agressiva que começa no fígado ou baço e geralmente afeta adultos jovens na faixa dos 20 e 30 anos de idade. O tratamento para pacientes com linfoma hepatoesplênico de células T inclui a quimioterapia baseada em antraciclina e, em alguns casos, o transplante de células tronco.
Linfoma de Células do Manto
Pelo momento em que o linfoma de células do manto é diagnosticado, ele geralmente já se espalhou para os linfonodos e medula óssea e, algumas vezes, no fígado, intestinos e baço. O LNH se desenvolve em um linfócito na área de um linfonodo conhecido como a zona do manto. O linfoma de células do manto é mais comumente diagnosticado em homens com mais de 50 anos de idade. Os médicos geralmente tratam o linfoma de células do manto com medicamentos quimioterápicos e o anticorpo monoclonal rituximabe (Rituxan®).
Linfoma do Tecido Linfoide Associado a Mucosa (MALT) (Transformado)
O linfoma do tecido linfoide associado a mucosa (MALT), que afeta locais fora dos linfonodos, como o trato gastrintestinal, olhos, glândula da tireoide, glândula salivares, pulmões ou pele, e representa cerca de 7,5 por cento dos casos de LNH. Os pacientes com linfoma MALT podem ter um histórico de doença autoimune. Uma maior incidência de linfoma MALT, envolvendo o estômago, é vista em pacientes que foram infectados com a bactéria Helicobacter pylori (H. pylori). As bactérias também têm sido implicadas em outras formas do linfoma MALT. O tratamento geralmente inclui combinações potentes de antibióticos, que erradicam a infecção por H. pylori e causam a regressão do linfoma. Muitos pacientes com H. pylori foram curados do linfoma MALT sem a radioterapia ou a quimioterapia.
O linfoma MALT transformado é um linfoma agressivo e é incomum. Para este pequeno subconjunto de pacientes, o linfoma MALT pode se transformar em linfoma difuso de grandes células B (LDCBG). Esses pacientes mostraram se beneficiar com os tratamentos usados para o LDCBG.
Linfoma de Células T Periférico
O linfoma de células T periférico é um dos linfomas mais difíceis de tratar. Existem diversas formas deste subtipo:
- Linfoma agudo adulto de células T (o mais comum);
- Linfoma extranodal de células T ou de células ‘natural killer’ (células NK);
- Linfoma do tipo nasal, que geralmente afeta as vias aéreas superiores, como o nariz e a nasofaringe, e a pele e o trato digestivo;
- Linfoma de células T associado a enteropatia, que pode afetar pessoas sensíveis ao glúten;
- Linfoma subcutâneo de células T paniculite-símile, que invade as camadas mais profundas da pele, causando a formação de nódulos sob a pele.
O linfoma de células T periférico é geralmente tratado como o linfoma difuso de grandes células B, geralmente com R-CHOP. No entanto, estudos estão em andamento para desenvolver abordagens terapêuticas mais efetivas.
O que é tratamento para PTCL recidivada ou refratária?
Não existe consenso sobre a melhor estratégia terapêutica para o PTCL recidivado/refratário. ‘Recidivado’ significa que, embora o seu tumor fosse inicialmente sensível à quimioterapia e não houvesse encolhimento tumoral inicial, as células do seu câncer não apresentam mais encolhimento com a quimioterapia que você recebeu. Você pode ser refratário ao primeiro tratamento que recebeu ou pode ser refratário após o seu câncer ter recidivado. ‘Recidivado’ e ‘refratário’ significam que as células do seu tumor desenvolveram resistência à quimioterapia que você estava recebendo e ela não é mais efetiva.
Desde 2009, existem dois agentes aprovados para pessoas com PTCL pela Agência Regulatória de Alimentos e Medicamentos dos Estados Unidos. Pralatrexato (Difolta) foi aprovado em setembro de 2009 para o tratamento de pacientes com PTCL recidivado ou refratário. Romidepsina (Istodax) recebeu aprovação acelerada como um tratamento para pessoas com PTCL que receberam pelo menos uma terapia prévia em junho de 2011.
Linfoma Folicular Transformado
O linfoma folicular começa como um subtipo indolente do LNH. No entanto, ele geralmente se transforma em um linfoma agressivo de grandes células B. A quimioterapia de alta dose seguida pelo transplante autólogo de células tronco pode ser um tratamento efetivo para controlar a doença.
Um estudo clínico também pode ser uma boa opção para os pacientes com linfoma folicular, cuja doença se transformou, apesar de diversas abordagens diferentes de tratamento terem sido tentadas. Outras escolhas de tratamento são:
- Quimioterapia com ou sem o anticorpo monoclonal, rituximabe (Rituxan®);
- Um anticorpo monoclonal radioimunoterapêutico, como Zevalin®;
- Radioterapia;
- Cuidado de suporte;
- Combinação de quimioterapia com Rituxan e possivelmente radioterapia para pacientes cujo LF se transformou antes de uma quantidade significativa de tratamento e está em uma única área;
- Infusão autóloga de células tronco (em um estudo clínico).
TRATAMENTO PARA SUBTIPOS INDOLENTES DO LNH
Subtipos indolentes do linfoma não Hodgkin (LNH) progridem lentamente. Eles constituem cerca de 30 por cento de todos os casos de LNH nos Estados Unidos. Os subtipos indolentes incluem:
- Linfoma cutâneo de células T (micose fungoide e síndrome de Sézary);
- Linfoma folicular;
- Linfoma linfoplásico e macroglobulinemia de Waldenstrom;
- Linfoma de zona marginal;
- Linfoma linfocítico de pequenas células (LLPC) e leucemia linfocítica crônica (LLC).
O tratamento para o LNH indolente varia de uma abordagem observar e esperar à terapia agressiva. O controle ou tratamento do LNH indolente é altamente individual. O seu médico considera uma série de fatores, como:
- Sua perspectiva para recuperação;
- O estágio da doença;
- A sua saúde geral.
Se não tiver sintomas e a sua doença não estiver progredindo, o seu médico pode recomendar a abordagem observar e esperar. Você não receberá terapia imediata, mas o seu médico o monitorará de perto para qualquer alteração. Mas ter um LNH indolente não qualifica você automaticamente para o observar e esperar: Alguns tipos de LNH indolente precisam de terapia inicial agressiva.
Medicamentos Usados para o Linfoma Não Hodgkin Indolente
Se precisar de tratamento imediato, você será geralmente submetido à quimioterapia. Os médicos combinam comumente até cinco medicamentos quimioterápicos para tratar o LNH indolente. Cada tipo de medicamento funciona de uma maneira diferente para matar as células cancerosas. A combinação de tipos de medicamentos pode aumentar a sua efetividade.
Um regime quimioterápico comum é um grupo de medicamentos conhecido como CVP. (Os nomes das combinações são geralmente abreviações para a primeira letra dos medicamentos usados.) CVP combina os seguintes medicamentos:
- Ciclofosfamida (Cytoxan ®);
- Vincristina (Oncovin ®);
- Prednisona.
Para determinados subtipos, os médicos normalmente adicionam o anticorpo monoclonal, rituximabe (Rituxan®) a esta mistura, combinado ao CVP ou administrado posteriormente, o que pode ajudar na efetividade do tratamento.
Tratando Subtipos Indolentes Específicos
Linfoma Cutâneo de Células T (Micose Fungoide e Síndrome de Sézary)
O linfoma cutâneo de células T geralmente começa em uma célula T na pele. Pode se tornar mais avançado se ele se espalhar para outros órgãos. Dois tipos comuns de linfoma cutâneo de células T são a micose fungoide e a síndrome de Sézary. Este subtipo de LNH pode ser difícil de diagnosticar em suas fases iniciais. O tratamento depende de ele estar ainda presente nos linfonodos e da gravidade das lesões cutâneas. Pode incluir medicamentos quimioterápicos tópicos que você aplica diretamente à pele afetada combinados à fototerapia com ultravioleta e à terapia com feixes de elétrons. O medicamento comumente usado com a fototerapia com ultravioleta é psoraleno. Esta combinação de tratamento é abreviada e referida como PUVA. Se a doença estiver disseminada, o seu médico pode usar a quimioterapia com um ou mais medicamentos ou a fotoférese extracorpórea, um método que retira o sangue do seu corpo e o trata com luz ultravioleta antes de ser devolvido ao seu corpo.
Linfoma Folicular
O linfoma folicular (LF) é o segundo subtipo mais comum de linfoma não Hodgkin (LNH), constituindo cerca de 20 por cento de todos os casos de LNH. O linfoma começa nas células em que ocorre uma translocação entre os cromossomos 14 e 18. Isto causa a produção excessiva (superexpressão) do gene BCL-2, que pode tornar as células resistentes à terapia. No entanto, o tratamento pode manter a doença indolente controlada por vários anos.
O LF tem um alto risco de se transformar em uma doença agressiva. O LF pode ser tratado com:
- Radioterapia;
- Quimioterapia seguida por radioterapia;
- Uma abordagem de observar e esperar;
- Um anticorpo monoclonal radioativo;
- Transplante de células tronco.
A participação em um estudo clínico também pode ser uma boa opção de tratamento.
Os médicos desenvolveram um sistema de pontuação chamado Índice de Prognóstico Internacional para Linfoma Folicular que pode ajudá-los a predizer quais pacientes têm um maior risco de a doença voltar (recorrência). Os médicos elaboram um plano de tratamento em torno da pontuação dos pacientes. Os fatores que aumentam o risco para pacientes com LF incluem:
- Idade acima de 60 anos;
- Doença de estágio III ou IV;
- Mais de quatro linfonodos envolvidos;
- Um nível elevado de lactato desidrogenase (um tipo de proteína) no sangue;
- Uma baixa concentração de hemoglobina (menos de 12 gramas por decilitro) no sangue;
- Opções de tratamento para o LF transformado estão descritas no Tratamento para Subtipos Agressivos do LNH.
Linfoma Linfoplasmacítico e Macroglobulinemia de Waldenström
O linfoma linfoplasmacítico e macroglobulinemia de Waldenström são dois subtipos de LNH proximamente relacionados que começam em uma célula B. Ambos podem se tornar mais avançados se o linfoma se espalhar para outros órgãos, como os pulmões e o trato digestivo. O seu médico pode sugerir uma abordagem observar e esperar se a doença estiver em seus estágios iniciais. Do contrário, você pode ser tratado com regimes terapêuticos que incluem uma combinação de agentes biológicos (tratamento que estimula o sistema imunológico a combater o câncer), inibidores de sinalização (medicamentos que bloqueiam os sinais de pró-crescimento e sobrevida), e a quimioterapia. Recentemente, o ibrutinibe (Imbruvica®) passou a ser o primeiro medicamento aprovado para o tratamento de pacientes sintomáticos com MW.
Uma complicação séria das duas doenças é chamada síndrome da hiperviscosidade, em que há o espessamento do sangue. Isto leva a um fluxo sanguíneo inadequado, causando sintomas como cefaleia, visão turva e confusão mental. Para tratar a síndrome, o seu médico pode fazer com que você passe por uma plasmaférese, um método que retira do seu sangue o excesso de anticorpos que causam a condição. Isto é seguido por tratamento para controlar o linfoma.
Linfoma de Zona Marginal
O linfoma de zona marginal pode se desenvolver nos linfonodos (nodal) ou em outro local do corpo (extranodal), porém geralmente não se espalha. O linfoma nodal de zona marginal de células B (também chamado linfoma monocitoide de células B) é uma forma rara da doença que é encontrada no baço e no sangue.
O linfoma do tecido linfoide associado a mucosa (MALT) é um tipo mais comum que se desenvolve fora dos linfonodos, incluindo o trato digestivo (gastrintestinal), olhos, glândula da tireoide, glândulas salivares, pulmões e pele. MALT tem sido associado a um histórico de doença autoimune e infecção bacteriana, incluindo Helicobacter pylori (H. pylori). Os médicos tratam MALT com combinações potentes de antibióticos, resultando em curas para alguns pacientes sem ter que passar pela radioterapia ou quimioterapia.
Linfoma Linfocítica de Pequenas Células e Leucemia Linfocítica Crônica
O linfoma linfocítico de pequenas células (LLPC) e a leucemia linfocítica crônica (LLC) são subtipos semelhantes de LNH. Eles tendem a afetar as mesmas faixas etárias (a idade mediana dos pacientes é de 65 anos), têm sinais e sintomas comuns e são de crescimento lento. As diferenças estão em onde eles se desenvolvem: LLPC geralmente afeta os linfonodos e o tecido linfoide; o LLC geralmente afeta o sangue e a medula óssea, mas pode se espalhar para os linfonodos. O tratamento para ambos é o mesmo: quimioterapia com o medicamento, bendamustina (Treanda®), que é usado para tratar o LLC. Ele provou ser efetivo em pacientes com LLPC em estudos clínicos após o tratamento com rituximabe (Rituxan®) isoladamente ou com outros medicamentos.
EFEITOS COLATERAIS
A terapia para câncer no linfoma não Hodgkin (LNH) pode, algumas vezes, produzir efeitos colaterais. Para a maioria dos pacientes, os efeitos colaterais do tratamento são temporários e desaparecem assim que a terapia termina. Para outros pacientes, os efeitos colaterais podem ser mais graves, algumas vezes, necessitando de hospitalização. Alguns pacientes nunca têm efeitos colaterais. Antes de receber o tratamento, converse com o seu médico sobre os possíveis efeitos colaterais. Medicamentos e outras terapias podem prevenir ou controlar muitos efeitos colaterais. Converse também com o seu médico sobre efeitos de longo prazo e tardios do tratamento. Alguns tratamentos para LNH têm um alto risco de infertilidade.
Efeitos Colaterais Comuns
Os medicamentos quimioterápicos são os principais responsáveis quando se trata de causar efeitos colaterais indesejados. Esses medicamentos matam as células cancerosas, mas também danificam células normais. O revestimento da boca, garganta, estômago e intestinos são particularmente vulneráveis ao dano.
Os efeitos colaterais que você pode apresentar dependem de:
- A intensidade da quimioterapia;
- Os medicamentos usados durante a terapia;
- A localização da radioterapia;
- A sua idade;
- A saúde geral e se você tem alguma condição de saúde crônica, como diabetes ou doença renal.
Os efeitos colaterais a seguir são comuns à quimioterapia, radioterapia e ao transplante de células tronco.
- Infecções;
- Contagens baixas de células sanguíneas;
- Feridas na boca;
- Náusea e vômito;
- Diarreia;
- Constipação;
- Irritação da bexiga urinária;
- Sangue na urina;
- Fadiga extrema;
- Anemia;
- Febre;
- Tosse;
- Erupções cutâneas;
- Queda de cabelo;
- Fraqueza;
- Sensações de formigamento;
- Problemas no pulmão, coração, rins ou no nervo;
- Infertilidade;
- Doença do enxerto versus hospedeiro (se você passou por um transplante alogênico de células tronco).
REFRATÁRIO E RECIDIVADO
Alguns pacientes ainda têm células do linfoma em sua medula óssea após o tratamento para LNH. Isto é chamado ‘linfoma não Hodgkin refratário’. Alguns pacientes têm um retorno das células do linfoma na medula e um decréscimo nas células sanguíneas normais após a remissão. Isto é chamado ‘recidiva’.
Medicamentos Usados para o LNH Refratário e Recidivado
A maioria dos pacientes com LNH refratário ou recidivado recebe a terapia de segunda linha – tratamento diferente do tipo usado da primeira vez. Os regimes farmacológicos comuns de segunda linha, algumas vezes, seguidos pelo transplante de células tronco, incluem:
- ICE: ifosfamida (Ifex®), carboplatina (Paraplatin®), etoposida (Etopophos®, Toposar®, VePesid®, VP-16);
- RICE: rituximabe (Rituxan®), Ifex, carboplatina (Paraplatin®), etoposida;
- DHAP: dexametasona (Decadron®), citarabina (Cytosar-U®, citosina arabinosida, ara-C), cisplatina (Platinol®-AQ);
- ESHAP: etoposida, metilprednisolona (Medrol®), citarabina de alta dose, Platinol-AQ;
- R-ESHAP: Rituxan, etoposida, Medrol, citarabina de alta dose, Platinol-AQ.
Linfoma Não Hodgkin Refratário
O termo ‘linfoma não Hodgkin refratário’ é usado para descrever uma doença que não entra em remissão (mas pode estar estável) ou que piora nos seis meses desde o último tratamento.
Linfoma Não Hodgkin Recidivado
Se o seu linfoma voltar após uma remissão (sem sinal da doença) de seis meses ou mais, você apresentou uma recaída (recidiva). Você pode apresentar uma recaída (recidiva) meses ou anos após o tratamento. Se você tiver uma recaída muito tempo após o tratamento, você pode passar por tratamento semelhante ao que recebeu quando recebeu o diagnóstico. Os pacientes com LNH refratário normalmente são submetidos a quimioterapia de alta dose com transplante de células tronco.
Para pacientes com linfoma folicular de estágio avançado, o tratamento depende dos sintomas e da extensão de disseminação da doença. Para pacientes que já foram tratados com quimioterapia usando o regime CHOP, um transplante autólogo de células tronco pode ser uma opção.
LINFOMA NÃO HODGKIN INFANTIL
Tratamento
O diagnóstico de câncer de uma criança pode trazer consigo sentimentos de incerteza para os pais e outros familiares. De repente, você é empurrado para um mundo de mudanças rápidas, com preocupações, medos e incertezas. Você terá que tomar decisões de tratamento enquanto estiver confortando o seu filho – e ao mesmo tempo tentará enfrentar as suas próprias emoções.
O tratamento do seu filho depende de determinados fatores:
- O estágio da doença;
- O subtipo da doença;
- Se a doença é agressiva (crescimento rápido) ou indolente (crescimento lento);
- Se o linfoma está em áreas do corpo diferentes dos linfonodos (envolvimento extranodal);
- Possíveis fatores de risco que podem ser encontrados durante os exames laboratoriais.
O oncologista (especialista em câncer) do seu filho deve desenvolver um plano de tratamento que limita a quantidade de terapia necessária para atingir a remissão. Certifique-se de perguntar o oncologista sobre possíveis efeitos colaterais e efeitos de longo prazo ao considerar as opções de tratamento. Alguns efeitos de longo prazo, como infertilidade, podem ser sérios. Baixe ou peça a ficha técnica gratuita da Sociedade de Leucemia e Linfoma Fatos sobre Fertilidade.
Crianças com LNH podem, algumas vezes, ser tratadas de maneira diferente dos adultos. Escolher a terapia mais efetiva para adolescentes e adultos jovens (idade entre 15 e 29 anos) pode ser um desafio e é um tópico de pesquisa em andamento. De fato, o tratamento usado em adultos para determinados subtipos de LNH, incluindo o linfoma de Burkitt e o linfoma linfoblástico, já é, na realidade, uma terapia pediátrica.
Estudos Clínicos
Um estudo clínico pode ser uma opção quando se trata de encontrar o tratamento certo para o câncer do seu filho. Estudos clínicos para crianças, adolescentes e adultos jovens com câncer são geralmente projetados para comparar potencialmente a terapia mais efetiva com a terapia que é atualmente aceita como padrão. O seu filho terá acesso a terapias novas ou melhoradas em estudo e ainda não disponíveis no mercado. Discuta com o médico do seu filho sobre a possibilidade de participar de um estudo clínico, onde o tratamento é administrado em um ambiente seguro e criteriosamente monitorado.
Sobrevivência e Necessidades de Cuidado à Saúde Especiais
Após o tratamento, a maioria das crianças pode esperar ter vidas plenas e produtivas. Muitos sobreviventes voltam à escola, vão à faculdade, entram para a força de trabalho, casam-se e têm filhos. Você pode considerar um programa de sobrevivência para o seu filho que foca na vida após o câncer. A maioria dos principais hospitais em todo o mundo oferece esses programas.
Cuidado de Acompanhamento
O seu filho deve visitar o pediatra ou médico pelo menos uma vez por ano para um exame físico completo e testes adicionais necessários. O seu oncologista também deve examinar regularmente o seu filho.
As visitas regulares ao médico são encorajadas para:
- Permitir que os médicos avaliem o efeito completo da terapia;
- Detectar e tratar a recorrência da doença;
- dentificar e controlar efeitos de longo prazo e tardios do tratamento.
O seu pediatra deve recomendar um cronograma para avaliar as habilidades de aprendizado do seu filho. Se parecer que o seu filho está apresentando dificuldades de aprendizado, métodos de educação especial podem ajudar. É importante a coordenação entre o pediatra e o oncologista do seu filho para o melhor cuidado possível. Alguns centros de tratamento oferecem clínicas de cuidado abrangente de acompanhamento para crianças sobreviventes do câncer.
Efeitos de Longo Prazo e Tardios do Tratamento
Alguns efeitos colaterais do tratamento para câncer, como fadiga, podem durar meses ou anos após a terapia. Algumas condições médicas, como doença cardíaca e outros cânceres podem não aparecer até anos após o final do tratamento. Os efeitos de longo prazo e tardios podem impactar a saúde física mental e cognitiva (função cerebral) do seu filho.
A maioria dos sobreviventes do linfoma infantil não desenvolve efeitos significativos de longo prazo ou tardios do tratamento. No entanto, para alguns pacientes, os efeitos podem variar de leves a graves.
Efeitos de Longo Prazo e Tardios da Quimioterapia
As crianças tratadas para linfoma podem estar em risco aumentado para:
- Fadiga;
- Atraso no crescimento;
- Disfunção da tireoide;
- Perda na audição;
- Um câncer secundário.
Alguns efeitos de longo prazo e tardios se tornam visíveis com a maturação (puberdade), crescimento e o processo normal de envelhecimento. A intervenção precoce e práticas de estilo de vida saudável (não fumar, dieta equilibrada, prática de exercícios, check-ups e acompanhamento regulares) ajudam.
Efeitos de Longo Prazo e Tardios da Radioterapia
As meninas (e também mulheres com menos de 30 anos de idade) que recebem radiação na área das mamas estão em risco para desenvolver câncer de mama 15 a 20 anos após o tratamento. Os meninos sobreviventes do câncer infantil estão em risco de desenvolver um segundo câncer, mas não têm um risco tão alto para desenvolver câncer de mama que as meninas sobreviventes do câncer infantil.
As meninas que receberam radioterapia na área do tórax (mediastinal) devem:
- Realizar autoexames mensais da mama;
- Fazer uma mamografia basal com 25 a 30 anos de idade ou 10 anos após a radioterapia;
- Fazer um exame clínico anual da mama;
- Fazer uma mamografia a cada dois a três anos, dependendo da densidade do tecido mamário.
As meninas e meninos que tiverem recebido radioterapia mediastinal devem fazer o teste basal para a função cardíaca. Isto deve ser seguido pelo teste a cada três a cinco anos após o tratamento ou com mais regularidade se forem encontradas anormalidades.
Volta à Escola
Dificuldades no aprendizado podem começar durante o tratamento ou aparecer meses ou anos depois. Educar os familiares, amigos, professores e profissionais de saúde sobre os possíveis efeitos de longo prazo e tardios do tratamento do seu filho. Conversar com os professores e profissionais de saúde do seu filho para desenvolver um programa personalizado às suas necessidades que apresente teste basal, acomodações especiais e planejamento no longo prazo.
- Estadiamento
-
O seu médico determinará a extensão de progressão da sua doença pelo estadiamento. O estadiamento ajuda o seu médico a calcular a progressão da doença e a desenvolver um plano de tratamento.
O LNH nem sempre começa no estágio I e se espalha para estágios mais avançados. Mais da metade de todos os pacientes com doença intermediária ou agressiva e mais de 80 por cento de todos os pacientes com doença indolente são diagnosticados com LNH de estágio III ou IV. E, se alguém for diagnosticado no estágio IV, não significa que a doença é incurável – ela pode ser altamente curável dependendo do subtipo.
Estágio I
Envolvimento de um grupo de linfonodos
Estágio II
Envolvimento de dois ou mais grupos de linfonodos do mesmo lado do diafragma (um músculo fino abaixo dos pulmões)
Estágio III
Envolvimento de grupos de linfonodos em ambos os lados do diafragma
Estágio IV
Envolvimento de um ou mais órgãos, diferente dos linfonodos, e possível envolvimento dos linfonodos
Categorias A, B, X e E
Os quatro estágios do LNH podem ser divididos em categorias:
- Categoria A: Sem febre, sem sudorese exagerada ou sem perda de peso presentes;
- Categoria B: Febre, sudorese excessiva e perda de peso presentes;
- Categoria X: Doença volumosa (massas grandes de linfócitos) presente;
- Categoria E: O linfoma se espalhou para áreas ou órgão foram dos linfonodos, ou para tecidos além, mas próximos, das principais áreas linfáticas.
Por exemplo, o estágio IIB indica que o paciente tem:
- Dois locais de linfonodos próximos um do outro com envolvimento da doença (por exemplo, linfonodos aumentados no pescoço e próximos à clavícula, ou no pescoço e axila);
- Febre, sudorese excessiva e perda de peso.
O seu tratamento depende do seu estágio e categoria. Os pacientes que se enquadram na categoria B geralmente precisam de tratamento mais agressivo do que os pacientes na categoria A.
O mieloma múltiplo é um câncer da medula óssea muito mais comum do que imaginamos. Ao contrário da maioria dos cânceres, ele não se apresenta como um tumor maciço ou nódulo, ao invés disso, as células de mieloma estão espalhadas na medula óssea. Em alguns casos, as células de mieloma se acumulam lentamente na medula óssea.
O mieloma é literalmente um “oma” ou tumor, envolvendo o “mielo,” ou células produtoras de sangue na medula óssea. As células que são afetadas são os plasmócitos (um tipo de célula branca, leucócito), que são as nossas células produtoras de anticorpos (produtoras de imunoglobulina). Uma célula do plasma maligna ou cancerosa é chamada de célula de mieloma. Mieloma é chamado “múltiplo”, já que existem, frequentemente, múltiplas porções ou áreas no osso em que ele cresce. O mieloma pode aparecer como um tumor e/ou uma área de perda óssea. Em qualquer um dos casos, o tumor ou ‘buraco’ no osso é chamado de “lesão”. As áreas de perda óssea causadas pelo mieloma são mencionadas como “lesões líticas”. O único momento em que o mieloma não é “múltiplo” é no caso raro de um “plasmocitoma solitário”, um único tumor de mieloma que pode aparecer dentro ou fora da medula óssea.
Existem alguns fatores de risco que podem causar o mieloma ou desencadear uma população de células já anormais ou pré-mieloma danificadas na medula óssea.
São eles:
- Exposição a substâncias químicas tóxicas;
- A exposição séria à radiação é muito incomum, mas ocorreu no Japão em locais de testes e reatores atômicos e também em instalações industriais;
- Histórico familiar. Aproximadamente 5% – 7% dos diagnósticos de mieloma ocorrem em um membro da família que tem um parente próximo anteriormente diagnosticado com GSMI ou mieloma.
No primeiro estágio da doença é muito difícil apresentar um sintoma, mas a medida que a doença progride os sintomas aparecem.
Separamos todos os sintomas de mieloma múltiplo. Confira e lembra-se: com saúde não se brinca!
- Dores ósseas;
- Anemia;
- Problemas renais;
- Fraturas patológicas;
- Sangue na urina;
- Frequentes infecções: podem ser um sinal que o seu sistema imunológico está comprometido.
O mieloma múltiplo é muito difícil ser diagnosticado, tanto que a maioria dos pacientes descobrem a doença em um estágio mais avançado. Isso acontece, pois os sintomas são comuns, facilmente confundidos com outras doenças, como por exemplo a hérnia de disco e problemas nas costas.
Se os sintomas sugerem que a pessoa pode estar com mieloma múltiplo, o médico poderá solicitar: exames laboratoriais como de sangue e urina, raio-x nos ossos e biópsia da medula-óssea.
Decidir se o tratamento é necessário, é a decisão inicial mais importante. Como já enfatizado, o teste basal, estadiamento e classificação prognóstica são essenciais. O tratamento é recomendado para o mieloma ativo ou sintomático e para a doença indolente que atende novos critérios de “altíssimo risco”. A urgência do tratamento depende dos problemas exatos enfrentados por um paciente individual.
O estágio inicial é chamado de Gamopatia Monoclonal de Significância Indeterminada (GSMI). Isto não é um câncer. Em GSMI, as células do mieloma constituem menos de 10% das células da medula óssea. O risco de transição de GSMI para mieloma ativo é muito baixo: apenas uma chance de 1% a cada ano de acompanhamento. Mesmo se as células do mieloma estiverem em um nível maior, de 10% – 60% do total da medula óssea, a taxa de crescimento pode ser muito lenta e representa o mieloma múltiplo assintomático (MMI). GSMI e MMI de “baixo risco” podem mudar, muito lentamente, durante um período de anos e não requer tratamento ativo.
O mieloma múltiplo assintomático de baixo risco não é nem GMSI, nem MMI de alto risco. É muito importante estabelecer o diagnóstico correto, distinguindo GMSI e MMI do mieloma ativo, ou inicial ativo, que requer tratamento.
Mais informações acesse o site da International Myeloma Foundation Latin America – IMF Latin America ou ligue para ligue para 0800 777 0355 (IMF Latin America) e saiba tudo sobre essa doença!
O mieloma múltiplo é um câncer da medula óssea muito mais comum do que imaginamos. Ao contrário da maioria dos cânceres, ele não se apresenta como um tumor maciço ou nódulo, ao invés disso, as células de mieloma estão espalhadas na medula óssea. Em alguns casos, as células de mieloma se acumulam lentamente na medula óssea.
O mieloma é literalmente um “oma” ou tumor, envolvendo o “mielo,” ou células produtoras de sangue na medula óssea. As células que são afetadas são os plasmócitos (um tipo de célula branca, leucócito), que são as nossas células produtoras de anticorpos (produtoras de imunoglobulina). Uma célula do plasma maligna ou cancerosa é chamada de célula de mieloma. Mieloma é chamado “múltiplo”, já que existem, frequentemente, múltiplas porções ou áreas no osso em que ele cresce. O mieloma pode aparecer como um tumor e/ou uma área de perda óssea. Em qualquer um dos casos, o tumor ou ‘buraco’ no osso é chamado de “lesão”. As áreas de perda óssea causadas pelo mieloma são mencionadas como “lesões líticas”. O único momento em que o mieloma não é “múltiplo” é no caso raro de um “plasmocitoma solitário”, um único tumor de mieloma que pode aparecer dentro ou fora da medula óssea.
Existem alguns fatores de risco que podem causar o mieloma ou desencadear uma população de células já anormais ou pré-mieloma danificadas na medula óssea.
São eles:
- Exposição a substâncias químicas tóxicas;
- A exposição séria à radiação é muito incomum, mas ocorreu no Japão em locais de testes e reatores atômicos e também em instalações industriais;
- Histórico familiar. Aproximadamente 5% – 7% dos diagnósticos de mieloma ocorrem em um membro da família que tem um parente próximo anteriormente diagnosticado com GSMI ou mieloma.
No primeiro estágio da doença é muito difícil apresentar um sintoma, mas a medida que a doença progride os sintomas aparecem.
Separamos todos os sintomas de mieloma múltiplo. Confira e lembra-se: com saúde não se brinca!
- Dores ósseas;
- Anemia;
- Problemas renais;
- Fraturas patológicas;
- Sangue na urina;
- Frequentes infecções: podem ser um sinal que o seu sistema imunológico está comprometido.
O mieloma múltiplo é muito difícil ser diagnosticado, tanto que a maioria dos pacientes descobrem a doença em um estágio mais avançado. Isso acontece, pois os sintomas são comuns, facilmente confundidos com outras doenças, como por exemplo a hérnia de disco e problemas nas costas.
Se os sintomas sugerem que a pessoa pode estar com mieloma múltiplo, o médico poderá solicitar: exames laboratoriais como de sangue e urina, raio-x nos ossos e biópsia da medula-óssea.
Decidir se o tratamento é necessário, é a decisão inicial mais importante. Como já enfatizado, o teste basal, estadiamento e classificação prognóstica são essenciais. O tratamento é recomendado para o mieloma ativo ou sintomático e para a doença indolente que atende novos critérios de “altíssimo risco”. A urgência do tratamento depende dos problemas exatos enfrentados por um paciente individual.
O estágio inicial é chamado de Gamopatia Monoclonal de Significância Indeterminada (GSMI). Isto não é um câncer. Em GSMI, as células do mieloma constituem menos de 10% das células da medula óssea. O risco de transição de GSMI para mieloma ativo é muito baixo: apenas uma chance de 1% a cada ano de acompanhamento. Mesmo se as células do mieloma estiverem em um nível maior, de 10% – 60% do total da medula óssea, a taxa de crescimento pode ser muito lenta e representa o mieloma múltiplo assintomático (MMI). GSMI e MMI de “baixo risco” podem mudar, muito lentamente, durante um período de anos e não requer tratamento ativo.
O mieloma múltiplo assintomático de baixo risco não é nem GMSI, nem MMI de alto risco. É muito importante estabelecer o diagnóstico correto, distinguindo GMSI e MMI do mieloma ativo, ou inicial ativo, que requer tratamento.
- O que é?
-
O mieloma múltiplo é um câncer da medula óssea muito mais comum do que imaginamos. Ao contrário da maioria dos cânceres, ele não se apresenta como um tumor maciço ou nódulo, ao invés disso, as células de mieloma estão espalhadas na medula óssea. Em alguns casos, as células de mieloma se acumulam lentamente na medula óssea.
O mieloma é literalmente um “oma” ou tumor, envolvendo o “mielo,” ou células produtoras de sangue na medula óssea. As células que são afetadas são os plasmócitos (um tipo de célula branca, leucócito), que são as nossas células produtoras de anticorpos (produtoras de imunoglobulina). Uma célula do plasma maligna ou cancerosa é chamada de célula de mieloma. Mieloma é chamado “múltiplo”, já que existem, frequentemente, múltiplas porções ou áreas no osso em que ele cresce. O mieloma pode aparecer como um tumor e/ou uma área de perda óssea. Em qualquer um dos casos, o tumor ou ‘buraco’ no osso é chamado de “lesão”. As áreas de perda óssea causadas pelo mieloma são mencionadas como “lesões líticas”. O único momento em que o mieloma não é “múltiplo” é no caso raro de um “plasmocitoma solitário”, um único tumor de mieloma que pode aparecer dentro ou fora da medula óssea.
- Fatores de Risco
-
Existem alguns fatores de risco que podem causar o mieloma ou desencadear uma população de células já anormais ou pré-mieloma danificadas na medula óssea.
São eles:
- Exposição a substâncias químicas tóxicas;
- A exposição séria à radiação é muito incomum, mas ocorreu no Japão em locais de testes e reatores atômicos e também em instalações industriais;
- Histórico familiar. Aproximadamente 5% – 7% dos diagnósticos de mieloma ocorrem em um membro da família que tem um parente próximo anteriormente diagnosticado com GSMI ou mieloma.
- Sintomas
-
No primeiro estágio da doença é muito difícil apresentar um sintoma, mas a medida que a doença progride os sintomas aparecem.
Separamos todos os sintomas de mieloma múltiplo. Confira e lembra-se: com saúde não se brinca!
- Dores ósseas;
- Anemia;
- Problemas renais;
- Fraturas patológicas;
- Sangue na urina;
- Frequentes infecções: podem ser um sinal que o seu sistema imunológico está comprometido.
- Diagnóstico
-
O mieloma múltiplo é muito difícil ser diagnosticado, tanto que a maioria dos pacientes descobrem a doença em um estágio mais avançado. Isso acontece, pois os sintomas são comuns, facilmente confundidos com outras doenças, como por exemplo a hérnia de disco e problemas nas costas.
Se os sintomas sugerem que a pessoa pode estar com mieloma múltiplo, o médico poderá solicitar: exames laboratoriais como de sangue e urina, raio-x nos ossos e biópsia da medula-óssea.
- Tratamento
-
Decidir se o tratamento é necessário, é a decisão inicial mais importante. Como já enfatizado, o teste basal, estadiamento e classificação prognóstica são essenciais. O tratamento é recomendado para o mieloma ativo ou sintomático e para a doença indolente que atende novos critérios de “altíssimo risco”. A urgência do tratamento depende dos problemas exatos enfrentados por um paciente individual.
- Estadiamento
-
O estágio inicial é chamado de Gamopatia Monoclonal de Significância Indeterminada (GSMI). Isto não é um câncer. Em GSMI, as células do mieloma constituem menos de 10% das células da medula óssea. O risco de transição de GSMI para mieloma ativo é muito baixo: apenas uma chance de 1% a cada ano de acompanhamento. Mesmo se as células do mieloma estiverem em um nível maior, de 10% – 60% do total da medula óssea, a taxa de crescimento pode ser muito lenta e representa o mieloma múltiplo assintomático (MMI). GSMI e MMI de “baixo risco” podem mudar, muito lentamente, durante um período de anos e não requer tratamento ativo.
O mieloma múltiplo assintomático de baixo risco não é nem GMSI, nem MMI de alto risco. É muito importante estabelecer o diagnóstico correto, distinguindo GMSI e MMI do mieloma ativo, ou inicial ativo, que requer tratamento.
Mais informações acesse o site da International Myeloma Foundation Latin America – IMF Latin America ou ligue para ligue para 0800 777 0355 (IMF Latin America) e saiba tudo sobre essa doença!
Neuroblastoma é uma forma de câncer que se inicia em certos tipos de células nervosas muito primitivas encontradas em embriões ou fetos (o termo neuro refere-se a nervos, enquanto blastoma diz respeito a um câncer que afeta células imaturas ou em desenvolvimento). Este tipo de câncer ocorre em lactentes e crianças na primeira infância. Raramente, é encontrado em crianças com mais de 10 anos de idade.
Para entender o neuroblastoma, é importante conhecer algo sobre a estrutura e o funcionamento normal do sistema nervoso simpático, lugar onde estes tumores se iniciam. A seguir, um pouco sobre o Sistema Nervoso Simpático.
Neuroblastoma e o Sistema Nervoso Simpático
O sistema nervoso é formado pelo cérebro, a medula espinhal e os nervos que deles se originam e atingem todas as áreas do corpo. O sistema nervoso é essencial para pensar, sentir e movimentar-se, entre outras coisas.
Parte do sistema nervoso controla também funções do corpo, das quais raramente estamos cientes, como frequência cardíaca, respiração, pressão arterial, digestão e outras funções. Esta parte do sistema nervoso é conhecida como sistema nervoso autônomo.
O sistema nervoso simpático faz parte do sistema nervoso autônomo. Ele inclui:
• Fibras nervosas que percorrem as laterais da medula espinhal.
• Agrupamentos de células nervosas, denominados gânglios, em certos pontos ao longo do trajeto das fibras nervosas.
• Células semelhantes às nervosas, encontradas na medula (centro) das glândulas adrenais. As adrenais são pequenas glândulas assentadas sobre a parte superior de cada rim. Estas glândulas produzem hormônios como a adrenalina (epinefrina).
As principais células que compõem o sistema nervoso são denominadas células nervosas ou neurônios. Estas células se comunicam com outros tipos de células no corpo ao liberarem quantidades diminutas de substâncias químicas (hormônios). Isso é importante porque as células do neuroblastoma frequentemente liberam certos hormônios que podem causar sintomas (ver a seção, “Como o neuroblastoma é diagnosticado?”).
Voltando aos neuroblastomas, são cânceres que se desenvolvem a partir de células nervosas imaturas do sistema nervoso simpático (neuroblastos simpáticos), de modo que podem ser encontrados em qualquer local ao longo deste sistema.
Um pouco mais que um terço dos neuroblastomas se inicia nas glândulas adrenais. Por volta de um terço começa em gânglios de nervos simpáticos no abdômen. A maior parte do restante tem início em gânglios simpáticos próximos à coluna vertebral, no tórax ou na pelve.
Em casos raros, é possível que um neuroblastoma tenha se espalhado de modo tão vasto que, ao ser encontrado, os médicos são incapazes de dizer exatamente o local de sua origem.
Existe um amplo espectro de comportamentos que os neuroblastomas podem adotar. Alguns são capazes de se proliferarem e disseminarem rapidamente, enquanto em outros o crescimento é lento. Às vezes, em crianças muito jovens, as células cancerosas morrem sem qualquer motivo ou o tumor desaparece por si próprio. Em outros casos, as células, algumas vezes, amadurecem sozinhas até células ganglionares normais e param de se dividir. Isso faz com que o tumor se torne um ganglioneuroma.
Outros Tumores
Nem todos os tumores do sistema nervoso autônomo na infância são malignos (cancerosos).
O ganglioneuroma é um tumor benigno (não cancerosos) formado por células ganglionares maduras e bainhas nervosas.
O ganglioneuroblastoma é um tumor que apresenta componentes malignos e benignos. O tumor contém neuroblastos (células nervosas imaturas) que são capazes de proliferar e se espalhar anormalmente, semelhantemente ao neuroblastoma, bem como regiões de tecido mais maduro que são semelhantes ao ganglioneuroma.
Os ganglioneuromas são geralmente extraídos por cirurgia e observados cuidadosamente sob um microscópio para ter certeza de que não possuem áreas de células malignas (o que o tornaria um ganglioneuroblastoma). Se o diagnóstico final for ganglioneuroma, nenhum outro tratamento é necessário. Por outro lado, ganglioneuroblastomas são tratados do mesmo modo que neuroblastomas.
Sabemos o que causa o neuroblastoma?
As causas do neuroblastoma não são completamente conhecidas. Porém, pesquisadores descobriram importantes diferenças entre células de neuroblastoma e os neuroblastos normais (células nervosas primitivas) a partir dos quais estas se desenvolvem. Encontraram também diferenças entre neuroblastomas que possivelmente respondem ao tratamento e aqueles cujo prognóstico é desfavorável (previsão). Estas diferenças (conhecidas como marcadores prognósticos) são úteis na seleção do tratamento para alguns pacientes (ver a seção, “Como é feito o estadiamento do neuroblastoma?”).
Há muitos anos, os cientistas já sabem que as células nervosas e as células da medula (centro) da glândula adrenal se desenvolvem a partir de células no feto denominadas neuroblastos. Neuroblastomas se formam quando neuroblastos fetais normais falham em se tornar células nervosas maduras ou células da medula adrenal. Ao invés, continuam a proliferar e se dividir.
Os neuroblastos podem não estar completamente amadurecidos em bebês quando estes nascem. De fato, estudos mostraram que existem pequenos agrupamentos de neuroblastos nas glândulas adrenais de alguns lactentes com menos de 3 meses de idade. A maioria destes eventualmente amadurece e se transforma em células nervosas ou simplesmente desaparece e não forma neuroblastomas. Algumas vezes, os neuroblastos restantes em lactentes muito jovens continuam a crescer e então formam tumores e podem até mesmo se disseminar para outras partes do corpo. Porém, muitos destes tumores ainda amadurecerão eventualmente e se transformarão em tecido nervoso ou desaparecerão sozinhos.
No entanto, à medida que a criança envelhece, torna-se menos provável que estas células amadureçam e é mais possível que continuem a se proliferar, dando origem a um câncer. No momento em que os neuroblastomas estão suficientemente grandes para serem percebidos ou causarem sintomas, a maioria não consegue mais amadurecer por si mesmo e crescerá e se espalhará a menos que tratada.
A incapacidade para amadurecer e parar de crescer deve-se ao DNA anormal nos neuroblastos. O DNA é a substância química em cada uma de nossas células que constitui nossos genes – as instruções para o modo como nossas células funcionam. O DNA é encontrado no núcleo (centro de controle) de cada célula, em estruturas longas semelhantes a fios denominadas cromossomos. Nós geralmente nos parecemos com nossos pais porque eles são a origem de nosso DNA, porém, o DNA afeta mais do que como aparentamos. O DNA pode influenciar também nosso risco de desenvolver certas doenças, tal como alguns tipos de câncer.
Alguns genes contêm instruções para controlar quando nossas células crescem, dividem-se e morrem. Certos genes que aceleram a divisão celular são denominados oncogenes. Outros que retardam a divisão celular ou que fazem com que as células morram no momento certo são denominados genes supressores de tumor. Cânceres podem ser causados por alterações no DNA que ativam oncogenes ou que desativam genes supressores de tumor.
Na maioria dos casos, alguns dos cromossomos em células do neuroblastoma apresentam alterações que provavelmente afetam certos genes. Os cientistas ainda estão tentando determinar quais genes são afetados por estas alterações cromossômicas, bem como o modo que estas alterações poderiam afetar o crescimento de células do neuroblastoma.
Algumas pessoas que desenvolvem câncer apresentam mutações no DNA que herdaram de um dos pais e que aumentam seu risco para a doença. Em casos raros, o neuroblastoma parece ser devido a alterações em genes herdadas. Alterações herdadas no oncogene ALK parecem ser responsáveis pela maioria dos casos de neuroblastoma hereditário. Um número pequeno de neuroblastomas herdados é causado por alterações no PHOX2B, um gene que normalmente ajuda células nervosas a amadurecerem.
Ainda, a maior parte dos neuroblastomas não é causada por alterações herdadas no DNA. Estes são o resultado de alterações em genes adquiridas precocemente no desenvolvimento da criança. Estas alterações estão presentes somente nas células cancerosas da criança, de modo que não serão transmitidas para seus filhos. Os genes exatos afetados não são conhecidos na maioria dos casos.
Algumas alterações gênicas podem afetar a rapidez com a qual um neuroblastoma provavelmente crescerá. Por exemplo, células de neuroblastoma contêm às vezes cópias extras de um oncogene denominado MYCN, que é frequentemente um sinal de que o tumor crescerá rapidamente. Por outro lado, o gene NTRK1 (que produz a proteína TrkA) é muitas vezes superativo em células de neuroblastoma, o que significa um prognóstico favorável.
Pesquisadores descobriram algumas das alterações gênicas que podem levar ao neuroblastoma, mas ainda não está claro o que poderia causar estas alterações. Algumas alterações gênicas podem ser herdadas. Algumas podem ter causas externas que ainda não são conhecidas, mas outras podem ser apenas um evento aleatório que às vezes ocorre no interior de uma célula, sem que tenha uma causa externa. No momento, ainda não são conhecidas causas de neuroblastoma que sejam associadas ao estilo de vida ou ao ambiente, de modo que é importante lembrar que não há nada que estas crianças ou seus pais pudessem ter feito para impedir a ocorrência deste câncer.
Quais são os fatores de risco para neuroblastoma?
Fator de risco é algo que afeta sua chance de adquirir uma doença, como o câncer. Diferentes tipos de câncer apresentam diferentes fatores de risco.
Fatores de risco associados ao estilo de vida, como dieta, peso corporal, atividade física e tabagismo desempenham um importante papel em muitos tipos de câncer no adulto. Porém, estes fatores geralmente levam muitos anos para influenciar o risco de câncer, e não se acredita que participem tanto em cânceres na infância, incluindo neuroblastomas.
Não se conhece fatores ambientais (como exposições durante a gestação da mãe ou na primeira infância) que aumentem a chance de se adquirir neuroblastoma.
Idade
O neuroblastoma é mais comum em crianças muito jovens, mas, mesmo nessa faixa etária, é ainda raro.
Hereditariedade
Em casos raros (em torno de 1% a 2% de todos os neuroblastomas), crianças podem herdar um risco aumentado de desenvolver neuroblastoma. No entanto, a grande maioria dos neuroblastomas não parece ser herdada.
Crianças com a forma familiar de neuroblastoma (aquelas com uma tendência herdada para desenvolver este câncer) geralmente vêm de famílias com um ou mais membros afetados que tiveram neuroblastoma quando lactentes. A idade média no diagnóstico de casos familiares é mais precoce do que a idade para casos esporádicos (não herdados).
Crianças com neuroblastoma familiar podem desenvolver 2 ou mais destes cânceres em diferentes órgãos (por exemplo, em ambas as glândulas adrenais ou em mais de um gânglio simpático). É importante distinguir neuroblastomas que se desenvolvem em diversos órgãos de neuroblastomas que tiveram início em um órgão e então se espalharam para outros (neuroblastomas metastáticos), pois, quando há o desenvolvimento de tumores em diversos locais, isto imediatamente sugere uma forma familiar. Metástases podem ocorrer tanto com a forma familiar quanto com a esporádica.
Grupos de Risco
Grupos de risco para o neuroblastoma
O Children’s Oncology Group (COG) faz uso dos principais fatores prognósticos discutidos na seção anterior, combinado com o estágio da doença, para formar 3 diferentes grupos de risco: baixo, intermediário e alto. Estes grupos de risco são utilizados para ajudar a predizer a probabilidade de uma criança poder ser curada. Por exemplo, uma criança no grupo de baixo risco pode frequentemente ser curada com tratamento simples, tal como apenas cirurgia. Com crianças nos grupos de risco mais alto, a chance de cura não é tão alta, de modo que tratamento mais intensivo é muitas vezes necessário.
Estes grupos de risco têm como base o conhecimento atual sobre características clínicas e biológicas do neuroblastoma e o modo como este é tratado. À medida que nova pesquisa forneça mais informações, estes grupos de riscos podem se alterar com o passar do tempo. Por exemplo, em recomendações recentes para o tratamento, o corte de idade para algumas dessas categorias foi revisado, de até 12 meses para até 18 meses (547 dias).
Baixo risco
• Todas as crianças que estão no Estágio 1
• Qualquer criança que esteja no Estágio 2A ou 2B e que tenha menos de 1 ano de idade
• Qualquer criança que esteja no Estágio 2A ou 2B, cujo câncer não tenha cópias extras do gene MYCN
Qualquer criança que esteja no Estágio 2A ou 2B, cujo câncer tenha cópias extras do gene MYCN, mas com histologia favorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer tenha histologia favorável, seja hiperdiploide (DNA em excesso) e sem cópias extras do gene MYCN
Risco intermediário
• Qualquer criança que esteja no Estágio 3, abaixo de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN e tenha histologia favorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 4, abaixo de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer não tenha cópias extras do gene MYCN e apresente ploidia normal do DNA (número de cromossomos) e/ou histologia desfavorável
Alto risco
• Qualquer criança que esteja no Estágio 2A ou 2B, acima de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN e histologia desfavorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 3, abaixo de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN, mas com histologia desfavorável
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4, abaixo de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4 e seja acima de 1 ano de idade
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer tenha cópias extras do gene MYCN
Classificação recente de grupos de risco
Tal como acontece com o sistema de estadiamento descrito na seção anterior, um sistema mais novo de classificação de grupos de risco, a classificação Internacional de Grupos de Riscos para Neuroblastoma (INRG), está sendo atualmente estudada e poderá em breve substituir o sistema acima do COG. A classificação INRG divide as crianças em 4 grupos de risco, incluindo um grupo de risco muito baixo, e possui modificações baseadas em nosso entendimento recente sobre a histologia do tumor.
Taxas de sobrevida em 5 anos do neuroblastoma com base em grupos de risco
Taxas de sobrevida representam uma maneira para obter uma ideia geral da previsão para crianças com certo tipo e estágio de câncer. Alguns pais podem querer saber sobre a estatística para crianças em situações semelhantes, mas outros podem não achar que os números ajudem, ou podem mesmo nem querer sabê-los.
A taxa de sobrevida em 5 anos refere-se ao percentual de pacientes que vivem pelo menos 5 anos depois que seu câncer é diagnosticado. Evidentemente, muitas crianças vivem por mais tempo do que 5 anos (e muitas são curadas).
Para obter taxas de sobrevida em 5 anos, os médicos precisam verificar pessoas que foram tratadas há pelo menos 5 anos. Melhoras no tratamento desde então podem resultar em previsão mais favorável para os pacientes que estão sendo diagnosticados agora com neuroblastoma.
As taxas de sobrevida frequentemente baseiam-se em resultados anteriores de grandes números de pessoas que sofreram da doença, mas não podem predizer o que acontecerá em qualquer caso individual específico. O grupo de risco do câncer de uma pessoa é importante para estimar sua previsão. Porém, muitos outros fatores podem afetar a previsão de uma pessoa, tais como sua idade, a localização do tumor e até que ponto o câncer responde ao tratamento.
Sobrevida por grupo de risco
· Grupo de baixo risco: A taxa de sobrevida em 5 anos em crianças no grupo de baixo risco é em torno de 95%.
· Grupo de risco intermediário: Em crianças no grupo de risco intermediário, a taxa de sobrevida em cinco anos é em torno de 80% a 90%.
· Grupo de alto risco: A taxa de sobrevida em 5 anos em crianças no grupo de alto risco é em torno de 30% a 50%.
Histórico Médico e Exame Físico
Se seu filho apresenta sinais e sintomas que possam sugerir um neuroblastoma, o médico vai querer obter um histórico médico completo para se inteirar mais sobre os sintomas. Um exame físico pode fornecer informações sobre sinais de um neuroblastoma ou de outros problemas de saúde. Por exemplo, o médico pode constatar pressão arterial alta em uma criança ou ser capaz de ver ou perceber uma massa anormal no corpo.
Se os sintomas e/ou os resultados do exame físico sugerirem um neuroblastoma (ou outro tumor), outros testes provavelmente serão realizados. Estes podem incluir exames de sangue e de urina, exames por imagem e biópsias. Estes exames são importantes porque muitos dos sintomas e sinais do neuroblastoma podem ser causados também por outros tipos de câncer ou por doenças não cancerosas.
PREVENÇÃO
O neuroblastoma pode ser prevenido?
O risco de muitos cânceres em adultos pode ser reduzido com certas mudanças no estilo de vida (tal como manter o peso saudável ou deixar de fumar), mas, por enquanto, não há maneiras conhecidas para prevenir a maioria dos cânceres em crianças.
Os únicos fatores de risco conhecidos para o neuroblastoma (idade e hereditariedade) não podem ser alterados. No momento, não se conhecem causas associadas ao estilo de vida ou ambientais para neuroblastomas.
Alguns estudos sugerem que a administração materna de multivitamínicos ou ácido fólico no período pré-natal poderia reduzir o risco de neuroblastoma, mas são necessárias pesquisas adicionais para confirmar essa recomendação.
Se houver histórico de neuroblastoma em sua família, você poderá desejar conversar com um geneticista sobre os riscos de seus filhos desenvolverem a doença. É importante lembrar, no entanto, que o neuroblastoma familiar é muito raro.
Sinais e sintomas
Os sinais e sintomas de neuroblastoma podem variar bastante, dependendo do tamanho e da localização do tumor original, da extensão da disseminação para outras partes do corpo e se as células tumorais secretam ou não hormônios.
Muitos dos sinais e sintomas abaixo são mais provavelmente causados por algo diferente de neuroblastoma. Ainda assim, se o seu filho tiver qualquer um destes sintomas, verifique com seu médico de modo que a causa possa ser avaliada e tratada, se necessário.
Sinais ou sintomas causados pelo tumor primário
Um dos sinais mais comuns de um neuroblastoma é a presença de uma protuberância ou massa incomum. Estas são normalmente encontradas no abdômen da criança, causando seu inchaço. A criança pode não querer comer (o que pode levar à perda do peso). Se a criança tiver idade suficiente, ele ou ela pode queixar-se de se sentir cheio ou de ter desconforto ou dor. Mas, a própria protuberância não é em geral sensível ao toque. Massas podem ocorrer também em outros locais como o pescoço.
Algumas vezes, o inchaço provocado por um tumor no abdômen pode afetar partes do corpo que não contêm câncer, especialmente as pernas e, no sexo masculino, o escroto. Isso acontece quando um tumor pressiona ou invade e obstrui os vasos sanguíneos e linfáticos, impedindo os líquidos de circularem de volta para o coração.
Em alguns casos, a pressão de um tumor em crescimento pode afetar a bexiga ou os intestinos da criança, o que pode causar problemas com a micção, diarreia ou constipação.
Se estiver localizado no tórax, o tumor pode pressionar a veia cava superior (a grande veia no tórax que faz o retorno do sangue da cabeça e pescoço para o coração). Isso pode causar inchaço na face, no pescoço, nos braços e na região superior do tórax (às vezes acompanhado por coloração vermelho-azulada da pele). Além disso, pode causar cefaleias, tonturas e uma alteração no nível da consciência se afetar o cérebro. O tumor pode pressionar também a garganta ou a traqueia, o que pode tornar difícil para a criança respirar ou deglutir.
Neuroblastomas que pressionam certos nervos no tórax ou no pescoço podem algumas vezes provocar outros sintomas, como queda palpebral e pupila pequena (a área preta no centro do olho). A pressão sobre outros nervos próximos à coluna vertebral pode afetar a capacidade da criança de sentir ou movimentar os braços ou as pernas.
Sinais ou sintomas causados pela disseminação do tumor
Cerca de dois terços dos casos de neuroblastomas já se disseminaram para outras partes do corpo no momento em que são descobertos.
O neuroblastoma frequentemente se dissemina para os ossos. Uma criança capaz de falar pode queixar-se de dor nos ossos. A dor pode ser tão grande que a criança manca ou se recusa a andar. Caso se dissemine para a coluna, os tumores podem pressionar a medula espinhal e provocar fraqueza, dormência ou paralisia nos braços ou nas pernas. A disseminação para os ossos em torno dos olhos pode levar ao aparecimento de hematoma ao redor dos olhos ou fazer com que um globo ocular se torne ligeiramente proeminente.
A presença de caroços azuis ou roxos que se assemelham a pequenas frutas silvestres (mirtilos) pode ser sinal de disseminação para a pele.
Se o câncer espalhar-se para a medula óssea (a parte interna de certos ossos que produzem células do sangue), a criança pode não ter número suficiente de células vermelhas, brancas ou plaquetas no sangue. Esses déficits de células sanguíneas podem resultar em cansaço, irritabilidade, fraqueza, infecções frequentes e sangramento excessivo de pequenos cortes ou arranhões.
Raramente, grandes tumores podem começar a se romper, levando a uma perda de fatores de coagulação no sangue. O resultado pode ser alto risco de sangramento sério, o que é conhecido como coagulopatia consumptiva e pode ser de risco à vida.
Uma forma especial do neuroblastoma de ampla disseminação (conhecida como estágio 4S) ocorre somente durante os primeiros meses de vida. Nesta forma especial, o neuroblastoma se dissemina para o fígado, para a pele e/ou para a medula óssea (em quantidades pequenas). O fígado pode tornar-se muito grande. Apesar do fato do câncer já estar disseminado quando descoberto, o neuroblastoma em estágio 4S é muito tratável (frequentemente diminuindo ou desaparecendo sozinho), e quase todas as crianças com esta forma de neuroblastoma podem ser curadas.
Sinais ou sintomas causados por hormônios provenientes do tumor
O neuroblastoma é um dos poucos tipos de câncer em crianças que libera hormônios que podem causar problemas em tecidos e órgãos distantes, embora o câncer não tenha se disseminado para estes tecidos ou órgãos. Estes problemas são denominados síndromes paraneoplásicas.
Os sintomas das síndromes paraneoplásicas podem incluir:
• Diarreia constante
• Febre
• Pressão arterial alta (causando irritabilidade)
• Frequência cardíaca acelerada
• Avermelhamento (rubor) da pele
• Sudorese
Um sintoma incomum é denominado síndrome da opsoclonia-mioclonia-ataxia ou dos “olhos e pés dançantes”. Nesta situação, a criança apresenta movimentos oculares irregulares, rápidos (opsoclonia), espasmos musculares semelhantes a torções (mioclonia) e aparenta estar sem coordenação ao ficar em pé ou andar (ataxia). Pode apresentar também dificuldade em falar. Por motivos desconhecidos, tumores de neuroblastoma que podem causar esta síndrome tendem a ser de menor risco à vida do que outras formas da doença.
Como o neuroblastoma é diagnosticado?
Neuroblastomas são em geral descobertos como resultado de sinais ou sintomas que uma criança está apresentando. Se houver suspeita de um tumor, serão necessários testes para confirmar este diagnóstico.
Diagnóstico Precoce
O neuroblastoma pode ser descoberto precocemente?
Pesquisadores têm estudado se a triagem de lactentes para neuroblastoma pode encontrar estes tumores mais precocemente e levar a melhores resultados do tratamento. A triagem é um teste para uma doença, tal como câncer, em pessoas sem sintomas. Uma maneira de triar para neuroblastoma é testar a urina da criança para certas substâncias produzidas por tumores do tipo neuroblastoma (Para maiores informações sobre este teste de urina, ver a seção “Como o neuroblastoma é diagnosticado?”).
Os estudos não concluíram que o rastreamento de neuroblastoma seja útil. O teste em lactentes quando tinham 6 meses de idade não encontrou um número maior de tumores do que o que teria sido normalmente diagnosticado. Porém, a maioria destes tumores pertencia a um tipo que provavelmente desapareceria ou amadureceria em um tumor benigno por si só e que provavelmente nunca causaria quaisquer problemas. A triagem não reduziu o número de casos encontrados em estágios avançados ou salvou vidas.
Além disso, somente a metade das crianças identificadas por testes de triagem como possivelmente tendo neuroblastoma realmente apresenta um tumor que causaria problemas sérios. Esses resultados “falso-positivos” podem assustar desnecessariamente os pais e levar a testes e cirurgias que não seriam precisos em crianças cujos tumores desapareceriam ou amadureceriam por conta própria se deixados sozinhos.
Por esses motivos, a maioria dos especialistas não recomenda a triagem para neuroblastoma em lactentes que não apresentem risco aumentado da doença.
Em situações raras, o neuroblastoma é encontrado antes do nascimento durante uma ultrassonografia, um teste que emprega ondas sonoras para criar uma imagem dos órgãos internos de um feto. Ultrassonografias são geralmente realizadas para estimar a idade de um feto, predizer a data do nascimento e procurar certos defeitos de nascimento comuns. Melhorias na tecnologia do ultrassom ou outros métodos podem levar a testes pré-natais (antes do nascimento) mais precisos para esta doença.
O neuroblastoma é às vezes encontrado acidentalmente em crianças na primeira infância sem quaisquer sintomas durante testes efetuados para descobrir outras doenças da infância. Estas crianças terão geralmente um bom resultado e algumas podem nem mesmo necessitar tratamento.
Contudo, na maioria dos casos, o neuroblastoma é detectado pela primeira vez quando causa certos sintomas que revelam que a criança está doente.
Quais são as principais estatísticas sobre neuroblastoma?
O neuroblastoma é de longe o câncer mais comum em lactentes (abaixo de 1 ano de idade). É responsável por aproximadamente 7% de todos os cânceres infantis. A idade média no momento do diagnóstico é em torno de 1 a 2 anos. Em casos raros, o neuroblastoma é detectado por ultrassom, antes mesmo do nascimento. Quase 90% dos casos são diagnosticados até os 5 anos. O neuroblastoma é extremamente raro em pessoas acima de 10 anos de idade. Em cerca de 2 em 3 casos, a doença já se espalhou (metastizou) para outras partes do corpo quando é diagnosticada.
EXAMES
Exames de Sangue e Urina
Testes de catecolaminas no sangue e na urina
O neuroblastoma pode ser frequentemente constatado pela detecção de catecolaminas no sangue ou na urina. As células nervosas simpáticas normalmente liberam hormônios denominados catecolaminas, como epinefrina (adrenalina) e norepinefrina. Eventualmente o corpo as decompõe em metabólitos (pedaços menores), que então são passados para fora do corpo na urina.
Na maioria dos casos, as células do neuroblastoma produzem catecolaminas suficientes para serem detectadas por exames de sangue ou urina. Os 2 metabólitos de catecolaminas mais frequentemente medidos são:
• Ácido homovanílico (HVA)
• Ácido vanilmandélico (VMA)
Outros exames laboratoriais
O médico de seu filho provavelmente pedirá também outros exames de sangue para verificar contagens de células do sangue, a função hepática e renal e o balanço de sais (eletrólitos) no corpo. Uma análise da urina poderá também ser efetuada para verificar a função renal.
Exames por Imagem
Os exames por imagem empregam raios-x, campos magnéticos, ondas sonoras ou substâncias radioativas para criar imagens do interior do corpo. Os exames por imagem podem ser realizados por alguns motivos, incluindo:
• Ajudar a descobrir se uma área suspeita poderia ser cancerosa
• Saber o quanto o câncer possa ter se disseminado
• Ajudar a determinar se o tratamento foi eficaz
A maioria dos pacientes com câncer ou que possam apresentar câncer será submetida a um ou mais destes exames. Pacientes com neuroblastoma são em geral muito jovens, de modo que pode ser difícil realizar alguns destes exames. Pais e equipes médicas precisam ser muito pacientes.
Radiografias
O médico pode pedir uma radiografia torácica ou de outra parte do corpo como exame inicial se uma criança estiver apresentando sintomas, mas sem que esteja claro o que poderia os estar causando. No entanto, as imagens podem não ser suficientemente detalhadas para localizar tumores.
Se o neuroblastoma já tiver sido diagnosticado, radiografias podem ser úteis para examinar se o câncer se espalhou para os ossos. Uma radiografia da cabeça poderá ser efetuada para investigar se o câncer se disseminou para os ossos cranianos. Uma cintilografia com MIBG (metaiodobenzilguanidina) ou cintilografia óssea (descrito abaixo) é geralmente melhor para examinar os ossos no resto do corpo, mas radiografias podem ser utilizadas em lactentes, quando estes exames não forem possíveis. Uma radiografia torácica padrão pode ser realizada, se médicos suspeitarem que o tumor tenha invadido os pulmões, mas uma tomografia computadorizada (TC) ou imagem por ressonância magnética (IRM) podem mostrar a área mais detalhadamente.
Exame de tomografia computadorizada (TC ou CAT)
Os exames por TC representam frequentemente o primeiro teste utilizado para buscar a presença de neuroblastoma no abdômen, na pelve e no tórax.
O exame por TC é um teste com raios-x que produz imagens detalhadas em corte transversal de partes do corpo. Em vez de obter uma única imagem, como uma radiografia regular, o aparelho de TC pode captar muitas imagens à medida que gira em torno de seu/sua filho/filha enquanto ele ou ela estão deitados em uma mesa. Um computador então combina e transforma estas imagens em outras representando fatias da parte do corpo em estudo. Diferentemente de uma radiografia regular, o exame por TC cria imagens detalhadas dos tecidos moles no corpo.
Seu filho pode ter que beber uma solução de contraste e/ou nele ser introduzido um tubo IV (intravenoso) através do qual uma tinta corante é injetada. Isso ajuda a melhorar o contorno das estruturas no corpo. O contraste pode provocar algum rubor (sensação de calor, especialmente na face). Algumas pessoas são alérgicas e apresentam urticária. Raramente, reações mais sérias, como dificuldade de respirar ou pressão arterial baixa, podem ocorrer. Certifique-se de informar ao médico se seu filho sofre de quaisquer alergias ou se já apresentou uma reação a qualquer material de contraste utilizado para radiografias.
Os exames por TC podem demorar mais do que as radiografias regulares, mas não tanto como exames de Ressonância Magnética. Seu filho precisará permanecer sem se mexer em uma mesa, enquanto estes são realizados. Durante o exame, a mesa desliza para dentro e para fora do aparelho, uma máquina em forma de anel que envolve completamente a mesa. Algumas pessoas se sentem um pouco confinadas pelo anel no qual devem permanecer enquanto as imagens estão sendo capturadas. Em alguns casos, seu filho poderá ser sedado (receber medicamento que o torna sonolento), antes do exame, para diminuir a movimentação e ajudar a ter certeza de que as imagens saíram boas.
A TC espiral (conhecida também como TC helicoidal) é utilizada agora em muitos centros médicos. Este tipo de TC emprega uma máquina mais rápida que reduz a dose de radiação e rende imagens mais detalhadas.
Biópsia com agulha guiada por TC
Os exames por TC podem ser utilizados também para guiar com precisão uma agulha de biópsia até um tumor. Para esse procedimento, o paciente permanece na mesa de exame de TC, enquanto o radiologista introduz uma agulha de biópsia através da pele e em direção à massa. Os exames por TC são repetidos até que a agulha esteja no interior da massa. Uma amostra de biópsia por agulha fina ou amostra de biópsia por agulha de calibre maior é então removida e examinada sob um microscópio. Em crianças, este procedimento é sempre efetuado com anestesia geral (em que a criança está adormecida).
Exame de imagem por ressonância magnética (IRM)
Exames de IRM fornecem imagens detalhadas de tecidos moles no corpo. Mas este tipo de exame emprega ondas de rádio e magnetos fortes, em vez de raios-x, de modo que não há radiação envolvida. A energia emitida pelas ondas de rádio é absorvida pelo corpo e então liberada em um padrão formado pelo tipo de tecido do corpo e por certas doenças. Um computador traduz o padrão em uma imagem muito detalhada de partes do corpo. Um material de contraste, denominado gadolínio, pode ser injetado em uma veia antes do exame para visualizar melhor os detalhes.
Os exames de IRM são muito úteis para examinar o cérebro e a medula espinhal. Uma IRM pode ser ligeiramente melhor do que a TC para se avaliar a extensão do neuroblastoma, especialmente em torno da coluna vertebral, mas pode ser mais difícil para a criança.
Os exames de IRM demoram mais do que os da TC, muitas vezes durante até uma hora. Na maioria das máquinas de IRM, seu filho terá que permanecer no interior de um tubo estreito, que produz uma sensação de confinamento e pode ser estressante. Máquinas de IRM mais novas e mais abertas podem representar uma opção em alguns casos, mas ainda exigem que a criança permaneça sem se mexer por longos períodos de tempo. A máquina de IRM produz também um zumbido alto e ruídos tipo estalidos que podem ser perturbadores. Crianças mais jovens frequentemente são medicadas para ajudá-las a se manterem calmas ou mesmo dormirem durante o exame.
Ultrassom
A ultrassonografia emprega ecos de ondas sonoras para produzir imagens de órgãos ou massas internas. Um instrumento semelhante a um pequeno microfone, denominado transdutor, emite ondas de som e captura os ecos à medida que estes rebatem vindos de tecidos do corpo. Os ecos são convertidos por um computador em uma imagem em branco e preto sobre uma tela de computador.
O ultrassom é um exame bastante rápido e fácil que não envolve radiação, sendo este o motivo pelo qual é frequentemente um dos primeiros exames efetuados na suspeita de uma massa interna. No exame de ultrassom, a criança simplesmente deita-se sobre uma mesa (ou os pais seguram a criança), e um técnico move o transdutor sobre pele ao longo da parte do corpo em exame. Em geral, a pele é lubrificada com um gel antes.
Às vezes, um ultrassom é utilizado para descobrir massas no abdômen (Não é utilizado para massas no tórax porque as costelas bloqueiam as ondas sonoras). Esse exame também é capaz de detectar se os rins se tornaram inchados porque o fluxo de saída de urina foi bloqueado por linfonodos aumentados ou por uma massa. O ultrassom pode ser utilizado também para guiar a penetração de agulha de biópsia em um tumor suspeito para coletar uma amostra para testes. É especialmente útil para verificar se os tumores no abdômen estão encolhendo.
Cintilografia com MIBG
Este exame emprega uma forma da substância química metaiodobenzilguanidina (MIBG) que contém uma pequena quantidade de iodo radioativo. A MIBG é semelhante à norepinefrina, um hormônio produzido por células nervosas simpáticas. É injetada em uma veia e percorre a corrente sanguínea e, na maioria dos pacientes, se fixará a células de neuroblastoma em qualquer local no corpo. Diversas horas ou dias mais tarde, o corpo é examinado com uma câmera especial para examinar áreas que capturaram a radioatividade. Isso ajuda aos médicos a dizerem onde o neuroblastoma se encontra e se este já se disseminou para os ossos e/ou outras partes do corpo.
Este exame é preferido por muitos médicos como teste padrão em crianças com neuroblastoma. Pode ser repetido após o tratamento para conferir se este foi eficaz. Além disso, é bom saber se o tumor capta a MIBG porque, em alguns casos, essa molécula radioativa pode ser utilizada (em doses mais altas) para tratar o neuroblastoma (ver a seção “Radioterapia”).
Exame de tomografia por emissão de pósitrons (PET)
Em exame PET, uma substância radioativa (geralmente um tipo de açúcar relacionado à glicose, conhecido como FDG) é injetada no corpo. A quantidade de radioatividade utilizada é muito baixa. Como as células cancerosas estão crescendo muito rápido, elas absorvem grandes quantidades de açúcar radioativo. Uma câmera especial pode então criar uma imagem de áreas de radioatividade no corpo. A imagem não é finamente detalhada como em um exame de TC ou IRM, mas ainda pode fornecer informações úteis sobre o corpo inteiro.
Algumas máquinas mais modernas são capazes de realizar exame PET e de TC ao mesmo tempo (exame PET/TC). Isso permite que o médico compare áreas de radioatividade mais alta no PET com o aspecto mais detalhado daquela área na TC.
Cintilografia óssea
Um exame ósseo pode ajudar a mostrar se um câncer já possui metástases (disseminou) nos ossos, e pode fornecer uma imagem de todo o esqueleto de uma só vez. O neuroblastoma muitas vezes provoca dano ósseo, o qual uma cintilografia óssea é capaz de encontrar. Este teste era realizado de rotina, mas em alguns centros foi substituído pelo uso de exames com MIBG ou PET.
Neste teste, uma pequena quantidade de material radioativo de baixo nível (tecnécio 99) é injetada em uma veia. A substância se acumula em áreas de osso danificado por todo o esqueleto no decorrer de umas duas horas. Seu filho, então, fica deitado sobre uma mesa por cerca de 30 minutos enquanto uma câmara especial detecta a radioatividade e cria uma imagem do esqueleto. Crianças mais jovens podem receber um medicamento que as ajuda a se manterem calmas ou mesmo dormirem durante o teste.
Áreas de alterações ósseas ativas atraem a radioatividade e aparecem como “locais quentes” no esqueleto. Estas áreas podem sugerir a presença de câncer, mas outras doenças ósseas podem causar também o mesmo padrão. Para distinguir entre essas condições, outros exames de imagem, como radiografias planas ou exames de IRM, ou mesmo uma biópsia óssea poderia ser necessária.
Biópsias
Sinais e sintomas, testes laboratoriais e exames de imagem podem sugerir fortemente um neuroblastoma, mas uma biópsia (retirada de parte do tumor para visualização sob um microscópio e outros testes laboratoriais) é a única maneira para se ter certeza.
Durante uma biópsia, o médico retira uma amostra da massa tumoral. Em adultos, as biópsias são às vezes efetuadas com anestésico local (medicamento que adormece a área), mas em crianças, são mais frequentemente realizadas enquanto a criança está sob o efeito de anestesia geral (dormindo). Existem 2 principais tipos de biópsias:
• Biópsia incisional (aberta): Este tipo de biópsia é realizado cortando e retirando um pedaço do tumor através de uma abertura na pele.
• Biópsia com agulha (fechada): Para este tipo de biópsia, uma agulha oca é posicionada através da pele e para dentro do tumor. Se o tumor for profundo dentro do corpo, exames de TC ou por ultrassom podem ser utilizados para guiar a penetração da agulha no tumor.
As amostras da biópsia são então visualizadas sob um microscópio por um patologista.
Alguns casos de neuroblastoma são facilmente reconhecidos quando examinados por médicos com experiência em testar amostras de tumores infantis. Porém, em alguns casos, pode ser difícil a diferenciação entre outros tipos de câncer na infância.
Nessas situações, testes especiais, como imunohistoquímica, precisam ser realizados. Para este teste, uma parte da amostra é tratada com proteínas especiais (anticorpos) que se fixam a substâncias em células de neuroblastoma, mas não de outros cânceres. Substâncias químicas (corantes) são então adicionadas de modo que células contendo estas substâncias mudem de cor e possam ser facilmente vistas sob um microscópio. Isso permite que o patologista saiba que o tumor é um neuroblastoma.
Outros tipos de testes laboratoriais podem ser realizados também em amostras de neuroblastoma para ajudar a determinar a velocidade com a qual o tumor provavelmente crescerá. Alguns destes estão descritos na seção, “Como é feito o estadiamento do neuroblastoma?”.
Aspiração e biópsia de medula óssea
O neuroblastoma muitas vezes se dissemina para a medula óssea (as partes internas esponjosas de certos ossos). Se os níveis sanguíneos ou urinários de catecolaminas estiverem aumentados, então o achado de células cancerosas em uma amostra de medula óssea é suficiente para diagnosticar neuroblastoma (sem obter uma biópsia do tumor principal). Se o neuroblastoma já tiver sido diagnosticado por uma biópsia efetuada em outro local no corpo, o teste na medula óssea é realizado para ajudar a determinar a extensão da doença.
Aspiração e biópsia da medula óssea são realizados geralmente ao mesmo tempo. Na maioria dos casos, as amostras são coletadas da parte posterior de ambos os ossos pélvicos (do quadril).
Para uma aspiração de medula óssea, a criança deita-se sobre uma mesa (sobre o lado ou o abdômen). Depois da limpeza da pele que recobre o quadril, o médico adormece a área e a superfície com anestésico local, o que pode provocar uma picada ou sensação de ardor de curta duração. Mesmo com o anestésico local, a maioria dos pacientes ainda sente alguma dor momentânea quando a medula é retirada. Na maioria dos casos, a criança recebe também outros medicamentos para reduzir a dor ou mesmo para dormir durante o procedimento. Uma agulha oca e fina é então inserida dentro do osso e uma seringa é usada para sugar uma pequena quantidade se medula óssea líquida;
Uma biópsia da medula óssea é geralmente realizada logo depois da aspiração. Um pequeno pedaço de osso e de medula é retirado com uma agulha ligeiramente mais larga, que é torcida enquanto empurrada para penetrar no osso. A biópsia pode causar também alguma rápida dor. Uma vez realizada a biópsia, é aplicada pressão ao local para ajudar a parar qualquer sangramento.
Amostras da medula óssea são enviadas para um laboratório de patologia, onde serão examinadas e testadas quanto à presença de células cancerosas.
MARCADORES DE PROGNÓSTICO
Marcadores prognósticos são características específicas que ajudam a predizer se a previsão de cura da criança é melhor ou pior do que seria prevista apenas pelo estágio. Os marcadores abaixo são empregados para determinar o prognóstico de uma criança.
Histologia do tumor
A histologia do tumor é baseada em como as células do neuroblastoma se parecem sob o microscópico. Tumores que contenham um número maior de células e tecidos com aparência normais tendem a ter melhores prognósticos e são considerados como tendo histologia favorável. Tumores cujas células e tecidos aparentem mais anormais sob um microscópico tendem a ter prognóstico mais desfavorável e são identificados como portadores de histologia desfavorável.
Idade
Crianças mais jovens (abaixo de 12-18 meses) são mais prováveis de serem curadas do que crianças de mais idade.
Ploidia do DNA
A quantidade de DNA em cada célula, conhecida como ploidia, pode ser medida por técnicas laboratoriais especiais, como citometria de fluxo e citometria de imagem. Células de neuroblastoma com aproximadamente a mesma quantidade de DNA que células normais são classificadas como diploides. Células com quantidades aumentadas de DNA são denominadas hiperdiploides.
Em lactentes, células hiperdiploides tendem a ser associadas com estágios mais precoces da doença, respondem melhor à quimioterapia e geralmente predizem um prognóstico (resultado) mais favorável do que células diploides.
Amplificações do gene MYCN
MYCN é um oncogene, um gene que é importante para regulação do crescimento celular. Alterações destes genes podem fazer com as células cresçam e se dividam muito rapidamente, tal como ocorre com células cancerosas.
Pesquisadores descobriram que neuroblastomas com cópias demais (amplificação) do oncogene MYCN tendem a crescer mais rapidamente e são menos propensos ao amadurecimento. O prognóstico de crianças cujos neuroblastomas apresentam esta característica tende a ser pior do que o de outras crianças com neuroblastoma.
Outros marcadores
Estes marcadores não são utilizados para ajudar a determinar grupos de risco neste momento (ver abaixo), mas ainda são importantes e podem influenciar a decisão médica sobre o modo de tratamento de uma criança com neuroblastoma.
Citogenética: Neste teste laboratorial, o número de cromossomos em cada célula é contado sob um microscópio, e as anormalidades cromossômicas são descritas. Células normais possuem 46 cromossomos (2 conjuntos de 23), os quais são formados por DNA e proteína. Neuroblastomas com números normais de cromossomos tendem a crescer e se espalhar mais rapidamente do que aqueles com cromossomos extras.
Células que têm certas partes dos cromossomos 1 ou 11 faltando (conhecidas como deleções 1p ou deleções 11q), também podem predizer um prognóstico menos favorável. Acredita-se que estas partes de cromossomos, que estão ausentes em muitos pacientes com neuroblastoma, possam conter importantes genes supressores de tumor, porém mais estudos são necessários para confirmar esse dado.
Ter uma parte extra do cromossomo 17 (ganho 17q) também está vinculado a um pior prognóstico. Isso provavelmente significa que existe um oncogene nesta parte do cromossomo 17.
Compreender a importância de deleções/ganhos em cromossomos é uma área ativa da pesquisa sobre neuroblastomas.
Receptores de neurotrofinas (fator de crescimento neural): Estas substâncias estão presentes sobre a superfície de células nervosas normais e em algumas células de neuroblastoma. Elas normalmente permitem que as células reconheçam neurotrofinas – substâncias químicas semelhantes a hormônios que ajudam as células normais a amadurecerem.
Neuroblastomas que contenham mais de certos receptores de neurotrofinas, especialmente o receptor de crescimento neural denominado TrkA, podem ter melhor prognóstico.
Marcadores séricos: Níveis séricos (do sangue) de certas substâncias podem ser utilizados para ajudar a predizer o prognóstico.
Células de neuroblastoma liberam ferritina, uma substância química que integra de modo importante o metabolismo normal do ferro no corpo, no sangue. Pacientes com altos níveis de ferritina tendem a ter pior prognóstico.
Enolase neuronal específica (NSE) e desidrogenase láctica (LDH) são produzidas por diversos tipos de células normais, bem como por células do neuroblastoma. Níveis elevados de NSE e LDH no sangue são muitas vezes associados com pior previsão em crianças com neuroblastoma.
Uma substância na superfície de muitas células nervosas, conhecida como gangliosídeo GD2, está frequentemente aumentada no sangue de pacientes com neuroblastoma. Embora a utilidade de GD2 para predizer prognósticos seja desconhecida, este pode vir a ser mais útil em tratar o neuroblastoma (ver a seção, “Quais são as novidades na pesquisa e no tratamento do neuroblastoma?”).
Como o neuroblastoma é tratado?
Estas informações representam as opiniões dos médicos e enfermeiros que atuam no Conselho Editorial do Banco de Dados de Informação sobre Câncer da American Cancer Society. Estas opiniões estão fundamentadas na interpretação que fazem de estudos publicados em periódicos médicos, bem como em sua própria experiência profissional.
As informações sobre o tratamento neste documento não se destinam a ser orientação médica que substitua a especialização e o juízo de sua equipe para o tratamento de câncer. A intenção pretendida é ajudar você e a sua família na tomada de decisões esclarecidas, junto com seu médico.
Seu médico pode ter motivos para sugerir um plano de tratamento diferente destas opções terapêuticas gerais. Não hesite em lhe fazer perguntas sobre suas opções de tratamento.
Tratar neuroblastoma é complexo e muitas vezes requer o conhecimento específico de diferentes médicos, enfermeiros e de outros profissionais de saúde. Oncologistas pediátricos, cirurgiões, radio-oncologistas e enfermeiros com especialização em oncologia se reunirão para planejar o tratamento mais eficaz.
A abordagem para o tratamento de neuroblastoma depende do estágio do câncer, da idade da criança e de outros fatores, como os marcadores prognósticos citados previamente. Os tipos de tratamento utilizados podem incluir:
• Cirurgia
• Quimioterapia
• Terapia com retinoides
• Radioterapia
• Quimioterapia/radioterapia em alta dose e transplante de células-tronco
• Imunoterapia
Em muitos casos, mais de um tipo de tratamento é necessário.
As poucas seções seguintes descrevem os tipos de tratamento utilizados para neuroblastomas. A esta se segue uma discussão sobre quando estes tratamentos são utilizados em diferentes situações.
Biópsia cirúrgica (aberta)
Antes que o tratamento se inicie, os médicos podem efetuar uma biópsia cirúrgica para retirar amostras do tumor a serem examinadas sob um microscópico e para outros testes laboratoriais. Se o tumor estiver situado no abdômen, o cirurgião poderá efetuar a biópsia com o auxílio de um laparoscópio. Este instrumento é um tubo fino e longo com uma câmara de vídeo diminuta na extremidade. É inserido no abdômen através de uma pequena incisão para permitir ao cirurgião visualizar o interior. O cirurgião faz então uma segunda pequena incisão para atingir o interior do abdômen com instrumentos finos e longos e retirar um pequeno pedaço de tumor.
Cirurgia
A cirurgia pode ser utilizada tanto para diagnosticar como para tratar o neuroblastoma. Para tumores menores que não se disseminaram, a cirurgia é frequentemente o único tratamento que é necessário.
Cirurgia como tratamento
Depois que o neuroblastoma é diagnosticado, a cirurgia é muitas vezes utilizada para tentar remover tanto tumor quanto possível. Em alguns casos, a cirurgia consegue retirar o tumor inteiro e levar à cura.
Durante a operação, o cirurgião cuidadosamente procura por sinais de disseminação do tumor para outros órgãos. Linfonodos próximos (pequenas coleções de células do sistema imune para as quais com frequência o tumor primeiro se espalha) são retirados e examinados sob um microscópico para detectar células cancerosas.
Se possível, o cirurgião removerá o tumor inteiro. Isso é menos provável ser possível se o tumor estiver próximo de estruturas vitais ou envolvido em torno de grandes vasos sanguíneos. Mesmo se o tumor não puder ser completamente extraído, o tratamento com quimioterapia (e às vezes radioterapia), depois da retirada da maior parte do câncer, pode resultar em cura. Algumas vezes, a cirurgia é repetida depois de outros tratamentos (quimioterapia e/ou radioterapia) para verificar os resultados da terapia e para retirar qualquer câncer restante se possível. Se o tumor for muito grande, quimioterapia pode ser empregada antes da cirurgia. Com isso, o tumor pode retrair-se e facilitar a sua remoção completa.
Possíveis riscos e efeitos colaterais da cirurgia
Tal como acontece com todas as formas de tratamento, a cirurgia acarreta alguns riscos de complicações. Estas dependem da localização e da extensão da operação e da saúde prévia da criança. Complicações sérias, embora raras, podem incluir problemas com a anestesia, sangramento excessivo, infecções na ferida e dano a vasos sanguíneos, rins, outros órgãos ou a nervos. A maioria das crianças sentirá alguma dor por um tempo após a operação, mas isso pode em geral ser rapidamente ajudado com medicamentos se necessários.
Imunoterapia
Anticorpos monoclonais são versões produzidas pelo homem de proteínas do sistema imune, cuja produção pode ser direcionada para atacar um alvo muito específico. Essas moléculas podem ser injetadas no sangue para buscar e atacar células cancerosas.
Um anticorpo monoclonal, denominado ch.14.18, foi desenvolvido para atacar o gangliosídeo GD2, uma substância encontrada na superfície de muitas células de neuroblastoma. Este anticorpo é administrado muitas vezes junto com citocinas (hormônios do sistema imune), como GM-CSF e interleucina-2 (IL-2). Essa combinação pode ajudar o sistema imune de seu filho a reconhecer e destruir células do neuroblastoma.
Este anticorpo faz parte agora do tratamento de rotina para muitas crianças com neuroblastoma de alto risco, frequentemente depois de um transplante de células-tronco.
Possíveis efeitos colaterais
Os efeitos colaterais de ch.14.18 podem incluir dor neuropática, extravasamento de líquido no corpo (que pode leva abaixar a pressão arterial, acelerar a frequência cardíaca, dificultar a respiração e provocar inchaço) e reações alérgicas.
Quimioterapia
A quimioterapia emprega medicamentos contra câncer, geralmente administrados na veia (intravenoso). Os medicamentos penetram na corrente sanguínea e circulam por todo o corpo para atingir e destruir as células de câncer. Isso torna a quimioterapia útil para tratar neuroblastoma que tenha se disseminado para os linfonodos, a medula óssea, o fígado, os pulmões ou outros órgãos.
Algumas crianças com neuroblastoma são tratadas com quimioterapia, administrada antes da cirurgia (quimioterapia neoadjuvante) ou depois da cirurgia (quimioterapia adjuvante). Em outros casos, especialmente quando o câncer já se espalhou demais para ser completamente removido por cirurgia, a quimioterapia é o principal tratamento.
A maioria das crianças com neuroblastoma necessitará se submeter à quimioterapia. Na maior parte dos casos, diversos medicamentos são fornecidos. Os principais medicamentos utilizados para tratar crianças com neuroblastoma incluem:
• Ciclofosfamida ou ifosfamida
• Cisplatina ou carboplatina
• Vincristina
• Doxorrubicina (Adriamicina)
• Etoposídeo
• Topotecano
A combinação mais comum de medicamentos para tratar neuroblastoma consiste em carboplatina (ou cisplatina), ciclofosfamida, doxorrubicina e etoposídeo, mas outros podem ser utilizados. Para crianças no grupo de alto risco, combinações maiores de medicamentos são utilizadas, e suas doses são mais altas, e que podem ser seguidas por transplante de células-tronco (este procedimento está descrito mais adiante).
Os médicos administram a quimioterapia em ciclos, o que consiste em tratamento em uns poucos dias consecutivos, seguido por um período de tempo sem tratamento para permitir que o corpo se recupere. Os ciclos são tipicamente repetidos a cada 3 ou 4 semanas. A duração total do tratamento depende do grupo de risco ao qual a criança pertence – grupos de risco mais alto requerem em geral tratamento mais longo.
Possíveis efeitos colaterais da quimioterapia
Medicamentos quimioterápicos atuam atacando células em rápida divisão, sendo este o motivo porque atuam contra células cancerosas. Porém, outras células no corpo, como aquelas presentes na medula óssea, no revestimento da boca e dos intestinos e os folículos pilosos, também se dividem rapidamente. Estas células provavelmente serão também afetadas pela quimioterapia, o que leva a efeitos colaterais.
Crianças parecem ter vantagem sobre adultos no que diz respeito à quimioterapia. Os efeitos colaterais que sofrem tendem a ser menos graves e sua recuperação, mais rápida. Um benefício resultante é que os médicos podem administrar doses altas de quimioterapia, necessárias para eliminar o tumor.
Os efeitos colaterais da quimioterapia dependem do tipo e da dose de medicamentos e da duração de tempo na qual são tomados. Efeitos colaterais gerais de medicamentos quimioterápicos podem incluir:
• Queda de cabelo
• Feridas na boca
• Perda de apetite
• Náusea e vômitos
• Diarreia
• Maior chance de sofrer infecções (que se deve a baixas contagens de leucócitos)
• Facilidade em se machucar e sangrar
• Fadiga (que se deve a baixas contagens de hemácias)
A maioria destes efeitos colaterais é de curta duração e tende a desaparecer depois que o tratamento é finalizado. Com frequência, existem maneiras para diminuir estes efeitos colaterais. Por exemplo, podem ser fornecidos medicamentos que ajudem a prevenir ou a reduzir a náusea e os vômitos. Certifique-se de discutir quaisquer dúvidas que tenha sobre efeitos colaterais com a equipe de tratamento do câncer.
Junto com os efeitos listados acima, alguns outros são específicos de certos medicamentos:
Ciclofosfamida e ifosfamida podem provocar lesões na bexiga. Essa ocorrência pode ser evitada ou minimizada administrando estes medicamentos com bastante líquido e incluindo um medicamento denominado mesna, que ajuda a proteger a bexiga. Estes medicamentos são capazes também de danificar os ovários ou os testículos e podem afetar a fertilidade (a capacidade de procriar).
Doxorrubicina pode causar lesão ao coração. Os médicos tentam reduzir esse risco tanto quanto possível ao não administrarem mais do que as doses recomendadas de doxorrubicina e verificando o coração com um exame denominado ecocardiograma (um ultrassom do coração) durante o tratamento. Este medicamento pode provocar também lesão na pele se extravasar da veia durante a administração.
Cisplatina e carboplatina podem afetar os rins. Fornecer bastante líquido pode ajudar a reduzir esse risco. Estes medicamentos podem afetar também a audição em alguns casos. Esse problema pode ser verificado pelo médico de seu filho com testes de audição (audiogramas) durante ou depois do tratamento.
Vincristina pode provocar lesões nos nervos. Alguns pacientes podem sentir formigamento e dormência, especialmente nas mãos e nos pés.
Em alguns casos, a quimioterapia pode ter também efeitos colaterais em prazo mais longo. Por exemplo, alguns medicamentos utilizados para tratar neuroblastoma podem aumentar o risco do desenvolvimento mais tardio de leucemia mieloide aguda (LMA), um tipo câncer do sangue. Embora seja sério, este risco não é comum, e a importância da quimioterapia no tratamento do neuroblastoma supera de longe este risco. Para mais informações sobre os possíveis efeitos do tratamento em longo prazo, ver a seção “O que acontece depois do tratamento para o neuroblastoma?”
Quimioterapia/Radioterapia
Quimioterapia/radioterapia em altas doses e transplante de células-tronco para neuroblastoma
Este tipo de tratamento é frequentemente utilizado em crianças com neuroblastoma de alto risco, que provavelmente não serão curadas com outros tratamentos. Este tratamento envolve administrar altas doses de quimioterapia (mais altas do que poderiam ser fornecidas com segurança de outra forma) e/ou de radioterapia (irradiação de corpo inteiro ou MIBG em alta dose) e, em seguida, repor as células da medula óssea do corpo, que foram mortas pelo tratamento. No passado, este tipo de tratamento era comumente designado transplante de medula óssea.
A medula óssea é a parte interna esponjosa de alguns ossos, onde novas células vermelhas, brancas e plaquetas são formados. As células vermelhas transportam oxigênio para todas as partes do corpo. As células brancas fazem parte do sistema imune, que combate as infecções. As plaquetas são necessárias para interromper o sangramento causado por cortes e arranhões.
A quimioterapia e alguns tipos de radiação podem afetar células-tronco formadoras de sangue na medula óssea (Estas são as células que produzem os diferentes tipos de células sanguíneas). Embora possam ser mais eficazes em tratar tumores, os tratamentos mais intensos não podem ser fornecidos, pois poderiam causar dano grave à medula óssea, levando a déficits de células sanguíneas que acarretam risco à vida.
Os médicos tentam contornar este problema, administrando à criança uma infusão de células-tronco formadoras de sangue depois do tratamento. Este procedimento é conhecido como transplante de células-tronco do sangue periférico (PBSCT).
O que o procedimento envolve
A primeira etapa em um PBSCT é coletar, ou “colher”, as células-tronco produtoras de sangue da própria criança para utilizar mais tarde. No passado, as células-tronco eram frequentemente coletadas da medula óssea da criança, o que exigia perfurar pequenos orifícios em certos ossos. Contudo, os médicos descobriram que células-tronco podem ser coletadas da corrente sanguínea durante um procedimento conhecido como aférese. O procedimento é semelhante a doar sangue, mas em vez do sangue ir para uma bolsa coletora, via para uma máquina especial que filtra e retira as células-tronco e devolve as outras partes do sangue de volta para o corpo da pessoa. Esse processo pode ser repetido durante alguns dias. As células-tronco são então congeladas até o transplante.
Depois das células-tronco terem sido coletadas, a criança recebe quimioterapia em alta dose. Isso destrói as células cancerosas no corpo, mas também as células normais na medula óssea. Quando o tratamento é concluído, as células-tronco do paciente são descongeladas e devolvidas para o corpo em um processo semelhante a uma transfusão normal de sangue. As células-tronco viajam através da corrente sanguínea e se alojam na medula óssea. Durante as 3 ou 4 semanas seguintes, as células-tronco começam a produzir novas células sanguíneas sadias na medula óssea.
Até que isso ocorra, a criança está em alto risco de infecção por apresentar baixa contagem de leucócitos, bem como de sangramento por baixa contagem de plaquetas. Medidas de proteção são adotadas, para evitar a ocorrência de infecções, como filtros de ar especiais no quarto de hospital e fazer com que os visitantes vistam roupas protetoras. Transfusões de sangue e de plaquetas e tratamento com antibióticos IV podem ser utilizados também para ajudar a prevenir ou tratar infecções ou problemas de sangramento.
Os pacientes geralmente permanecem no hospital em isolamento visando proteção (vigilância contra a exposição a germes), até que parte de sua contagem de células brancas (conhecida como a contagem absoluta de neutrófilos ou CAN) se eleve para acima de 500. A alta do hospital pode ser permitida quando a contagem absoluta de neutrófilos estiver próxima de 1.000. A criança é então acompanhada em uma clínica ambulatorial quase todos os dias por muitas semanas. As contagens de plaquetas muitas vezes demoram mais para retornarem a um nível seguro, portanto, as transfusões de plaquetas podem ser administradas no acompanhamento ambulatorial.
O transplante de células-tronco é um tratamento complexo. Se o médico considerar que seu filho possa se beneficiar de um transplante, o melhor lugar a ser realizado é em um centro de câncer reconhecido nacionalmente, onde a equipe possui experiência em realizar o procedimento e controlar o período de recuperação.
Possíveis efeitos colaterais
Possíveis complicações e efeitos colaterais precoces podem ser sérios e são basicamente os mesmos que os causados por quimioterapia (ver a seção “Quimioterapia” deste documento) ou radioterapia em alta dose. Os efeitos colaterais devem-se ao dano à medula óssea e a outros tecidos do corpo que se dividem rapidamente. Estes efeitos podem incluir baixas contagens de células sanguíneas (acompanhadas por cansaço e risco aumentado de infecção e sangramento), náusea, vômitos, perda de apetite, feridas na boca e queda de cabelos, entre outros.
Um dos efeitos imediatos mais comuns e sérios é maior risco de infecção. Antibióticos são frequentemente administrados para tentar prevenir essa ocorrência. Outros efeitos colaterais, como baixa contagem de hemácias e de plaquetas, podem exigir transfusões de derivados do sangue ou outros tratamentos.
Algumas complicações e efeitos colaterais podem persistir por longo tempo ou podem não ocorrer até anos depois do transplante. Por exemplo, o tratamento pode afetar o desenvolvimento ósseo, a fertilidade ou níveis hormonais, e pode aumentar o risco de desenvolver outro câncer mais tarde na vida. Certifique-se de conversar com o médico de seu filho antes do transplante para informar-se sobre possíveis efeitos tardios que seu filho pode apresentar.
Radioterapia
A radioterapia emprega raios ou partículas de alta energia para eliminar as células cancerosas. A radiação é, às vezes, uma parte necessária do tratamento, mas em virtude dos possíveis efeitos colaterais tardios em crianças, é evitada quando possível. Dois tipos de radioterapia podem ser utilizados para tratar crianças com neuroblastoma.
– Radioterapia por feixe externo
Este tipo de radioterapia focaliza a radiação sobre o câncer a partir de uma fonte fora do corpo. Existem diversas situações nas quais este tipo de radioterapia poderia ser utilizado:
• Para destruir células do neuroblastoma que permanecem depois da cirurgia e quimioterapia
• Para tentar reduzir o tamanho do tumor antes da cirurgia, tornando mais fácil sua extração no procedimento cirúrgico
• Para tratar tumores maiores que estejam causando problemas sérios (como dificuldade em respirar) e que não respondem rapidamente à quimioterapia
• Como parte do esquema terapêutico (junto com quimioterapia em alta dose) antes de um transplante de células-tronco em crianças com neuroblastoma de alto risco
• Para ajudar a aliviar a dor causada por neuroblastoma avançado
A radiação é direcionada tipicamente ao próprio tumor, mas em alguns caso pode também visar outras partes do corpo para reduzir o risco de disseminação do câncer. Quando administrada por todo o corpo, a radiação é conhecida como irradiação de corpo inteiro (ICI).
Antes que o tratamento inicie, a equipe da radiação obtém medidas cuidadosas com auxílio de exames de imagem, tais como exames de IRM, para determinar os ângulos corretos para direcionar os feixes de radiação e a dose apropriada de radiação.
A radioterapia é muito semelhante a submeter-se a uma radiografia, mas a dose de radiação é muito mais alta. Para cada sessão, seu filho deita-se sobre uma mesa especial enquanto uma máquina administra a radiação a partir de um ângulo preciso. O tratamento não é doloroso.
A duração real do tratamento é de somente alguns minutos, mas o tempo para preparação – posicionar corretamente seu filho para o tratamento – geralmente dura mais. Crianças pequenas podem receber medicamentos que as façam dormir de modo que não se movam durante o tratamento. O número de sessões de radioterapia dependerá da situação.
Possíveis efeitos colaterais: Os efeitos colaterais da radioterapia dependem da dose e do alvo ao qual a radiação é direcionada.
Efeitos colaterais em curto prazo da radioterapia externa podem incluir reações cutâneas leves, náusea, diarreia ou cansaço. Com frequência, estes efeitos desaparecem em pouco tempo. Converse com o médico de seu filho sobre os possíveis efeitos colaterais, pois existem maneiras para aliviar alguns destes. A radiação pode também fazer com que os efeitos colaterais da quimioterapia piorem.
A radioterapia pode interferir com o crescimento de tecidos sadios do corpo, inclusive dos ossos, e pode aumentar o risco de desenvolver outros cânceres mais tarde. A fim de diminuir o risco de efeitos sérios tardios provocados pela radiação, os médicos tentam usar a dose mais baixa de radioterapia que seja ainda eficaz.
– Radioterapia com MIBG
Como descrito na seção “Como o neuroblastoma é diagnosticado?”, MIBG é uma substância química semelhante à norepinefrina, a qual é produzida por células nervosas simpáticas. Uma forma levemente radioativa de MIBG é às vezes injetada na corrente sanguínea como parte de um teste de imagem para identificar células de neuroblastoma no corpo.
Uma forma mais altamente radioativa de MIBG é utilizada também para tratar alguns pacientes com neuroblastoma avançado, muitas vezes junto com outros tratamentos. Uma vez injetado na corrente sanguínea, o MIBG vai para os sítios de tumores em qualquer local no corpo, onde libera sua radiação. A criança necessitará permanecer em uma sala especial por alguns dias depois da injeção, até que a maior parte da radiação tenha deixado o corpo.
Possíveis efeitos colaterais: A terapia com MIBG pode causar às vezes náusea e vômitos. Além disso, pode reduzir a contagem de células do sangue por seus efeitos sobre a medula óssea. Em casos raros, pode elevar a pressão arterial por um curto período de tempo. Por conter iodo, o MIBG pode se acumular na glândula tireoide no pescoço, capaz de resultar às vezes em níveis baixos do hormônio da tireoide no corpo.
Terapia com retinoides para neuroblastoma
Retinoides são substâncias químicas que são relacionadas com a vitamina A. São conhecidos como agentes de diferenciação por acreditar-se que ajudem algumas células cancerosas a amadurecerem (diferenciarem-se) em células normais.
Em crianças com neuroblastoma de alto risco, o tratamento com um retinoide denominado ácido 13-cis retinoico (isotretinoína) reduz o risco de recorrência após quimioterapia em alta dose e transplante de células-tronco. A maioria dos médicos recomenda 6 meses de ácido 13-cis retinoico (tomado em forma de cápsula) uma vez concluído o transplante.
Pesquisadores estão atualmente tentando desenvolver retinoides mais eficazes e definir a função exata dessa abordagem no tratamento do neuroblastoma.
Possíveis efeitos colaterais
O efeito colateral mais comum do ácido 13-cis retinoico é o ressecamento e fissuramento dos lábios. Pele e olhos ressecados são possíveis também, como o são sangramentos nasais e alterações nas unhas.
Tratamento por Grupo
Tratamento de neuroblastoma por grupo de risco
O tratamento para neuroblastoma baseia-se em grande medida no grupo ao qual uma criança se enquadre.
Baixo risco
Crianças em baixo risco frequentemente requerem somente cirurgia como o único tratamento. Mesmo em casos em que alguma parte do neuroblastoma é deixada atrás depois da cirurgia, a criança pode ser vigiada cuidadosamente sem tratamento adicional porque o tumor restante muitas amadurecerá ou desaparecerá por sua própria conta.
A quimioterapia é tipicamente administrada depois da cirurgia se muito do tumor não puder ser removido ou se este apresentar algumas características desfavoráveis. Um esquema quimioterápico comum é uma combinação de carboplatina, ciclofosfamida, doxorrubicina e etoposídeo. Porém, outras combinações poderão ser utilizadas.
Para aquelas poucas crianças com sintomas provocados por um tumor que não pode ser tratado de modo seguro imediatamente com cirurgia, um ciclo curto de quimioterapia poderia ser administrado. Por exemplo, se o tumor estiver pressionando a medula espinhal ou afetando a respiração, a quimioterapia pode ser utilizada para encolher o tumor e controlar os sintomas. A radioterapia pode ser necessária se a quimioterapia não retrair o tumor com a velocidade necessária.
Lactentes com a doença no estágio 4S e sem sintomas podem muitas vezes ser vigiados cuidadosamente sem tratamento, uma vez que estes cânceres tipicamente amadurecem ou desaparecem sozinhos. Se o tumor fizer com que o fígado aumente de volume, o que pode acarretar risco à vida para lactantes muito jovens, quimioterapia menos intensa pode ser utilizada para encolher o tumor. A radioterapia pode ser utilizada se a quimioterapia não retrair de imediato o fígado.
Risco intermediário
A cirurgia é uma parte importante do tratamento para crianças em risco intermediário, mas, raramente é suficiente sozinha. Tipicamente, são administrados de 4 a 8 ciclos (em torno de 12 a 24 semanas) de quimioterapia às crianças antes ou depois da cirurgia. Os medicamentos quimioterápicos utilizados são normalmente os mesmos que para a doença de baixo risco, embora as doses possam ser mais altas. A radioterapia pode ser empregada se a quimioterapia não surtir efeito.
Se quimioterapia for utilizada antes da cirurgia, uma “cirurgia de revisão” poderá ser realizada para examinar se há qualquer resto do câncer e, se presente, retirá-lo se possível. Esse procedimento pode ser seguido por radioterapia, se necessário.
Alto risco
Crianças em alto risco requerem tratamento mais agressivo, o que frequentemente inclui uma combinação de quimioterapia, cirurgia e radiação. O tratamento é muitas vezes dividido em 3 fases.
Indução: A meta desta fase é fazer com que o câncer entre em remissão, destruindo ou retirando tanto do tumor quanto possível. O tratamento em geral se inicia com quimioterapia, empregando mais medicamentos e a doses mais altas do que é utilizado em outros grupos de risco. A cirurgia pode ser realizada em seguida para tentar retirar quaisquer tumores que sejam ainda visíveis.
Consolidação: Nesta fase, o tratamento é mais intensivo para tentar se livrar de quaisquer células cancerosas que restem no corpo. Quimioterapia em alta dose é administrada (muitas vezes junto com radioterapia), seguido por transplante de células-tronco.
Manutenção: Esta fase de tratamento é fornecida para tentar reduzir a probabilidade de que o câncer retorne. O medicamento retinoide, ácido 13-cis retinoico (isotretinoína) é frequentemente administrado por 6 meses, depois que os outros tratamentos tiverem concluído. Adicionalmente, imunoterapia com o anticorpo monoclonal ch14.18, junto com citocinas ativadoras do sistema imune (GM-CSF e IL-2) são com frequência administrados também.
Terapia Complementar
Terapias complementares e alternativas para neuroblastoma
Quando seu filho tem câncer, você provavelmente ouvirá muitas maneiras para tratar seu câncer ou para aliviar sintomas que seu médico não tenha citado. Todos, de amigos e família a grupos na Internet e sites na Rede, podem oferecer ideias para o quê poderia ajudá-lo. Esses métodos podem incluir vitaminas, fitoterápicos e dietas especiais, ou outros como acupuntura ou massagem, para citar alguns. Consulte sempre o médico responsável pelo tratamento antes de qualquer ação.
O que são exatamente terapias complementares e alternativas?
Nem todos usam estes termos da mesma maneira, e são utilizados para se referirem a muitos diferentes métodos, de modo que podem provocar confusão. Utilizamos complementar para nos referirmos a tratamentos que são utilizados juntos com seu tratamento médico regular. Tratamentos alternativos são utilizados em vez de um tratamento médico do doutor.
Métodos complementares: A maioria dos métodos de tratamento complementar não é oferecida como uma cura para o câncer. São empregados, principalmente, para ajudar a pessoa com câncer a se sentir melhor. Alguns dos métodos que são utilizados junto com o tratamento regular são: arteterapia e terapia com brincadeiras para reduzir o estresse; acupuntura para ajudar a aliviar a dor; ou chá de hortelã para aliviar a náusea. Alguns métodos complementares são conhecidos por ajudar, enquanto outros não foram testados. Alguns foram comprovados não ser úteis, e uns poucos demonstraram mesmo serem nocivos.
Tratamentos alternativos: Tratamentos alternativos podem ser oferecidos como curas para o câncer. A segurança e a eficácia destes tratamentos não foram comprovadas em estudos clínicos. Alguns destes métodos podem representar um perigo, ou terem efeitos de risco à vida. Mas o maior perigo na maioria dos casos é que seu filho pode perder a oportunidade de ser ajudado pelo tratamento médico padrão. Atrasos ou interrupções em tratamento médicos podem permitir mais tempo ao câncer para crescer e tornar menos provável que o tratamento ajude.
Descobrindo mais
É fácil ver o motivo porque pais com filhos portadores de câncer consideram métodos alternativos. Você quer fazer tudo que pode para ajudar a combater o câncer, e a ideia de um tratamento sem ou com poucos efeitos colaterais parece ser fantástica. Às vezes, tratamentos médicos como a quimioterapia podem ser difíceis de fazer, ou podem demorar muito para funcionar. Mas, a verdade é que a maioria destes tratamentos alternativos não foi testada e comprovou funcionar no tratamento de câncer.
Ao considerar as opções de seu filho, abaixo, são apresentados 3 importantes passos que você pode tomar:
• Procure por “sinais de alerta” que sugiram fraude. O método promete curar todos ou quase todos os cânceres? Disseram-lhe para não usar tratamentos médicos regulares? O tratamento é “secreto” e somente pode ser administrado por certos profissionais ou em outro país?
• Converse com o médico ou o enfermeiro de seu filho sobre qualquer método que você esteja considerando.
A escolha é sua
A decisão sobre como tratar seu filho é sempre sua. Se você quiser usar um tratamento fora do padrão, aprenda tudo que possa sobre o método e converse com o médico de seu filho a respeito. Com boas informações e o suporte da equipe de tratamento de saúde, você pode ser capaz de usar com segurança os métodos que possam ajudar ao mesmo tempo em que evitar aqueles que poderiam ser prejudiciais.
NEUROBLASTOMA RECORRENTE
Neuroblastoma recorrente – E se o neuroblastoma voltar?
Infelizmente, às vezes, o neuroblastoma pode retornar após a terapia inicial. Isso é conhecido como recorrência ou recidiva. O tratamento nesse ponto dependerá de muitos fatores, inclusive o grupo de risco inicial, o local onde o câncer recorre e quais tratamentos foram utilizados.
Para neuroblastomas de risco intermediário ou baixo cuja recorrência seja na mesma área em que iniciaram, pode ser eficaz cirurgia associada ou não com quimioterapia.
Para cânceres de risco mais alto ou aqueles que recorrem em partes distantes do corpo, o tratamento é geralmente mais intenso, e poderá incluir uma combinação de quimioterapia, cirurgia e radioterapia (como radioterapia com MIBG). A quimioterapia poderia incluir medicamentos que não foram utilizados durante o tratamento inicial. Em alguns casos de recidiva, tratamento intensivo com quimioterapia/radioterapia em alta dose, seguido por transplante de células-tronco, pode ser utilizado. Considerando que estes cânceres são de difícil tratamento, testes clínicos de tratamentos experimentais, como anticorpos monoclonais ou novos medicamentos anticâncer, podem ser outra opção razoável (Ver a seção, “Quais são as novidades na pesquisa e no tratamento do neuroblastoma?”).
CUIDADOS PÓS TRATAMENTO
O que acontece após o tratamento para o neuroblastoma?
Muitas crianças com neuroblastoma têm uma boa probabilidade de sobrevida duradoura depois do tratamento.
Após o tratamento para o neuroblastoma, as principais preocupações para a maioria das famílias são os efeitos imediatos e tardios do tumor e de seu tratamento, e preocupações sobre a possível recorrência do tumor.
É certamente compreensível querer colocar para trás o tumor e seu tratamento e retornar a uma vida que não gire em torno de câncer. Mas, é importante perceber que os cuidados de acompanhamento representam uma parte central do processo que oferece a seu filho a melhor oportunidade para recuperação e sobrevida longa.
Exames de acompanhamento
Após o tratamento, o médico provavelmente pedirá testes de acompanhamento, os quais poderão incluir testes laboratoriais e testes de imagem (exames com MIBG, exames de PET, ultrassom, exames de TC e/ou exames de IRM) para verificar se há qualquer tumor restante. Os testes realizados dependerão do grupo de risco, do tamanho e da localização do tumor e de outros fatores.
Tendo em vista que há uma probabilidade de que o câncer possa retornar após o tratamento inicial, é muito importante manter todos os compromissos de acompanhamento e relatar imediatamente quaisquer novos sintomas ao médico de seu filho. A equipe do tratamento de saúde discutirá com você um cronograma de acompanhamento, inclusive quais testes devem ser realizados e qual com frequência. Visitas ao médico, testes laboratoriais e exames de imagem para averiguar sinais de recorrência são efetuados mais frequentemente no início. Se nada anormal é encontrado, o tempo entre os testes pode ser ampliado.
Um benefício do atendimento de acompanhamento é que este lhe oferece a oportunidade para discutir quaisquer perguntas e preocupações que surjam durante e depois da recuperação de seu filho. Por exemplo, quase todo tratamento contra o câncer pode ter efeitos colaterais. Alguns podem durar de poucas semanas a muitos meses, mas outros podem ser permanentes. É importante relatar imediatamente quaisquer novos sintomas ao médico de modo que a causa possa ser determinada e tratada, se necessário.
É importante também manter o plano de saúde. Apesar de ninguém querer pensar a esse respeito, a volta do câncer é sempre uma possibilidade. Se acontecer, a última coisa que você desejaria é ter que se preocupar com o pagamento pelo tratamento.
Manter bons registros médicos
Por mais que você possa querer esquecer a experiência uma vez que o tratamento tenha sido concluído, é também muito importante manter bons registros do atendimento médico de seu filho durante esse período. Isso pode ser muito útil para seu filho e seus médicos mais tarde quando adulto. Há certas informações que você deve assegurar que os médicos de seu filho possuam.
Estas são:
• Uma cópia do(s) laudo(s) de patologia de quaisquer biópsias ou cirurgias
• Se houve uma cirurgia, uma cópia do(s) laudo(s) da operação
• Caso seu filho tenha sido hospitalizado, cópias dos resumos de alta que os médicos preparam quando os pacientes são enviados para casa
• Caso seu filho tenha recebido quimioterapia ou outros medicamentos para o câncer, uma lista dos medicamentos, de suas doses e quando foram administrados
• Se houve radiação, um resumo do tipo e da dose de radiação e quando e onde foi administrado
Efeitos em longo prazo do neuroblastoma e de seu tratamento
O próprio neuroblastoma e seu tratamento são capazes às vezes de resultar em efeitos duradouros.
Em circunstâncias muito raras e por motivos desconhecidos, em algumas crianças com neuroblastoma, o sistema imune do corpo ataca o tecido nervoso normal da criança. Isso pode levar a problemas como deficiências no aprendizado, atrasos no desenvolvimento muscular, problemas de fala e no comportamento. Crianças cujo tumor surja no pescoço ou no tórax e que tenham problemas com os olhos ou com torções musculares podem necessitar tratamento adicional com corticosteroides ou outros hormônios para suprimir seu sistema imune.
Graças aos grandes avanços terapêuticos, um número maior de crianças tratadas para câncer está sobrevivendo agora até a idade adulta. Os médicos aprenderam que o tratamento pode afetar a saúde das crianças mais tarde na vida, de modo que vigiar efeitos à saúde à medida que envelhecem tornou-se mais uma preocupação nos últimos anos.
Tratar câncer infantil requer uma abordagem muito especializada, assim como os cuidados e o acompanhamento após o tratamento. Quanto mais cedo quaisquer problemas possam ser reconhecidos, mais provavelmente poderão ser tratados eficazmente.
Sobreviventes de câncer infantil estão em risco, em certa medida, de diversos possíveis efeitos tardios ocasionados por seu tratamento contra o câncer. Este risco depende de alguns fatores, como o tipo de câncer, os tratamentos específicos recebidos para câncer, doses de tratamento contra o câncer e a idade em que receberam o tratamento contra o câncer. Os efeitos tardios do tratamento para o câncer podem incluir:
• Problemas cardíacos ou pulmonares (em decorrência de certos medicamentos quimioterápicos ou à radioterapia)
• Crescimento e desenvolvimento retardado ou diminuído (ósseo ou no geral)
• Alterações no desenvolvimento sexual e na capacidade de ter filhos
• Alterações na função intelectual com problemas no aprendizado
• Desenvolvimento de um segundo câncer mais tarde na vida
NOVIDADES
Quais são as novidades na pesquisa e no tratamento do neuroblastoma?
Pesquisas importantes sobre o neuroblastoma estão em andamento neste momento em muitos hospitais universitários, centros médicos e em outras instituições em todo o mundo. A cada ano, os cientistas descobrem mais sobre o que causa a doença e o modo como melhorar o tratamento.
Classificação de neuroblastomas
Os pesquisadores contam agora com testes laboratoriais melhores para investigar alterações nos genes de células do neuroblastoma. Foram feitos muitos progressos nos últimos anos em descobrir quais neuroblastomas mais provavelmente serão curados com tratamento padrão e quais necessitarão tratamento mais agressivo.
Por exemplo, usando testes laboratoriais mais modernos, pesquisadores descobriram que certas alterações no DNA no braço curto do cromossomo 6 (p622) são mais provavelmente vistas em neuroblastomas que crescem com mais agressividade.
Os médicos estão buscando agora usar esses achados para ajudar na escolha dos melhores tratamentos. Sistemas mais novos de estadiamento e de classificações de grupos de riscos, que tiram proveito de alguns destes achados, devem estar em uso dentro dos próximos anos.
Tratamento
As taxas de sobrevida de cânceres na infância melhoraram, pois os médicos descobriram maneiras para aperfeiçoar os tratamentos atuais. Os pesquisados prosseguem buscando melhores maneiras para tratar o neuroblastoma.
Quimioterapia
Os médicos seguem pesquisando as melhores combinações de medicamentos quimioterápicos para tratar o neuroblastoma.
Diversos medicamentos quimioterápicos que já estão sendo utilizados para tratar outros tipos de câncer, como topotecano, irinotecano e temozolomida, estão sendo estudados atualmente para o uso contra o neuroblastoma. Além disso, alguns medicamentos mais recentes que atuam em maneiras diferentes dos medicamentos quimioterápicos padrão estão sendo também estudados em outros países para o tratamento do neuroblastoma. Os exemplos incluem bortezomibe, nifurtimox e lestaurtinibe.
Outros estudos estão investigando se crianças com neuroblastoma de risco intermediário ou baixo podem ser tratadas com menos quimioterapia. A meta é ainda obter os mesmos bons resultados, mas com menos efeitos colaterais provocados pelo tratamento.
Transplantes de células-tronco
Os médicos estão tentando também melhorar as taxas de sucesso com quimioterapia em alta dose e transplantes de células-tronco, utilizando diferentes combinações de quimioterapia, radioterapia, retinoides e outros tratamentos. Alguns estudos clínicos estão investigando o uso de mais de um transplante de células-tronco no mesmo paciente (conhecido como transplante em tandem). Outros estão buscando ver se o uso de células-tronco de outra pessoa (um transplante alogênico) poderia ajudar algumas crianças com tumores difíceis de tratar.
Retinoides
Retinoides como o ácido 13-cis retinoico (isotretinoína) demonstram promessa em reduzir o risco de recorrência depois do tratamento. Retinoides mais novos, potencialmente mais eficazes, como fenretinida, estão sendo examinados agora em estudos clínicos.
Formas mais recentes de tratamento
O conhecimento sobre o que torna células de neuroblastoma diferentes de células normais pode levar a novas abordagens para tratar esta doença. Diversas formas de terapias mais novas, direcionadas mais especificamente contra células de neuroblastoma do que os tratamentos tradicionais, atualmente estão sendo investigadas em estudos clínicos.
Por exemplo, os médicos estão estudando agora medicamentos que visam especificamente o mecanismo de ação de células de neuroblastoma, tal como um medicamento que inibe a via do ALK ou a via aurora A. Um exemplo é o crizotinibe, um medicamento direcionado a células com alterações no gene ALK. Até 15% dos neuroblastomas apresentam alterações neste gene. Estudos que testam este medicamento estão sendo iniciados no momento.
O anticorpo monoclonal ch 14.18, cujo alvo é GD2 em células de neuroblastoma, é utilizado agora de rotina para crianças com neuroblastoma de alto risco, para ajudar que células do sistema imune encontrem e destruam as células cancerosas. Estudos clínicos estão em andamento para testar a efetividade de diversos outros anticorpos direcionados ao GD2. Um exemplo é o hu 14.18-IL-2, um anticorpo que está ligado à interleucina-2 (uma citocina que reforça o sistema imune). Resultados iniciais constataram que esta combinação anticorpo/citocina pode ajudar algumas crianças nas quais outros tratamentos não estão funcionando mais.
Diversas vacinas contra câncer estão também sendo estudadas para o uso contra o neuroblastoma. Para estas vacinas, células modificadas de neuroblastoma ou outras substâncias são injetadas no corpo para tentar fazer com que o próprio sistema imune da criança ataque as células cancerosas. Estes tratamentos estão ainda nos estágios mais precoces de estudos clínicos.
O QUE PERGUNTAR AO MÉDICO?
O que você deve perguntar ao médico de seu filho sobre o neuroblastoma?
É importante ter discussões abertas honestas com sua equipe de tratamento do câncer. Você deve sentir-se à vontade para fazer qualquer pergunta que tenha em mente, não importando o quanto insignificante possa parecer.
Entre as perguntas que você poderia querer fazer estão:
• Qual é o estágio (extensão) do neuroblastoma?
• Qual é o grupo de risco que o câncer do meu filho se encontra? O que isso significa no caso do meu filho?
• O que mais pode me informar sobre o câncer com base nos testes laboratoriais?
• Existem quaisquer outros testes que precisam ser feitos antes que discutamos o tratamento?
• Qual é sua experiência em tratar este tipo de câncer?
• Quais são os outros médicos que precisaremos consultar?
• Quais são nossas opções de tratamento?
• Um tipo de tratamento aumenta a chance de cura mais do que outro?
• Há outros estudos clínicos que deveríamos considerar?
• Qual tratamento você recomenda? Por quê?
• Quais são os possíveis efeitos colaterais do tratamento? O que pode ser feito a respeito?
• Qual será a duração do tratamento? O que envolverá? O que será realizado?
• Quanto tempo levará para que meu filho se recupere do tratamento?
• Qual são as probabilidades do câncer recorrer? O que faríamos se isso acontecer?
• Existem riscos a longo prazo ou complicações da doença ou do tratamento?
• O que devo fazer para ajudar meu filho a estar pronto para o tratamento?
• Que tipo de acompanhamento meu filho necessitará depois do tratamento?
• Existe um grupo de apoio para famílias que estão enfrentando neuroblastoma ou câncer na infância?
Junto com estas perguntas de amostra, certifique-se de anotar algumas próprias. Por exemplo, você poderia querer mais informações sobre períodos de tempo para recuperação de modo que possa planejar seus esquemas para escola e trabalho. Você pode querer perguntar também sobre obter uma segunda opinião. Mantenha em mente também que os médicos não são os únicos que podem fornecer-lhe informações. Outros profissionais de saúde como, por exemplo, enfermeiras e assistentes sociais, podem ter as respostas que você procura.
Como é feito o estadiamento do neuroblastoma?
Estadiamento é o processo de se descobrir o quanto um câncer se disseminou. A previsão (prognóstico) para pessoas com câncer depende, em grande medida, do estágio do câncer. O estágio de um câncer é um dos fatores mais importantes ao ser escolhido um tratamento.
O estágio do neuroblastoma tem como base resultados de exames físicos, exames de imagem e biópsias do tumor principal e de outros tecidos, os quais foram descritos na seção “Como o neuroblastoma é diagnosticado?”, bem como os resultados de cirurgia.
Para o neuroblastoma, diversos outros fatores afetam também o prognóstico, inclusive idade da criança e certos exames e tumor. Embora não sejam utilizados para determinar o estágio do câncer, estes fatores prognósticos são usados, juntamente com o estágio do câncer, para determinar em qual grupo de risco uma criança se enquadra. Estes fatores prognósticos e grupos de risco estão também descritos abaixo e na seção “Grupos de risco”.
Sistema Internacional de Estadiamento do Neuroblastoma
Um sistema de estadiamento é uma maneira padronizada para a equipe que trata o câncer descrever a sua extensão. A partir da metade da década de noventa, a maioria dos centros de câncer tem utilizado o Sistema Internacional de Estadiamento do Neuroblastoma (INSS) para estadiar neuroblastoma. Em forma simplificada, os estágios são:
Estágio 1: O câncer ainda está na área onde iniciou. Está localizado em um lado do corpo (direito ou esquerdo). Todo o tumor visível é totalmente removível por cirurgia (embora as margens do tumor, examinadas sob o microscópio depois da cirurgia, possam mostrar algumas células cancerosas). Linfonodos situados no interior do tumor podem conter células de neuroblastoma, mas os existentes fora do tumor estão livres do câncer.
Estágio 2A: O câncer ainda está na área onde iniciou e em um lado do corpo, mas nem todo o tumor visível pode ser removido por cirurgia. Linfonodos situados no interior do tumor podem conter células de neuroblastoma, mas os existentes fora do tumor estão livres do câncer.
Estágio 2B: O câncer está em um lado do corpo e pode ou não ser possível que seja totalmente removido por cirurgia. Linfonodos próximos, fora do tumor, contêm células de neuroblastoma, mas o câncer não se espalhou para linfonodos no outro lado do corpo ou para outro local.
Estágio 3: O câncer não se espalhou para partes distantes do corpo, mas uma das afirmações seguintes é verdadeira:
– O câncer não pode ser completamente removido por cirurgia e atravessou a linha mediana (definida como a coluna vertebral) para o outro lado do corpo. Pode ou não ter se espalhado para linfonodos próximos.
– O câncer ainda está na área onde se iniciou e está situado em um lado do corpo. Já se espalhou para linfonodos que são relativamente próximos, mas no outro lado do corpo.
– O câncer está no meio do corpo e crescendo em direção aos dois lados (seja diretamente ou por disseminação para linfonodos próximos) e não pode ser completamente removido por cirurgia.
Estágio 4: O câncer se disseminou para sítios distantes, tais como linfonodos distantes, osso, fígado, pele, medula óssea ou outros órgãos (mas a criança não atende aos critérios para o Estágio 4S).
Estágio 4S (denominado também neuroblastoma “especial”): A criança é mais nova do que 1 ano de idade. O câncer está em um lado do corpo. Pode ter se espalhado para linfonodos no mesmo lado do coro, mas não para nódulos no outro lado. O neuroblastoma se espalhou para o fígado, a pele e/ou a medula óssea. Contudo, no máximo 10% das células da medula podem ser cancerosas, e os exames de imagem, como exame com MIBG, não mostram disseminação para os ossos.
Recorrente: Embora não integre formalmente o sistema de estadiamento, esse termo é empregado para descrever o câncer que retornou (recorreu) depois de ter sido tratado. O câncer pode retornar na área onde primeiramente iniciou ou em outra parte do corpo.
Sistema Internacional de Estadiamento de Grupos de Risco para Neuroblastoma
Um sistema mais novo de estadiamento, conhecido como o Sistema Internacional de Estadiamento de Grupos de Risco para Neuroblastoma (INRGSS), não utiliza os resultados de cirurgia para ajudar a determinar o estágio. O sistema permite que o médico determine um estágio antes da cirurgia, com base nos resultados de exames físicos, exames de imagem e biópsias. O INRGSS está sendo estudado para ter a certeza de que é útil, de modo que o INSS ainda está sendo utilizado por ora. O sistema mais novo pode substituir o INSS no futuro próximo.
Neuroblastoma é uma forma de câncer que se inicia em certos tipos de células nervosas muito primitivas encontradas em embriões ou fetos (o termo neuro refere-se a nervos, enquanto blastoma diz respeito a um câncer que afeta células imaturas ou em desenvolvimento). Este tipo de câncer ocorre em lactentes e crianças na primeira infância. Raramente, é encontrado em crianças com mais de 10 anos de idade.
Para entender o neuroblastoma, é importante conhecer algo sobre a estrutura e o funcionamento normal do sistema nervoso simpático, lugar onde estes tumores se iniciam. A seguir, um pouco sobre o Sistema Nervoso Simpático.
Neuroblastoma e o Sistema Nervoso Simpático
O sistema nervoso é formado pelo cérebro, a medula espinhal e os nervos que deles se originam e atingem todas as áreas do corpo. O sistema nervoso é essencial para pensar, sentir e movimentar-se, entre outras coisas.
Parte do sistema nervoso controla também funções do corpo, das quais raramente estamos cientes, como frequência cardíaca, respiração, pressão arterial, digestão e outras funções. Esta parte do sistema nervoso é conhecida como sistema nervoso autônomo.
O sistema nervoso simpático faz parte do sistema nervoso autônomo. Ele inclui:
• Fibras nervosas que percorrem as laterais da medula espinhal.
• Agrupamentos de células nervosas, denominados gânglios, em certos pontos ao longo do trajeto das fibras nervosas.
• Células semelhantes às nervosas, encontradas na medula (centro) das glândulas adrenais. As adrenais são pequenas glândulas assentadas sobre a parte superior de cada rim. Estas glândulas produzem hormônios como a adrenalina (epinefrina).
As principais células que compõem o sistema nervoso são denominadas células nervosas ou neurônios. Estas células se comunicam com outros tipos de células no corpo ao liberarem quantidades diminutas de substâncias químicas (hormônios). Isso é importante porque as células do neuroblastoma frequentemente liberam certos hormônios que podem causar sintomas (ver a seção, “Como o neuroblastoma é diagnosticado?”).
Voltando aos neuroblastomas, são cânceres que se desenvolvem a partir de células nervosas imaturas do sistema nervoso simpático (neuroblastos simpáticos), de modo que podem ser encontrados em qualquer local ao longo deste sistema.
Um pouco mais que um terço dos neuroblastomas se inicia nas glândulas adrenais. Por volta de um terço começa em gânglios de nervos simpáticos no abdômen. A maior parte do restante tem início em gânglios simpáticos próximos à coluna vertebral, no tórax ou na pelve.
Em casos raros, é possível que um neuroblastoma tenha se espalhado de modo tão vasto que, ao ser encontrado, os médicos são incapazes de dizer exatamente o local de sua origem.
Existe um amplo espectro de comportamentos que os neuroblastomas podem adotar. Alguns são capazes de se proliferarem e disseminarem rapidamente, enquanto em outros o crescimento é lento. Às vezes, em crianças muito jovens, as células cancerosas morrem sem qualquer motivo ou o tumor desaparece por si próprio. Em outros casos, as células, algumas vezes, amadurecem sozinhas até células ganglionares normais e param de se dividir. Isso faz com que o tumor se torne um ganglioneuroma.
Outros Tumores
Nem todos os tumores do sistema nervoso autônomo na infância são malignos (cancerosos).
O ganglioneuroma é um tumor benigno (não cancerosos) formado por células ganglionares maduras e bainhas nervosas.
O ganglioneuroblastoma é um tumor que apresenta componentes malignos e benignos. O tumor contém neuroblastos (células nervosas imaturas) que são capazes de proliferar e se espalhar anormalmente, semelhantemente ao neuroblastoma, bem como regiões de tecido mais maduro que são semelhantes ao ganglioneuroma.
Os ganglioneuromas são geralmente extraídos por cirurgia e observados cuidadosamente sob um microscópio para ter certeza de que não possuem áreas de células malignas (o que o tornaria um ganglioneuroblastoma). Se o diagnóstico final for ganglioneuroma, nenhum outro tratamento é necessário. Por outro lado, ganglioneuroblastomas são tratados do mesmo modo que neuroblastomas.
Sabemos o que causa o neuroblastoma?
As causas do neuroblastoma não são completamente conhecidas. Porém, pesquisadores descobriram importantes diferenças entre células de neuroblastoma e os neuroblastos normais (células nervosas primitivas) a partir dos quais estas se desenvolvem. Encontraram também diferenças entre neuroblastomas que possivelmente respondem ao tratamento e aqueles cujo prognóstico é desfavorável (previsão). Estas diferenças (conhecidas como marcadores prognósticos) são úteis na seleção do tratamento para alguns pacientes (ver a seção, “Como é feito o estadiamento do neuroblastoma?”).
Há muitos anos, os cientistas já sabem que as células nervosas e as células da medula (centro) da glândula adrenal se desenvolvem a partir de células no feto denominadas neuroblastos. Neuroblastomas se formam quando neuroblastos fetais normais falham em se tornar células nervosas maduras ou células da medula adrenal. Ao invés, continuam a proliferar e se dividir.
Os neuroblastos podem não estar completamente amadurecidos em bebês quando estes nascem. De fato, estudos mostraram que existem pequenos agrupamentos de neuroblastos nas glândulas adrenais de alguns lactentes com menos de 3 meses de idade. A maioria destes eventualmente amadurece e se transforma em células nervosas ou simplesmente desaparece e não forma neuroblastomas. Algumas vezes, os neuroblastos restantes em lactentes muito jovens continuam a crescer e então formam tumores e podem até mesmo se disseminar para outras partes do corpo. Porém, muitos destes tumores ainda amadurecerão eventualmente e se transformarão em tecido nervoso ou desaparecerão sozinhos.
No entanto, à medida que a criança envelhece, torna-se menos provável que estas células amadureçam e é mais possível que continuem a se proliferar, dando origem a um câncer. No momento em que os neuroblastomas estão suficientemente grandes para serem percebidos ou causarem sintomas, a maioria não consegue mais amadurecer por si mesmo e crescerá e se espalhará a menos que tratada.
A incapacidade para amadurecer e parar de crescer deve-se ao DNA anormal nos neuroblastos. O DNA é a substância química em cada uma de nossas células que constitui nossos genes – as instruções para o modo como nossas células funcionam. O DNA é encontrado no núcleo (centro de controle) de cada célula, em estruturas longas semelhantes a fios denominadas cromossomos. Nós geralmente nos parecemos com nossos pais porque eles são a origem de nosso DNA, porém, o DNA afeta mais do que como aparentamos. O DNA pode influenciar também nosso risco de desenvolver certas doenças, tal como alguns tipos de câncer.
Alguns genes contêm instruções para controlar quando nossas células crescem, dividem-se e morrem. Certos genes que aceleram a divisão celular são denominados oncogenes. Outros que retardam a divisão celular ou que fazem com que as células morram no momento certo são denominados genes supressores de tumor. Cânceres podem ser causados por alterações no DNA que ativam oncogenes ou que desativam genes supressores de tumor.
Na maioria dos casos, alguns dos cromossomos em células do neuroblastoma apresentam alterações que provavelmente afetam certos genes. Os cientistas ainda estão tentando determinar quais genes são afetados por estas alterações cromossômicas, bem como o modo que estas alterações poderiam afetar o crescimento de células do neuroblastoma.
Algumas pessoas que desenvolvem câncer apresentam mutações no DNA que herdaram de um dos pais e que aumentam seu risco para a doença. Em casos raros, o neuroblastoma parece ser devido a alterações em genes herdadas. Alterações herdadas no oncogene ALK parecem ser responsáveis pela maioria dos casos de neuroblastoma hereditário. Um número pequeno de neuroblastomas herdados é causado por alterações no PHOX2B, um gene que normalmente ajuda células nervosas a amadurecerem.
Ainda, a maior parte dos neuroblastomas não é causada por alterações herdadas no DNA. Estes são o resultado de alterações em genes adquiridas precocemente no desenvolvimento da criança. Estas alterações estão presentes somente nas células cancerosas da criança, de modo que não serão transmitidas para seus filhos. Os genes exatos afetados não são conhecidos na maioria dos casos.
Algumas alterações gênicas podem afetar a rapidez com a qual um neuroblastoma provavelmente crescerá. Por exemplo, células de neuroblastoma contêm às vezes cópias extras de um oncogene denominado MYCN, que é frequentemente um sinal de que o tumor crescerá rapidamente. Por outro lado, o gene NTRK1 (que produz a proteína TrkA) é muitas vezes superativo em células de neuroblastoma, o que significa um prognóstico favorável.
Pesquisadores descobriram algumas das alterações gênicas que podem levar ao neuroblastoma, mas ainda não está claro o que poderia causar estas alterações. Algumas alterações gênicas podem ser herdadas. Algumas podem ter causas externas que ainda não são conhecidas, mas outras podem ser apenas um evento aleatório que às vezes ocorre no interior de uma célula, sem que tenha uma causa externa. No momento, ainda não são conhecidas causas de neuroblastoma que sejam associadas ao estilo de vida ou ao ambiente, de modo que é importante lembrar que não há nada que estas crianças ou seus pais pudessem ter feito para impedir a ocorrência deste câncer.
Quais são os fatores de risco para neuroblastoma?
Fator de risco é algo que afeta sua chance de adquirir uma doença, como o câncer. Diferentes tipos de câncer apresentam diferentes fatores de risco.
Fatores de risco associados ao estilo de vida, como dieta, peso corporal, atividade física e tabagismo desempenham um importante papel em muitos tipos de câncer no adulto. Porém, estes fatores geralmente levam muitos anos para influenciar o risco de câncer, e não se acredita que participem tanto em cânceres na infância, incluindo neuroblastomas.
Não se conhece fatores ambientais (como exposições durante a gestação da mãe ou na primeira infância) que aumentem a chance de se adquirir neuroblastoma.
Idade
O neuroblastoma é mais comum em crianças muito jovens, mas, mesmo nessa faixa etária, é ainda raro.
Hereditariedade
Em casos raros (em torno de 1% a 2% de todos os neuroblastomas), crianças podem herdar um risco aumentado de desenvolver neuroblastoma. No entanto, a grande maioria dos neuroblastomas não parece ser herdada.
Crianças com a forma familiar de neuroblastoma (aquelas com uma tendência herdada para desenvolver este câncer) geralmente vêm de famílias com um ou mais membros afetados que tiveram neuroblastoma quando lactentes. A idade média no diagnóstico de casos familiares é mais precoce do que a idade para casos esporádicos (não herdados).
Crianças com neuroblastoma familiar podem desenvolver 2 ou mais destes cânceres em diferentes órgãos (por exemplo, em ambas as glândulas adrenais ou em mais de um gânglio simpático). É importante distinguir neuroblastomas que se desenvolvem em diversos órgãos de neuroblastomas que tiveram início em um órgão e então se espalharam para outros (neuroblastomas metastáticos), pois, quando há o desenvolvimento de tumores em diversos locais, isto imediatamente sugere uma forma familiar. Metástases podem ocorrer tanto com a forma familiar quanto com a esporádica.
Grupos de Risco
Grupos de risco para o neuroblastoma
O Children’s Oncology Group (COG) faz uso dos principais fatores prognósticos discutidos na seção anterior, combinado com o estágio da doença, para formar 3 diferentes grupos de risco: baixo, intermediário e alto. Estes grupos de risco são utilizados para ajudar a predizer a probabilidade de uma criança poder ser curada. Por exemplo, uma criança no grupo de baixo risco pode frequentemente ser curada com tratamento simples, tal como apenas cirurgia. Com crianças nos grupos de risco mais alto, a chance de cura não é tão alta, de modo que tratamento mais intensivo é muitas vezes necessário.
Estes grupos de risco têm como base o conhecimento atual sobre características clínicas e biológicas do neuroblastoma e o modo como este é tratado. À medida que nova pesquisa forneça mais informações, estes grupos de riscos podem se alterar com o passar do tempo. Por exemplo, em recomendações recentes para o tratamento, o corte de idade para algumas dessas categorias foi revisado, de até 12 meses para até 18 meses (547 dias).
Baixo risco
• Todas as crianças que estão no Estágio 1
• Qualquer criança que esteja no Estágio 2A ou 2B e que tenha menos de 1 ano de idade
• Qualquer criança que esteja no Estágio 2A ou 2B, cujo câncer não tenha cópias extras do gene MYCN
Qualquer criança que esteja no Estágio 2A ou 2B, cujo câncer tenha cópias extras do gene MYCN, mas com histologia favorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer tenha histologia favorável, seja hiperdiploide (DNA em excesso) e sem cópias extras do gene MYCN
Risco intermediário
• Qualquer criança que esteja no Estágio 3, abaixo de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN e tenha histologia favorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 4, abaixo de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer não tenha cópias extras do gene MYCN e apresente ploidia normal do DNA (número de cromossomos) e/ou histologia desfavorável
Alto risco
• Qualquer criança que esteja no Estágio 2A ou 2B, acima de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN e histologia desfavorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 3, abaixo de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN, mas com histologia desfavorável
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4, abaixo de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4 e seja acima de 1 ano de idade
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer tenha cópias extras do gene MYCN
Classificação recente de grupos de risco
Tal como acontece com o sistema de estadiamento descrito na seção anterior, um sistema mais novo de classificação de grupos de risco, a classificação Internacional de Grupos de Riscos para Neuroblastoma (INRG), está sendo atualmente estudada e poderá em breve substituir o sistema acima do COG. A classificação INRG divide as crianças em 4 grupos de risco, incluindo um grupo de risco muito baixo, e possui modificações baseadas em nosso entendimento recente sobre a histologia do tumor.
Taxas de sobrevida em 5 anos do neuroblastoma com base em grupos de risco
Taxas de sobrevida representam uma maneira para obter uma ideia geral da previsão para crianças com certo tipo e estágio de câncer. Alguns pais podem querer saber sobre a estatística para crianças em situações semelhantes, mas outros podem não achar que os números ajudem, ou podem mesmo nem querer sabê-los.
A taxa de sobrevida em 5 anos refere-se ao percentual de pacientes que vivem pelo menos 5 anos depois que seu câncer é diagnosticado. Evidentemente, muitas crianças vivem por mais tempo do que 5 anos (e muitas são curadas).
Para obter taxas de sobrevida em 5 anos, os médicos precisam verificar pessoas que foram tratadas há pelo menos 5 anos. Melhoras no tratamento desde então podem resultar em previsão mais favorável para os pacientes que estão sendo diagnosticados agora com neuroblastoma.
As taxas de sobrevida frequentemente baseiam-se em resultados anteriores de grandes números de pessoas que sofreram da doença, mas não podem predizer o que acontecerá em qualquer caso individual específico. O grupo de risco do câncer de uma pessoa é importante para estimar sua previsão. Porém, muitos outros fatores podem afetar a previsão de uma pessoa, tais como sua idade, a localização do tumor e até que ponto o câncer responde ao tratamento.
Sobrevida por grupo de risco
· Grupo de baixo risco: A taxa de sobrevida em 5 anos em crianças no grupo de baixo risco é em torno de 95%.
· Grupo de risco intermediário: Em crianças no grupo de risco intermediário, a taxa de sobrevida em cinco anos é em torno de 80% a 90%.
· Grupo de alto risco: A taxa de sobrevida em 5 anos em crianças no grupo de alto risco é em torno de 30% a 50%.
Histórico Médico e Exame Físico
Se seu filho apresenta sinais e sintomas que possam sugerir um neuroblastoma, o médico vai querer obter um histórico médico completo para se inteirar mais sobre os sintomas. Um exame físico pode fornecer informações sobre sinais de um neuroblastoma ou de outros problemas de saúde. Por exemplo, o médico pode constatar pressão arterial alta em uma criança ou ser capaz de ver ou perceber uma massa anormal no corpo.
Se os sintomas e/ou os resultados do exame físico sugerirem um neuroblastoma (ou outro tumor), outros testes provavelmente serão realizados. Estes podem incluir exames de sangue e de urina, exames por imagem e biópsias. Estes exames são importantes porque muitos dos sintomas e sinais do neuroblastoma podem ser causados também por outros tipos de câncer ou por doenças não cancerosas.
PREVENÇÃO
O neuroblastoma pode ser prevenido?
O risco de muitos cânceres em adultos pode ser reduzido com certas mudanças no estilo de vida (tal como manter o peso saudável ou deixar de fumar), mas, por enquanto, não há maneiras conhecidas para prevenir a maioria dos cânceres em crianças.
Os únicos fatores de risco conhecidos para o neuroblastoma (idade e hereditariedade) não podem ser alterados. No momento, não se conhecem causas associadas ao estilo de vida ou ambientais para neuroblastomas.
Alguns estudos sugerem que a administração materna de multivitamínicos ou ácido fólico no período pré-natal poderia reduzir o risco de neuroblastoma, mas são necessárias pesquisas adicionais para confirmar essa recomendação.
Se houver histórico de neuroblastoma em sua família, você poderá desejar conversar com um geneticista sobre os riscos de seus filhos desenvolverem a doença. É importante lembrar, no entanto, que o neuroblastoma familiar é muito raro.
Sinais e sintomas
Os sinais e sintomas de neuroblastoma podem variar bastante, dependendo do tamanho e da localização do tumor original, da extensão da disseminação para outras partes do corpo e se as células tumorais secretam ou não hormônios.
Muitos dos sinais e sintomas abaixo são mais provavelmente causados por algo diferente de neuroblastoma. Ainda assim, se o seu filho tiver qualquer um destes sintomas, verifique com seu médico de modo que a causa possa ser avaliada e tratada, se necessário.
Sinais ou sintomas causados pelo tumor primário
Um dos sinais mais comuns de um neuroblastoma é a presença de uma protuberância ou massa incomum. Estas são normalmente encontradas no abdômen da criança, causando seu inchaço. A criança pode não querer comer (o que pode levar à perda do peso). Se a criança tiver idade suficiente, ele ou ela pode queixar-se de se sentir cheio ou de ter desconforto ou dor. Mas, a própria protuberância não é em geral sensível ao toque. Massas podem ocorrer também em outros locais como o pescoço.
Algumas vezes, o inchaço provocado por um tumor no abdômen pode afetar partes do corpo que não contêm câncer, especialmente as pernas e, no sexo masculino, o escroto. Isso acontece quando um tumor pressiona ou invade e obstrui os vasos sanguíneos e linfáticos, impedindo os líquidos de circularem de volta para o coração.
Em alguns casos, a pressão de um tumor em crescimento pode afetar a bexiga ou os intestinos da criança, o que pode causar problemas com a micção, diarreia ou constipação.
Se estiver localizado no tórax, o tumor pode pressionar a veia cava superior (a grande veia no tórax que faz o retorno do sangue da cabeça e pescoço para o coração). Isso pode causar inchaço na face, no pescoço, nos braços e na região superior do tórax (às vezes acompanhado por coloração vermelho-azulada da pele). Além disso, pode causar cefaleias, tonturas e uma alteração no nível da consciência se afetar o cérebro. O tumor pode pressionar também a garganta ou a traqueia, o que pode tornar difícil para a criança respirar ou deglutir.
Neuroblastomas que pressionam certos nervos no tórax ou no pescoço podem algumas vezes provocar outros sintomas, como queda palpebral e pupila pequena (a área preta no centro do olho). A pressão sobre outros nervos próximos à coluna vertebral pode afetar a capacidade da criança de sentir ou movimentar os braços ou as pernas.
Sinais ou sintomas causados pela disseminação do tumor
Cerca de dois terços dos casos de neuroblastomas já se disseminaram para outras partes do corpo no momento em que são descobertos.
O neuroblastoma frequentemente se dissemina para os ossos. Uma criança capaz de falar pode queixar-se de dor nos ossos. A dor pode ser tão grande que a criança manca ou se recusa a andar. Caso se dissemine para a coluna, os tumores podem pressionar a medula espinhal e provocar fraqueza, dormência ou paralisia nos braços ou nas pernas. A disseminação para os ossos em torno dos olhos pode levar ao aparecimento de hematoma ao redor dos olhos ou fazer com que um globo ocular se torne ligeiramente proeminente.
A presença de caroços azuis ou roxos que se assemelham a pequenas frutas silvestres (mirtilos) pode ser sinal de disseminação para a pele.
Se o câncer espalhar-se para a medula óssea (a parte interna de certos ossos que produzem células do sangue), a criança pode não ter número suficiente de células vermelhas, brancas ou plaquetas no sangue. Esses déficits de células sanguíneas podem resultar em cansaço, irritabilidade, fraqueza, infecções frequentes e sangramento excessivo de pequenos cortes ou arranhões.
Raramente, grandes tumores podem começar a se romper, levando a uma perda de fatores de coagulação no sangue. O resultado pode ser alto risco de sangramento sério, o que é conhecido como coagulopatia consumptiva e pode ser de risco à vida.
Uma forma especial do neuroblastoma de ampla disseminação (conhecida como estágio 4S) ocorre somente durante os primeiros meses de vida. Nesta forma especial, o neuroblastoma se dissemina para o fígado, para a pele e/ou para a medula óssea (em quantidades pequenas). O fígado pode tornar-se muito grande. Apesar do fato do câncer já estar disseminado quando descoberto, o neuroblastoma em estágio 4S é muito tratável (frequentemente diminuindo ou desaparecendo sozinho), e quase todas as crianças com esta forma de neuroblastoma podem ser curadas.
Sinais ou sintomas causados por hormônios provenientes do tumor
O neuroblastoma é um dos poucos tipos de câncer em crianças que libera hormônios que podem causar problemas em tecidos e órgãos distantes, embora o câncer não tenha se disseminado para estes tecidos ou órgãos. Estes problemas são denominados síndromes paraneoplásicas.
Os sintomas das síndromes paraneoplásicas podem incluir:
• Diarreia constante
• Febre
• Pressão arterial alta (causando irritabilidade)
• Frequência cardíaca acelerada
• Avermelhamento (rubor) da pele
• Sudorese
Um sintoma incomum é denominado síndrome da opsoclonia-mioclonia-ataxia ou dos “olhos e pés dançantes”. Nesta situação, a criança apresenta movimentos oculares irregulares, rápidos (opsoclonia), espasmos musculares semelhantes a torções (mioclonia) e aparenta estar sem coordenação ao ficar em pé ou andar (ataxia). Pode apresentar também dificuldade em falar. Por motivos desconhecidos, tumores de neuroblastoma que podem causar esta síndrome tendem a ser de menor risco à vida do que outras formas da doença.
Como o neuroblastoma é diagnosticado?
Neuroblastomas são em geral descobertos como resultado de sinais ou sintomas que uma criança está apresentando. Se houver suspeita de um tumor, serão necessários testes para confirmar este diagnóstico.
Diagnóstico Precoce
O neuroblastoma pode ser descoberto precocemente?
Pesquisadores têm estudado se a triagem de lactentes para neuroblastoma pode encontrar estes tumores mais precocemente e levar a melhores resultados do tratamento. A triagem é um teste para uma doença, tal como câncer, em pessoas sem sintomas. Uma maneira de triar para neuroblastoma é testar a urina da criança para certas substâncias produzidas por tumores do tipo neuroblastoma (Para maiores informações sobre este teste de urina, ver a seção “Como o neuroblastoma é diagnosticado?”).
Os estudos não concluíram que o rastreamento de neuroblastoma seja útil. O teste em lactentes quando tinham 6 meses de idade não encontrou um número maior de tumores do que o que teria sido normalmente diagnosticado. Porém, a maioria destes tumores pertencia a um tipo que provavelmente desapareceria ou amadureceria em um tumor benigno por si só e que provavelmente nunca causaria quaisquer problemas. A triagem não reduziu o número de casos encontrados em estágios avançados ou salvou vidas.
Além disso, somente a metade das crianças identificadas por testes de triagem como possivelmente tendo neuroblastoma realmente apresenta um tumor que causaria problemas sérios. Esses resultados “falso-positivos” podem assustar desnecessariamente os pais e levar a testes e cirurgias que não seriam precisos em crianças cujos tumores desapareceriam ou amadureceriam por conta própria se deixados sozinhos.
Por esses motivos, a maioria dos especialistas não recomenda a triagem para neuroblastoma em lactentes que não apresentem risco aumentado da doença.
Em situações raras, o neuroblastoma é encontrado antes do nascimento durante uma ultrassonografia, um teste que emprega ondas sonoras para criar uma imagem dos órgãos internos de um feto. Ultrassonografias são geralmente realizadas para estimar a idade de um feto, predizer a data do nascimento e procurar certos defeitos de nascimento comuns. Melhorias na tecnologia do ultrassom ou outros métodos podem levar a testes pré-natais (antes do nascimento) mais precisos para esta doença.
O neuroblastoma é às vezes encontrado acidentalmente em crianças na primeira infância sem quaisquer sintomas durante testes efetuados para descobrir outras doenças da infância. Estas crianças terão geralmente um bom resultado e algumas podem nem mesmo necessitar tratamento.
Contudo, na maioria dos casos, o neuroblastoma é detectado pela primeira vez quando causa certos sintomas que revelam que a criança está doente.
Quais são as principais estatísticas sobre neuroblastoma?
O neuroblastoma é de longe o câncer mais comum em lactentes (abaixo de 1 ano de idade). É responsável por aproximadamente 7% de todos os cânceres infantis. A idade média no momento do diagnóstico é em torno de 1 a 2 anos. Em casos raros, o neuroblastoma é detectado por ultrassom, antes mesmo do nascimento. Quase 90% dos casos são diagnosticados até os 5 anos. O neuroblastoma é extremamente raro em pessoas acima de 10 anos de idade. Em cerca de 2 em 3 casos, a doença já se espalhou (metastizou) para outras partes do corpo quando é diagnosticada.
EXAMES
Exames de Sangue e Urina
Testes de catecolaminas no sangue e na urina
O neuroblastoma pode ser frequentemente constatado pela detecção de catecolaminas no sangue ou na urina. As células nervosas simpáticas normalmente liberam hormônios denominados catecolaminas, como epinefrina (adrenalina) e norepinefrina. Eventualmente o corpo as decompõe em metabólitos (pedaços menores), que então são passados para fora do corpo na urina.
Na maioria dos casos, as células do neuroblastoma produzem catecolaminas suficientes para serem detectadas por exames de sangue ou urina. Os 2 metabólitos de catecolaminas mais frequentemente medidos são:
• Ácido homovanílico (HVA)
• Ácido vanilmandélico (VMA)
Outros exames laboratoriais
O médico de seu filho provavelmente pedirá também outros exames de sangue para verificar contagens de células do sangue, a função hepática e renal e o balanço de sais (eletrólitos) no corpo. Uma análise da urina poderá também ser efetuada para verificar a função renal.
Exames por Imagem
Os exames por imagem empregam raios-x, campos magnéticos, ondas sonoras ou substâncias radioativas para criar imagens do interior do corpo. Os exames por imagem podem ser realizados por alguns motivos, incluindo:
• Ajudar a descobrir se uma área suspeita poderia ser cancerosa
• Saber o quanto o câncer possa ter se disseminado
• Ajudar a determinar se o tratamento foi eficaz
A maioria dos pacientes com câncer ou que possam apresentar câncer será submetida a um ou mais destes exames. Pacientes com neuroblastoma são em geral muito jovens, de modo que pode ser difícil realizar alguns destes exames. Pais e equipes médicas precisam ser muito pacientes.
Radiografias
O médico pode pedir uma radiografia torácica ou de outra parte do corpo como exame inicial se uma criança estiver apresentando sintomas, mas sem que esteja claro o que poderia os estar causando. No entanto, as imagens podem não ser suficientemente detalhadas para localizar tumores.
Se o neuroblastoma já tiver sido diagnosticado, radiografias podem ser úteis para examinar se o câncer se espalhou para os ossos. Uma radiografia da cabeça poderá ser efetuada para investigar se o câncer se disseminou para os ossos cranianos. Uma cintilografia com MIBG (metaiodobenzilguanidina) ou cintilografia óssea (descrito abaixo) é geralmente melhor para examinar os ossos no resto do corpo, mas radiografias podem ser utilizadas em lactentes, quando estes exames não forem possíveis. Uma radiografia torácica padrão pode ser realizada, se médicos suspeitarem que o tumor tenha invadido os pulmões, mas uma tomografia computadorizada (TC) ou imagem por ressonância magnética (IRM) podem mostrar a área mais detalhadamente.
Exame de tomografia computadorizada (TC ou CAT)
Os exames por TC representam frequentemente o primeiro teste utilizado para buscar a presença de neuroblastoma no abdômen, na pelve e no tórax.
O exame por TC é um teste com raios-x que produz imagens detalhadas em corte transversal de partes do corpo. Em vez de obter uma única imagem, como uma radiografia regular, o aparelho de TC pode captar muitas imagens à medida que gira em torno de seu/sua filho/filha enquanto ele ou ela estão deitados em uma mesa. Um computador então combina e transforma estas imagens em outras representando fatias da parte do corpo em estudo. Diferentemente de uma radiografia regular, o exame por TC cria imagens detalhadas dos tecidos moles no corpo.
Seu filho pode ter que beber uma solução de contraste e/ou nele ser introduzido um tubo IV (intravenoso) através do qual uma tinta corante é injetada. Isso ajuda a melhorar o contorno das estruturas no corpo. O contraste pode provocar algum rubor (sensação de calor, especialmente na face). Algumas pessoas são alérgicas e apresentam urticária. Raramente, reações mais sérias, como dificuldade de respirar ou pressão arterial baixa, podem ocorrer. Certifique-se de informar ao médico se seu filho sofre de quaisquer alergias ou se já apresentou uma reação a qualquer material de contraste utilizado para radiografias.
Os exames por TC podem demorar mais do que as radiografias regulares, mas não tanto como exames de Ressonância Magnética. Seu filho precisará permanecer sem se mexer em uma mesa, enquanto estes são realizados. Durante o exame, a mesa desliza para dentro e para fora do aparelho, uma máquina em forma de anel que envolve completamente a mesa. Algumas pessoas se sentem um pouco confinadas pelo anel no qual devem permanecer enquanto as imagens estão sendo capturadas. Em alguns casos, seu filho poderá ser sedado (receber medicamento que o torna sonolento), antes do exame, para diminuir a movimentação e ajudar a ter certeza de que as imagens saíram boas.
A TC espiral (conhecida também como TC helicoidal) é utilizada agora em muitos centros médicos. Este tipo de TC emprega uma máquina mais rápida que reduz a dose de radiação e rende imagens mais detalhadas.
Biópsia com agulha guiada por TC
Os exames por TC podem ser utilizados também para guiar com precisão uma agulha de biópsia até um tumor. Para esse procedimento, o paciente permanece na mesa de exame de TC, enquanto o radiologista introduz uma agulha de biópsia através da pele e em direção à massa. Os exames por TC são repetidos até que a agulha esteja no interior da massa. Uma amostra de biópsia por agulha fina ou amostra de biópsia por agulha de calibre maior é então removida e examinada sob um microscópio. Em crianças, este procedimento é sempre efetuado com anestesia geral (em que a criança está adormecida).
Exame de imagem por ressonância magnética (IRM)
Exames de IRM fornecem imagens detalhadas de tecidos moles no corpo. Mas este tipo de exame emprega ondas de rádio e magnetos fortes, em vez de raios-x, de modo que não há radiação envolvida. A energia emitida pelas ondas de rádio é absorvida pelo corpo e então liberada em um padrão formado pelo tipo de tecido do corpo e por certas doenças. Um computador traduz o padrão em uma imagem muito detalhada de partes do corpo. Um material de contraste, denominado gadolínio, pode ser injetado em uma veia antes do exame para visualizar melhor os detalhes.
Os exames de IRM são muito úteis para examinar o cérebro e a medula espinhal. Uma IRM pode ser ligeiramente melhor do que a TC para se avaliar a extensão do neuroblastoma, especialmente em torno da coluna vertebral, mas pode ser mais difícil para a criança.
Os exames de IRM demoram mais do que os da TC, muitas vezes durante até uma hora. Na maioria das máquinas de IRM, seu filho terá que permanecer no interior de um tubo estreito, que produz uma sensação de confinamento e pode ser estressante. Máquinas de IRM mais novas e mais abertas podem representar uma opção em alguns casos, mas ainda exigem que a criança permaneça sem se mexer por longos períodos de tempo. A máquina de IRM produz também um zumbido alto e ruídos tipo estalidos que podem ser perturbadores. Crianças mais jovens frequentemente são medicadas para ajudá-las a se manterem calmas ou mesmo dormirem durante o exame.
Ultrassom
A ultrassonografia emprega ecos de ondas sonoras para produzir imagens de órgãos ou massas internas. Um instrumento semelhante a um pequeno microfone, denominado transdutor, emite ondas de som e captura os ecos à medida que estes rebatem vindos de tecidos do corpo. Os ecos são convertidos por um computador em uma imagem em branco e preto sobre uma tela de computador.
O ultrassom é um exame bastante rápido e fácil que não envolve radiação, sendo este o motivo pelo qual é frequentemente um dos primeiros exames efetuados na suspeita de uma massa interna. No exame de ultrassom, a criança simplesmente deita-se sobre uma mesa (ou os pais seguram a criança), e um técnico move o transdutor sobre pele ao longo da parte do corpo em exame. Em geral, a pele é lubrificada com um gel antes.
Às vezes, um ultrassom é utilizado para descobrir massas no abdômen (Não é utilizado para massas no tórax porque as costelas bloqueiam as ondas sonoras). Esse exame também é capaz de detectar se os rins se tornaram inchados porque o fluxo de saída de urina foi bloqueado por linfonodos aumentados ou por uma massa. O ultrassom pode ser utilizado também para guiar a penetração de agulha de biópsia em um tumor suspeito para coletar uma amostra para testes. É especialmente útil para verificar se os tumores no abdômen estão encolhendo.
Cintilografia com MIBG
Este exame emprega uma forma da substância química metaiodobenzilguanidina (MIBG) que contém uma pequena quantidade de iodo radioativo. A MIBG é semelhante à norepinefrina, um hormônio produzido por células nervosas simpáticas. É injetada em uma veia e percorre a corrente sanguínea e, na maioria dos pacientes, se fixará a células de neuroblastoma em qualquer local no corpo. Diversas horas ou dias mais tarde, o corpo é examinado com uma câmera especial para examinar áreas que capturaram a radioatividade. Isso ajuda aos médicos a dizerem onde o neuroblastoma se encontra e se este já se disseminou para os ossos e/ou outras partes do corpo.
Este exame é preferido por muitos médicos como teste padrão em crianças com neuroblastoma. Pode ser repetido após o tratamento para conferir se este foi eficaz. Além disso, é bom saber se o tumor capta a MIBG porque, em alguns casos, essa molécula radioativa pode ser utilizada (em doses mais altas) para tratar o neuroblastoma (ver a seção “Radioterapia”).
Exame de tomografia por emissão de pósitrons (PET)
Em exame PET, uma substância radioativa (geralmente um tipo de açúcar relacionado à glicose, conhecido como FDG) é injetada no corpo. A quantidade de radioatividade utilizada é muito baixa. Como as células cancerosas estão crescendo muito rápido, elas absorvem grandes quantidades de açúcar radioativo. Uma câmera especial pode então criar uma imagem de áreas de radioatividade no corpo. A imagem não é finamente detalhada como em um exame de TC ou IRM, mas ainda pode fornecer informações úteis sobre o corpo inteiro.
Algumas máquinas mais modernas são capazes de realizar exame PET e de TC ao mesmo tempo (exame PET/TC). Isso permite que o médico compare áreas de radioatividade mais alta no PET com o aspecto mais detalhado daquela área na TC.
Cintilografia óssea
Um exame ósseo pode ajudar a mostrar se um câncer já possui metástases (disseminou) nos ossos, e pode fornecer uma imagem de todo o esqueleto de uma só vez. O neuroblastoma muitas vezes provoca dano ósseo, o qual uma cintilografia óssea é capaz de encontrar. Este teste era realizado de rotina, mas em alguns centros foi substituído pelo uso de exames com MIBG ou PET.
Neste teste, uma pequena quantidade de material radioativo de baixo nível (tecnécio 99) é injetada em uma veia. A substância se acumula em áreas de osso danificado por todo o esqueleto no decorrer de umas duas horas. Seu filho, então, fica deitado sobre uma mesa por cerca de 30 minutos enquanto uma câmara especial detecta a radioatividade e cria uma imagem do esqueleto. Crianças mais jovens podem receber um medicamento que as ajuda a se manterem calmas ou mesmo dormirem durante o teste.
Áreas de alterações ósseas ativas atraem a radioatividade e aparecem como “locais quentes” no esqueleto. Estas áreas podem sugerir a presença de câncer, mas outras doenças ósseas podem causar também o mesmo padrão. Para distinguir entre essas condições, outros exames de imagem, como radiografias planas ou exames de IRM, ou mesmo uma biópsia óssea poderia ser necessária.
Biópsias
Sinais e sintomas, testes laboratoriais e exames de imagem podem sugerir fortemente um neuroblastoma, mas uma biópsia (retirada de parte do tumor para visualização sob um microscópio e outros testes laboratoriais) é a única maneira para se ter certeza.
Durante uma biópsia, o médico retira uma amostra da massa tumoral. Em adultos, as biópsias são às vezes efetuadas com anestésico local (medicamento que adormece a área), mas em crianças, são mais frequentemente realizadas enquanto a criança está sob o efeito de anestesia geral (dormindo). Existem 2 principais tipos de biópsias:
• Biópsia incisional (aberta): Este tipo de biópsia é realizado cortando e retirando um pedaço do tumor através de uma abertura na pele.
• Biópsia com agulha (fechada): Para este tipo de biópsia, uma agulha oca é posicionada através da pele e para dentro do tumor. Se o tumor for profundo dentro do corpo, exames de TC ou por ultrassom podem ser utilizados para guiar a penetração da agulha no tumor.
As amostras da biópsia são então visualizadas sob um microscópio por um patologista.
Alguns casos de neuroblastoma são facilmente reconhecidos quando examinados por médicos com experiência em testar amostras de tumores infantis. Porém, em alguns casos, pode ser difícil a diferenciação entre outros tipos de câncer na infância.
Nessas situações, testes especiais, como imunohistoquímica, precisam ser realizados. Para este teste, uma parte da amostra é tratada com proteínas especiais (anticorpos) que se fixam a substâncias em células de neuroblastoma, mas não de outros cânceres. Substâncias químicas (corantes) são então adicionadas de modo que células contendo estas substâncias mudem de cor e possam ser facilmente vistas sob um microscópio. Isso permite que o patologista saiba que o tumor é um neuroblastoma.
Outros tipos de testes laboratoriais podem ser realizados também em amostras de neuroblastoma para ajudar a determinar a velocidade com a qual o tumor provavelmente crescerá. Alguns destes estão descritos na seção, “Como é feito o estadiamento do neuroblastoma?”.
Aspiração e biópsia de medula óssea
O neuroblastoma muitas vezes se dissemina para a medula óssea (as partes internas esponjosas de certos ossos). Se os níveis sanguíneos ou urinários de catecolaminas estiverem aumentados, então o achado de células cancerosas em uma amostra de medula óssea é suficiente para diagnosticar neuroblastoma (sem obter uma biópsia do tumor principal). Se o neuroblastoma já tiver sido diagnosticado por uma biópsia efetuada em outro local no corpo, o teste na medula óssea é realizado para ajudar a determinar a extensão da doença.
Aspiração e biópsia da medula óssea são realizados geralmente ao mesmo tempo. Na maioria dos casos, as amostras são coletadas da parte posterior de ambos os ossos pélvicos (do quadril).
Para uma aspiração de medula óssea, a criança deita-se sobre uma mesa (sobre o lado ou o abdômen). Depois da limpeza da pele que recobre o quadril, o médico adormece a área e a superfície com anestésico local, o que pode provocar uma picada ou sensação de ardor de curta duração. Mesmo com o anestésico local, a maioria dos pacientes ainda sente alguma dor momentânea quando a medula é retirada. Na maioria dos casos, a criança recebe também outros medicamentos para reduzir a dor ou mesmo para dormir durante o procedimento. Uma agulha oca e fina é então inserida dentro do osso e uma seringa é usada para sugar uma pequena quantidade se medula óssea líquida;
Uma biópsia da medula óssea é geralmente realizada logo depois da aspiração. Um pequeno pedaço de osso e de medula é retirado com uma agulha ligeiramente mais larga, que é torcida enquanto empurrada para penetrar no osso. A biópsia pode causar também alguma rápida dor. Uma vez realizada a biópsia, é aplicada pressão ao local para ajudar a parar qualquer sangramento.
Amostras da medula óssea são enviadas para um laboratório de patologia, onde serão examinadas e testadas quanto à presença de células cancerosas.
MARCADORES DE PROGNÓSTICO
Marcadores prognósticos são características específicas que ajudam a predizer se a previsão de cura da criança é melhor ou pior do que seria prevista apenas pelo estágio. Os marcadores abaixo são empregados para determinar o prognóstico de uma criança.
Histologia do tumor
A histologia do tumor é baseada em como as células do neuroblastoma se parecem sob o microscópico. Tumores que contenham um número maior de células e tecidos com aparência normais tendem a ter melhores prognósticos e são considerados como tendo histologia favorável. Tumores cujas células e tecidos aparentem mais anormais sob um microscópico tendem a ter prognóstico mais desfavorável e são identificados como portadores de histologia desfavorável.
Idade
Crianças mais jovens (abaixo de 12-18 meses) são mais prováveis de serem curadas do que crianças de mais idade.
Ploidia do DNA
A quantidade de DNA em cada célula, conhecida como ploidia, pode ser medida por técnicas laboratoriais especiais, como citometria de fluxo e citometria de imagem. Células de neuroblastoma com aproximadamente a mesma quantidade de DNA que células normais são classificadas como diploides. Células com quantidades aumentadas de DNA são denominadas hiperdiploides.
Em lactentes, células hiperdiploides tendem a ser associadas com estágios mais precoces da doença, respondem melhor à quimioterapia e geralmente predizem um prognóstico (resultado) mais favorável do que células diploides.
Amplificações do gene MYCN
MYCN é um oncogene, um gene que é importante para regulação do crescimento celular. Alterações destes genes podem fazer com as células cresçam e se dividam muito rapidamente, tal como ocorre com células cancerosas.
Pesquisadores descobriram que neuroblastomas com cópias demais (amplificação) do oncogene MYCN tendem a crescer mais rapidamente e são menos propensos ao amadurecimento. O prognóstico de crianças cujos neuroblastomas apresentam esta característica tende a ser pior do que o de outras crianças com neuroblastoma.
Outros marcadores
Estes marcadores não são utilizados para ajudar a determinar grupos de risco neste momento (ver abaixo), mas ainda são importantes e podem influenciar a decisão médica sobre o modo de tratamento de uma criança com neuroblastoma.
Citogenética: Neste teste laboratorial, o número de cromossomos em cada célula é contado sob um microscópio, e as anormalidades cromossômicas são descritas. Células normais possuem 46 cromossomos (2 conjuntos de 23), os quais são formados por DNA e proteína. Neuroblastomas com números normais de cromossomos tendem a crescer e se espalhar mais rapidamente do que aqueles com cromossomos extras.
Células que têm certas partes dos cromossomos 1 ou 11 faltando (conhecidas como deleções 1p ou deleções 11q), também podem predizer um prognóstico menos favorável. Acredita-se que estas partes de cromossomos, que estão ausentes em muitos pacientes com neuroblastoma, possam conter importantes genes supressores de tumor, porém mais estudos são necessários para confirmar esse dado.
Ter uma parte extra do cromossomo 17 (ganho 17q) também está vinculado a um pior prognóstico. Isso provavelmente significa que existe um oncogene nesta parte do cromossomo 17.
Compreender a importância de deleções/ganhos em cromossomos é uma área ativa da pesquisa sobre neuroblastomas.
Receptores de neurotrofinas (fator de crescimento neural): Estas substâncias estão presentes sobre a superfície de células nervosas normais e em algumas células de neuroblastoma. Elas normalmente permitem que as células reconheçam neurotrofinas – substâncias químicas semelhantes a hormônios que ajudam as células normais a amadurecerem.
Neuroblastomas que contenham mais de certos receptores de neurotrofinas, especialmente o receptor de crescimento neural denominado TrkA, podem ter melhor prognóstico.
Marcadores séricos: Níveis séricos (do sangue) de certas substâncias podem ser utilizados para ajudar a predizer o prognóstico.
Células de neuroblastoma liberam ferritina, uma substância química que integra de modo importante o metabolismo normal do ferro no corpo, no sangue. Pacientes com altos níveis de ferritina tendem a ter pior prognóstico.
Enolase neuronal específica (NSE) e desidrogenase láctica (LDH) são produzidas por diversos tipos de células normais, bem como por células do neuroblastoma. Níveis elevados de NSE e LDH no sangue são muitas vezes associados com pior previsão em crianças com neuroblastoma.
Uma substância na superfície de muitas células nervosas, conhecida como gangliosídeo GD2, está frequentemente aumentada no sangue de pacientes com neuroblastoma. Embora a utilidade de GD2 para predizer prognósticos seja desconhecida, este pode vir a ser mais útil em tratar o neuroblastoma (ver a seção, “Quais são as novidades na pesquisa e no tratamento do neuroblastoma?”).
Como o neuroblastoma é tratado?
Estas informações representam as opiniões dos médicos e enfermeiros que atuam no Conselho Editorial do Banco de Dados de Informação sobre Câncer da American Cancer Society. Estas opiniões estão fundamentadas na interpretação que fazem de estudos publicados em periódicos médicos, bem como em sua própria experiência profissional.
As informações sobre o tratamento neste documento não se destinam a ser orientação médica que substitua a especialização e o juízo de sua equipe para o tratamento de câncer. A intenção pretendida é ajudar você e a sua família na tomada de decisões esclarecidas, junto com seu médico.
Seu médico pode ter motivos para sugerir um plano de tratamento diferente destas opções terapêuticas gerais. Não hesite em lhe fazer perguntas sobre suas opções de tratamento.
Tratar neuroblastoma é complexo e muitas vezes requer o conhecimento específico de diferentes médicos, enfermeiros e de outros profissionais de saúde. Oncologistas pediátricos, cirurgiões, radio-oncologistas e enfermeiros com especialização em oncologia se reunirão para planejar o tratamento mais eficaz.
A abordagem para o tratamento de neuroblastoma depende do estágio do câncer, da idade da criança e de outros fatores, como os marcadores prognósticos citados previamente. Os tipos de tratamento utilizados podem incluir:
• Cirurgia
• Quimioterapia
• Terapia com retinoides
• Radioterapia
• Quimioterapia/radioterapia em alta dose e transplante de células-tronco
• Imunoterapia
Em muitos casos, mais de um tipo de tratamento é necessário.
As poucas seções seguintes descrevem os tipos de tratamento utilizados para neuroblastomas. A esta se segue uma discussão sobre quando estes tratamentos são utilizados em diferentes situações.
Biópsia cirúrgica (aberta)
Antes que o tratamento se inicie, os médicos podem efetuar uma biópsia cirúrgica para retirar amostras do tumor a serem examinadas sob um microscópico e para outros testes laboratoriais. Se o tumor estiver situado no abdômen, o cirurgião poderá efetuar a biópsia com o auxílio de um laparoscópio. Este instrumento é um tubo fino e longo com uma câmara de vídeo diminuta na extremidade. É inserido no abdômen através de uma pequena incisão para permitir ao cirurgião visualizar o interior. O cirurgião faz então uma segunda pequena incisão para atingir o interior do abdômen com instrumentos finos e longos e retirar um pequeno pedaço de tumor.
Cirurgia
A cirurgia pode ser utilizada tanto para diagnosticar como para tratar o neuroblastoma. Para tumores menores que não se disseminaram, a cirurgia é frequentemente o único tratamento que é necessário.
Cirurgia como tratamento
Depois que o neuroblastoma é diagnosticado, a cirurgia é muitas vezes utilizada para tentar remover tanto tumor quanto possível. Em alguns casos, a cirurgia consegue retirar o tumor inteiro e levar à cura.
Durante a operação, o cirurgião cuidadosamente procura por sinais de disseminação do tumor para outros órgãos. Linfonodos próximos (pequenas coleções de células do sistema imune para as quais com frequência o tumor primeiro se espalha) são retirados e examinados sob um microscópico para detectar células cancerosas.
Se possível, o cirurgião removerá o tumor inteiro. Isso é menos provável ser possível se o tumor estiver próximo de estruturas vitais ou envolvido em torno de grandes vasos sanguíneos. Mesmo se o tumor não puder ser completamente extraído, o tratamento com quimioterapia (e às vezes radioterapia), depois da retirada da maior parte do câncer, pode resultar em cura. Algumas vezes, a cirurgia é repetida depois de outros tratamentos (quimioterapia e/ou radioterapia) para verificar os resultados da terapia e para retirar qualquer câncer restante se possível. Se o tumor for muito grande, quimioterapia pode ser empregada antes da cirurgia. Com isso, o tumor pode retrair-se e facilitar a sua remoção completa.
Possíveis riscos e efeitos colaterais da cirurgia
Tal como acontece com todas as formas de tratamento, a cirurgia acarreta alguns riscos de complicações. Estas dependem da localização e da extensão da operação e da saúde prévia da criança. Complicações sérias, embora raras, podem incluir problemas com a anestesia, sangramento excessivo, infecções na ferida e dano a vasos sanguíneos, rins, outros órgãos ou a nervos. A maioria das crianças sentirá alguma dor por um tempo após a operação, mas isso pode em geral ser rapidamente ajudado com medicamentos se necessários.
Imunoterapia
Anticorpos monoclonais são versões produzidas pelo homem de proteínas do sistema imune, cuja produção pode ser direcionada para atacar um alvo muito específico. Essas moléculas podem ser injetadas no sangue para buscar e atacar células cancerosas.
Um anticorpo monoclonal, denominado ch.14.18, foi desenvolvido para atacar o gangliosídeo GD2, uma substância encontrada na superfície de muitas células de neuroblastoma. Este anticorpo é administrado muitas vezes junto com citocinas (hormônios do sistema imune), como GM-CSF e interleucina-2 (IL-2). Essa combinação pode ajudar o sistema imune de seu filho a reconhecer e destruir células do neuroblastoma.
Este anticorpo faz parte agora do tratamento de rotina para muitas crianças com neuroblastoma de alto risco, frequentemente depois de um transplante de células-tronco.
Possíveis efeitos colaterais
Os efeitos colaterais de ch.14.18 podem incluir dor neuropática, extravasamento de líquido no corpo (que pode leva abaixar a pressão arterial, acelerar a frequência cardíaca, dificultar a respiração e provocar inchaço) e reações alérgicas.
Quimioterapia
A quimioterapia emprega medicamentos contra câncer, geralmente administrados na veia (intravenoso). Os medicamentos penetram na corrente sanguínea e circulam por todo o corpo para atingir e destruir as células de câncer. Isso torna a quimioterapia útil para tratar neuroblastoma que tenha se disseminado para os linfonodos, a medula óssea, o fígado, os pulmões ou outros órgãos.
Algumas crianças com neuroblastoma são tratadas com quimioterapia, administrada antes da cirurgia (quimioterapia neoadjuvante) ou depois da cirurgia (quimioterapia adjuvante). Em outros casos, especialmente quando o câncer já se espalhou demais para ser completamente removido por cirurgia, a quimioterapia é o principal tratamento.
A maioria das crianças com neuroblastoma necessitará se submeter à quimioterapia. Na maior parte dos casos, diversos medicamentos são fornecidos. Os principais medicamentos utilizados para tratar crianças com neuroblastoma incluem:
• Ciclofosfamida ou ifosfamida
• Cisplatina ou carboplatina
• Vincristina
• Doxorrubicina (Adriamicina)
• Etoposídeo
• Topotecano
A combinação mais comum de medicamentos para tratar neuroblastoma consiste em carboplatina (ou cisplatina), ciclofosfamida, doxorrubicina e etoposídeo, mas outros podem ser utilizados. Para crianças no grupo de alto risco, combinações maiores de medicamentos são utilizadas, e suas doses são mais altas, e que podem ser seguidas por transplante de células-tronco (este procedimento está descrito mais adiante).
Os médicos administram a quimioterapia em ciclos, o que consiste em tratamento em uns poucos dias consecutivos, seguido por um período de tempo sem tratamento para permitir que o corpo se recupere. Os ciclos são tipicamente repetidos a cada 3 ou 4 semanas. A duração total do tratamento depende do grupo de risco ao qual a criança pertence – grupos de risco mais alto requerem em geral tratamento mais longo.
Possíveis efeitos colaterais da quimioterapia
Medicamentos quimioterápicos atuam atacando células em rápida divisão, sendo este o motivo porque atuam contra células cancerosas. Porém, outras células no corpo, como aquelas presentes na medula óssea, no revestimento da boca e dos intestinos e os folículos pilosos, também se dividem rapidamente. Estas células provavelmente serão também afetadas pela quimioterapia, o que leva a efeitos colaterais.
Crianças parecem ter vantagem sobre adultos no que diz respeito à quimioterapia. Os efeitos colaterais que sofrem tendem a ser menos graves e sua recuperação, mais rápida. Um benefício resultante é que os médicos podem administrar doses altas de quimioterapia, necessárias para eliminar o tumor.
Os efeitos colaterais da quimioterapia dependem do tipo e da dose de medicamentos e da duração de tempo na qual são tomados. Efeitos colaterais gerais de medicamentos quimioterápicos podem incluir:
• Queda de cabelo
• Feridas na boca
• Perda de apetite
• Náusea e vômitos
• Diarreia
• Maior chance de sofrer infecções (que se deve a baixas contagens de leucócitos)
• Facilidade em se machucar e sangrar
• Fadiga (que se deve a baixas contagens de hemácias)
A maioria destes efeitos colaterais é de curta duração e tende a desaparecer depois que o tratamento é finalizado. Com frequência, existem maneiras para diminuir estes efeitos colaterais. Por exemplo, podem ser fornecidos medicamentos que ajudem a prevenir ou a reduzir a náusea e os vômitos. Certifique-se de discutir quaisquer dúvidas que tenha sobre efeitos colaterais com a equipe de tratamento do câncer.
Junto com os efeitos listados acima, alguns outros são específicos de certos medicamentos:
Ciclofosfamida e ifosfamida podem provocar lesões na bexiga. Essa ocorrência pode ser evitada ou minimizada administrando estes medicamentos com bastante líquido e incluindo um medicamento denominado mesna, que ajuda a proteger a bexiga. Estes medicamentos são capazes também de danificar os ovários ou os testículos e podem afetar a fertilidade (a capacidade de procriar).
Doxorrubicina pode causar lesão ao coração. Os médicos tentam reduzir esse risco tanto quanto possível ao não administrarem mais do que as doses recomendadas de doxorrubicina e verificando o coração com um exame denominado ecocardiograma (um ultrassom do coração) durante o tratamento. Este medicamento pode provocar também lesão na pele se extravasar da veia durante a administração.
Cisplatina e carboplatina podem afetar os rins. Fornecer bastante líquido pode ajudar a reduzir esse risco. Estes medicamentos podem afetar também a audição em alguns casos. Esse problema pode ser verificado pelo médico de seu filho com testes de audição (audiogramas) durante ou depois do tratamento.
Vincristina pode provocar lesões nos nervos. Alguns pacientes podem sentir formigamento e dormência, especialmente nas mãos e nos pés.
Em alguns casos, a quimioterapia pode ter também efeitos colaterais em prazo mais longo. Por exemplo, alguns medicamentos utilizados para tratar neuroblastoma podem aumentar o risco do desenvolvimento mais tardio de leucemia mieloide aguda (LMA), um tipo câncer do sangue. Embora seja sério, este risco não é comum, e a importância da quimioterapia no tratamento do neuroblastoma supera de longe este risco. Para mais informações sobre os possíveis efeitos do tratamento em longo prazo, ver a seção “O que acontece depois do tratamento para o neuroblastoma?”
Quimioterapia/Radioterapia
Quimioterapia/radioterapia em altas doses e transplante de células-tronco para neuroblastoma
Este tipo de tratamento é frequentemente utilizado em crianças com neuroblastoma de alto risco, que provavelmente não serão curadas com outros tratamentos. Este tratamento envolve administrar altas doses de quimioterapia (mais altas do que poderiam ser fornecidas com segurança de outra forma) e/ou de radioterapia (irradiação de corpo inteiro ou MIBG em alta dose) e, em seguida, repor as células da medula óssea do corpo, que foram mortas pelo tratamento. No passado, este tipo de tratamento era comumente designado transplante de medula óssea.
A medula óssea é a parte interna esponjosa de alguns ossos, onde novas células vermelhas, brancas e plaquetas são formados. As células vermelhas transportam oxigênio para todas as partes do corpo. As células brancas fazem parte do sistema imune, que combate as infecções. As plaquetas são necessárias para interromper o sangramento causado por cortes e arranhões.
A quimioterapia e alguns tipos de radiação podem afetar células-tronco formadoras de sangue na medula óssea (Estas são as células que produzem os diferentes tipos de células sanguíneas). Embora possam ser mais eficazes em tratar tumores, os tratamentos mais intensos não podem ser fornecidos, pois poderiam causar dano grave à medula óssea, levando a déficits de células sanguíneas que acarretam risco à vida.
Os médicos tentam contornar este problema, administrando à criança uma infusão de células-tronco formadoras de sangue depois do tratamento. Este procedimento é conhecido como transplante de células-tronco do sangue periférico (PBSCT).
O que o procedimento envolve
A primeira etapa em um PBSCT é coletar, ou “colher”, as células-tronco produtoras de sangue da própria criança para utilizar mais tarde. No passado, as células-tronco eram frequentemente coletadas da medula óssea da criança, o que exigia perfurar pequenos orifícios em certos ossos. Contudo, os médicos descobriram que células-tronco podem ser coletadas da corrente sanguínea durante um procedimento conhecido como aférese. O procedimento é semelhante a doar sangue, mas em vez do sangue ir para uma bolsa coletora, via para uma máquina especial que filtra e retira as células-tronco e devolve as outras partes do sangue de volta para o corpo da pessoa. Esse processo pode ser repetido durante alguns dias. As células-tronco são então congeladas até o transplante.
Depois das células-tronco terem sido coletadas, a criança recebe quimioterapia em alta dose. Isso destrói as células cancerosas no corpo, mas também as células normais na medula óssea. Quando o tratamento é concluído, as células-tronco do paciente são descongeladas e devolvidas para o corpo em um processo semelhante a uma transfusão normal de sangue. As células-tronco viajam através da corrente sanguínea e se alojam na medula óssea. Durante as 3 ou 4 semanas seguintes, as células-tronco começam a produzir novas células sanguíneas sadias na medula óssea.
Até que isso ocorra, a criança está em alto risco de infecção por apresentar baixa contagem de leucócitos, bem como de sangramento por baixa contagem de plaquetas. Medidas de proteção são adotadas, para evitar a ocorrência de infecções, como filtros de ar especiais no quarto de hospital e fazer com que os visitantes vistam roupas protetoras. Transfusões de sangue e de plaquetas e tratamento com antibióticos IV podem ser utilizados também para ajudar a prevenir ou tratar infecções ou problemas de sangramento.
Os pacientes geralmente permanecem no hospital em isolamento visando proteção (vigilância contra a exposição a germes), até que parte de sua contagem de células brancas (conhecida como a contagem absoluta de neutrófilos ou CAN) se eleve para acima de 500. A alta do hospital pode ser permitida quando a contagem absoluta de neutrófilos estiver próxima de 1.000. A criança é então acompanhada em uma clínica ambulatorial quase todos os dias por muitas semanas. As contagens de plaquetas muitas vezes demoram mais para retornarem a um nível seguro, portanto, as transfusões de plaquetas podem ser administradas no acompanhamento ambulatorial.
O transplante de células-tronco é um tratamento complexo. Se o médico considerar que seu filho possa se beneficiar de um transplante, o melhor lugar a ser realizado é em um centro de câncer reconhecido nacionalmente, onde a equipe possui experiência em realizar o procedimento e controlar o período de recuperação.
Possíveis efeitos colaterais
Possíveis complicações e efeitos colaterais precoces podem ser sérios e são basicamente os mesmos que os causados por quimioterapia (ver a seção “Quimioterapia” deste documento) ou radioterapia em alta dose. Os efeitos colaterais devem-se ao dano à medula óssea e a outros tecidos do corpo que se dividem rapidamente. Estes efeitos podem incluir baixas contagens de células sanguíneas (acompanhadas por cansaço e risco aumentado de infecção e sangramento), náusea, vômitos, perda de apetite, feridas na boca e queda de cabelos, entre outros.
Um dos efeitos imediatos mais comuns e sérios é maior risco de infecção. Antibióticos são frequentemente administrados para tentar prevenir essa ocorrência. Outros efeitos colaterais, como baixa contagem de hemácias e de plaquetas, podem exigir transfusões de derivados do sangue ou outros tratamentos.
Algumas complicações e efeitos colaterais podem persistir por longo tempo ou podem não ocorrer até anos depois do transplante. Por exemplo, o tratamento pode afetar o desenvolvimento ósseo, a fertilidade ou níveis hormonais, e pode aumentar o risco de desenvolver outro câncer mais tarde na vida. Certifique-se de conversar com o médico de seu filho antes do transplante para informar-se sobre possíveis efeitos tardios que seu filho pode apresentar.
Radioterapia
A radioterapia emprega raios ou partículas de alta energia para eliminar as células cancerosas. A radiação é, às vezes, uma parte necessária do tratamento, mas em virtude dos possíveis efeitos colaterais tardios em crianças, é evitada quando possível. Dois tipos de radioterapia podem ser utilizados para tratar crianças com neuroblastoma.
– Radioterapia por feixe externo
Este tipo de radioterapia focaliza a radiação sobre o câncer a partir de uma fonte fora do corpo. Existem diversas situações nas quais este tipo de radioterapia poderia ser utilizado:
• Para destruir células do neuroblastoma que permanecem depois da cirurgia e quimioterapia
• Para tentar reduzir o tamanho do tumor antes da cirurgia, tornando mais fácil sua extração no procedimento cirúrgico
• Para tratar tumores maiores que estejam causando problemas sérios (como dificuldade em respirar) e que não respondem rapidamente à quimioterapia
• Como parte do esquema terapêutico (junto com quimioterapia em alta dose) antes de um transplante de células-tronco em crianças com neuroblastoma de alto risco
• Para ajudar a aliviar a dor causada por neuroblastoma avançado
A radiação é direcionada tipicamente ao próprio tumor, mas em alguns caso pode também visar outras partes do corpo para reduzir o risco de disseminação do câncer. Quando administrada por todo o corpo, a radiação é conhecida como irradiação de corpo inteiro (ICI).
Antes que o tratamento inicie, a equipe da radiação obtém medidas cuidadosas com auxílio de exames de imagem, tais como exames de IRM, para determinar os ângulos corretos para direcionar os feixes de radiação e a dose apropriada de radiação.
A radioterapia é muito semelhante a submeter-se a uma radiografia, mas a dose de radiação é muito mais alta. Para cada sessão, seu filho deita-se sobre uma mesa especial enquanto uma máquina administra a radiação a partir de um ângulo preciso. O tratamento não é doloroso.
A duração real do tratamento é de somente alguns minutos, mas o tempo para preparação – posicionar corretamente seu filho para o tratamento – geralmente dura mais. Crianças pequenas podem receber medicamentos que as façam dormir de modo que não se movam durante o tratamento. O número de sessões de radioterapia dependerá da situação.
Possíveis efeitos colaterais: Os efeitos colaterais da radioterapia dependem da dose e do alvo ao qual a radiação é direcionada.
Efeitos colaterais em curto prazo da radioterapia externa podem incluir reações cutâneas leves, náusea, diarreia ou cansaço. Com frequência, estes efeitos desaparecem em pouco tempo. Converse com o médico de seu filho sobre os possíveis efeitos colaterais, pois existem maneiras para aliviar alguns destes. A radiação pode também fazer com que os efeitos colaterais da quimioterapia piorem.
A radioterapia pode interferir com o crescimento de tecidos sadios do corpo, inclusive dos ossos, e pode aumentar o risco de desenvolver outros cânceres mais tarde. A fim de diminuir o risco de efeitos sérios tardios provocados pela radiação, os médicos tentam usar a dose mais baixa de radioterapia que seja ainda eficaz.
– Radioterapia com MIBG
Como descrito na seção “Como o neuroblastoma é diagnosticado?”, MIBG é uma substância química semelhante à norepinefrina, a qual é produzida por células nervosas simpáticas. Uma forma levemente radioativa de MIBG é às vezes injetada na corrente sanguínea como parte de um teste de imagem para identificar células de neuroblastoma no corpo.
Uma forma mais altamente radioativa de MIBG é utilizada também para tratar alguns pacientes com neuroblastoma avançado, muitas vezes junto com outros tratamentos. Uma vez injetado na corrente sanguínea, o MIBG vai para os sítios de tumores em qualquer local no corpo, onde libera sua radiação. A criança necessitará permanecer em uma sala especial por alguns dias depois da injeção, até que a maior parte da radiação tenha deixado o corpo.
Possíveis efeitos colaterais: A terapia com MIBG pode causar às vezes náusea e vômitos. Além disso, pode reduzir a contagem de células do sangue por seus efeitos sobre a medula óssea. Em casos raros, pode elevar a pressão arterial por um curto período de tempo. Por conter iodo, o MIBG pode se acumular na glândula tireoide no pescoço, capaz de resultar às vezes em níveis baixos do hormônio da tireoide no corpo.
Terapia com retinoides para neuroblastoma
Retinoides são substâncias químicas que são relacionadas com a vitamina A. São conhecidos como agentes de diferenciação por acreditar-se que ajudem algumas células cancerosas a amadurecerem (diferenciarem-se) em células normais.
Em crianças com neuroblastoma de alto risco, o tratamento com um retinoide denominado ácido 13-cis retinoico (isotretinoína) reduz o risco de recorrência após quimioterapia em alta dose e transplante de células-tronco. A maioria dos médicos recomenda 6 meses de ácido 13-cis retinoico (tomado em forma de cápsula) uma vez concluído o transplante.
Pesquisadores estão atualmente tentando desenvolver retinoides mais eficazes e definir a função exata dessa abordagem no tratamento do neuroblastoma.
Possíveis efeitos colaterais
O efeito colateral mais comum do ácido 13-cis retinoico é o ressecamento e fissuramento dos lábios. Pele e olhos ressecados são possíveis também, como o são sangramentos nasais e alterações nas unhas.
Tratamento por Grupo
Tratamento de neuroblastoma por grupo de risco
O tratamento para neuroblastoma baseia-se em grande medida no grupo ao qual uma criança se enquadre.
Baixo risco
Crianças em baixo risco frequentemente requerem somente cirurgia como o único tratamento. Mesmo em casos em que alguma parte do neuroblastoma é deixada atrás depois da cirurgia, a criança pode ser vigiada cuidadosamente sem tratamento adicional porque o tumor restante muitas amadurecerá ou desaparecerá por sua própria conta.
A quimioterapia é tipicamente administrada depois da cirurgia se muito do tumor não puder ser removido ou se este apresentar algumas características desfavoráveis. Um esquema quimioterápico comum é uma combinação de carboplatina, ciclofosfamida, doxorrubicina e etoposídeo. Porém, outras combinações poderão ser utilizadas.
Para aquelas poucas crianças com sintomas provocados por um tumor que não pode ser tratado de modo seguro imediatamente com cirurgia, um ciclo curto de quimioterapia poderia ser administrado. Por exemplo, se o tumor estiver pressionando a medula espinhal ou afetando a respiração, a quimioterapia pode ser utilizada para encolher o tumor e controlar os sintomas. A radioterapia pode ser necessária se a quimioterapia não retrair o tumor com a velocidade necessária.
Lactentes com a doença no estágio 4S e sem sintomas podem muitas vezes ser vigiados cuidadosamente sem tratamento, uma vez que estes cânceres tipicamente amadurecem ou desaparecem sozinhos. Se o tumor fizer com que o fígado aumente de volume, o que pode acarretar risco à vida para lactantes muito jovens, quimioterapia menos intensa pode ser utilizada para encolher o tumor. A radioterapia pode ser utilizada se a quimioterapia não retrair de imediato o fígado.
Risco intermediário
A cirurgia é uma parte importante do tratamento para crianças em risco intermediário, mas, raramente é suficiente sozinha. Tipicamente, são administrados de 4 a 8 ciclos (em torno de 12 a 24 semanas) de quimioterapia às crianças antes ou depois da cirurgia. Os medicamentos quimioterápicos utilizados são normalmente os mesmos que para a doença de baixo risco, embora as doses possam ser mais altas. A radioterapia pode ser empregada se a quimioterapia não surtir efeito.
Se quimioterapia for utilizada antes da cirurgia, uma “cirurgia de revisão” poderá ser realizada para examinar se há qualquer resto do câncer e, se presente, retirá-lo se possível. Esse procedimento pode ser seguido por radioterapia, se necessário.
Alto risco
Crianças em alto risco requerem tratamento mais agressivo, o que frequentemente inclui uma combinação de quimioterapia, cirurgia e radiação. O tratamento é muitas vezes dividido em 3 fases.
Indução: A meta desta fase é fazer com que o câncer entre em remissão, destruindo ou retirando tanto do tumor quanto possível. O tratamento em geral se inicia com quimioterapia, empregando mais medicamentos e a doses mais altas do que é utilizado em outros grupos de risco. A cirurgia pode ser realizada em seguida para tentar retirar quaisquer tumores que sejam ainda visíveis.
Consolidação: Nesta fase, o tratamento é mais intensivo para tentar se livrar de quaisquer células cancerosas que restem no corpo. Quimioterapia em alta dose é administrada (muitas vezes junto com radioterapia), seguido por transplante de células-tronco.
Manutenção: Esta fase de tratamento é fornecida para tentar reduzir a probabilidade de que o câncer retorne. O medicamento retinoide, ácido 13-cis retinoico (isotretinoína) é frequentemente administrado por 6 meses, depois que os outros tratamentos tiverem concluído. Adicionalmente, imunoterapia com o anticorpo monoclonal ch14.18, junto com citocinas ativadoras do sistema imune (GM-CSF e IL-2) são com frequência administrados também.
Terapia Complementar
Terapias complementares e alternativas para neuroblastoma
Quando seu filho tem câncer, você provavelmente ouvirá muitas maneiras para tratar seu câncer ou para aliviar sintomas que seu médico não tenha citado. Todos, de amigos e família a grupos na Internet e sites na Rede, podem oferecer ideias para o quê poderia ajudá-lo. Esses métodos podem incluir vitaminas, fitoterápicos e dietas especiais, ou outros como acupuntura ou massagem, para citar alguns. Consulte sempre o médico responsável pelo tratamento antes de qualquer ação.
O que são exatamente terapias complementares e alternativas?
Nem todos usam estes termos da mesma maneira, e são utilizados para se referirem a muitos diferentes métodos, de modo que podem provocar confusão. Utilizamos complementar para nos referirmos a tratamentos que são utilizados juntos com seu tratamento médico regular. Tratamentos alternativos são utilizados em vez de um tratamento médico do doutor.
Métodos complementares: A maioria dos métodos de tratamento complementar não é oferecida como uma cura para o câncer. São empregados, principalmente, para ajudar a pessoa com câncer a se sentir melhor. Alguns dos métodos que são utilizados junto com o tratamento regular são: arteterapia e terapia com brincadeiras para reduzir o estresse; acupuntura para ajudar a aliviar a dor; ou chá de hortelã para aliviar a náusea. Alguns métodos complementares são conhecidos por ajudar, enquanto outros não foram testados. Alguns foram comprovados não ser úteis, e uns poucos demonstraram mesmo serem nocivos.
Tratamentos alternativos: Tratamentos alternativos podem ser oferecidos como curas para o câncer. A segurança e a eficácia destes tratamentos não foram comprovadas em estudos clínicos. Alguns destes métodos podem representar um perigo, ou terem efeitos de risco à vida. Mas o maior perigo na maioria dos casos é que seu filho pode perder a oportunidade de ser ajudado pelo tratamento médico padrão. Atrasos ou interrupções em tratamento médicos podem permitir mais tempo ao câncer para crescer e tornar menos provável que o tratamento ajude.
Descobrindo mais
É fácil ver o motivo porque pais com filhos portadores de câncer consideram métodos alternativos. Você quer fazer tudo que pode para ajudar a combater o câncer, e a ideia de um tratamento sem ou com poucos efeitos colaterais parece ser fantástica. Às vezes, tratamentos médicos como a quimioterapia podem ser difíceis de fazer, ou podem demorar muito para funcionar. Mas, a verdade é que a maioria destes tratamentos alternativos não foi testada e comprovou funcionar no tratamento de câncer.
Ao considerar as opções de seu filho, abaixo, são apresentados 3 importantes passos que você pode tomar:
• Procure por “sinais de alerta” que sugiram fraude. O método promete curar todos ou quase todos os cânceres? Disseram-lhe para não usar tratamentos médicos regulares? O tratamento é “secreto” e somente pode ser administrado por certos profissionais ou em outro país?
• Converse com o médico ou o enfermeiro de seu filho sobre qualquer método que você esteja considerando.
A escolha é sua
A decisão sobre como tratar seu filho é sempre sua. Se você quiser usar um tratamento fora do padrão, aprenda tudo que possa sobre o método e converse com o médico de seu filho a respeito. Com boas informações e o suporte da equipe de tratamento de saúde, você pode ser capaz de usar com segurança os métodos que possam ajudar ao mesmo tempo em que evitar aqueles que poderiam ser prejudiciais.
NEUROBLASTOMA RECORRENTE
Neuroblastoma recorrente – E se o neuroblastoma voltar?
Infelizmente, às vezes, o neuroblastoma pode retornar após a terapia inicial. Isso é conhecido como recorrência ou recidiva. O tratamento nesse ponto dependerá de muitos fatores, inclusive o grupo de risco inicial, o local onde o câncer recorre e quais tratamentos foram utilizados.
Para neuroblastomas de risco intermediário ou baixo cuja recorrência seja na mesma área em que iniciaram, pode ser eficaz cirurgia associada ou não com quimioterapia.
Para cânceres de risco mais alto ou aqueles que recorrem em partes distantes do corpo, o tratamento é geralmente mais intenso, e poderá incluir uma combinação de quimioterapia, cirurgia e radioterapia (como radioterapia com MIBG). A quimioterapia poderia incluir medicamentos que não foram utilizados durante o tratamento inicial. Em alguns casos de recidiva, tratamento intensivo com quimioterapia/radioterapia em alta dose, seguido por transplante de células-tronco, pode ser utilizado. Considerando que estes cânceres são de difícil tratamento, testes clínicos de tratamentos experimentais, como anticorpos monoclonais ou novos medicamentos anticâncer, podem ser outra opção razoável (Ver a seção, “Quais são as novidades na pesquisa e no tratamento do neuroblastoma?”).
CUIDADOS PÓS TRATAMENTO
O que acontece após o tratamento para o neuroblastoma?
Muitas crianças com neuroblastoma têm uma boa probabilidade de sobrevida duradoura depois do tratamento.
Após o tratamento para o neuroblastoma, as principais preocupações para a maioria das famílias são os efeitos imediatos e tardios do tumor e de seu tratamento, e preocupações sobre a possível recorrência do tumor.
É certamente compreensível querer colocar para trás o tumor e seu tratamento e retornar a uma vida que não gire em torno de câncer. Mas, é importante perceber que os cuidados de acompanhamento representam uma parte central do processo que oferece a seu filho a melhor oportunidade para recuperação e sobrevida longa.
Exames de acompanhamento
Após o tratamento, o médico provavelmente pedirá testes de acompanhamento, os quais poderão incluir testes laboratoriais e testes de imagem (exames com MIBG, exames de PET, ultrassom, exames de TC e/ou exames de IRM) para verificar se há qualquer tumor restante. Os testes realizados dependerão do grupo de risco, do tamanho e da localização do tumor e de outros fatores.
Tendo em vista que há uma probabilidade de que o câncer possa retornar após o tratamento inicial, é muito importante manter todos os compromissos de acompanhamento e relatar imediatamente quaisquer novos sintomas ao médico de seu filho. A equipe do tratamento de saúde discutirá com você um cronograma de acompanhamento, inclusive quais testes devem ser realizados e qual com frequência. Visitas ao médico, testes laboratoriais e exames de imagem para averiguar sinais de recorrência são efetuados mais frequentemente no início. Se nada anormal é encontrado, o tempo entre os testes pode ser ampliado.
Um benefício do atendimento de acompanhamento é que este lhe oferece a oportunidade para discutir quaisquer perguntas e preocupações que surjam durante e depois da recuperação de seu filho. Por exemplo, quase todo tratamento contra o câncer pode ter efeitos colaterais. Alguns podem durar de poucas semanas a muitos meses, mas outros podem ser permanentes. É importante relatar imediatamente quaisquer novos sintomas ao médico de modo que a causa possa ser determinada e tratada, se necessário.
É importante também manter o plano de saúde. Apesar de ninguém querer pensar a esse respeito, a volta do câncer é sempre uma possibilidade. Se acontecer, a última coisa que você desejaria é ter que se preocupar com o pagamento pelo tratamento.
Manter bons registros médicos
Por mais que você possa querer esquecer a experiência uma vez que o tratamento tenha sido concluído, é também muito importante manter bons registros do atendimento médico de seu filho durante esse período. Isso pode ser muito útil para seu filho e seus médicos mais tarde quando adulto. Há certas informações que você deve assegurar que os médicos de seu filho possuam.
Estas são:
• Uma cópia do(s) laudo(s) de patologia de quaisquer biópsias ou cirurgias
• Se houve uma cirurgia, uma cópia do(s) laudo(s) da operação
• Caso seu filho tenha sido hospitalizado, cópias dos resumos de alta que os médicos preparam quando os pacientes são enviados para casa
• Caso seu filho tenha recebido quimioterapia ou outros medicamentos para o câncer, uma lista dos medicamentos, de suas doses e quando foram administrados
• Se houve radiação, um resumo do tipo e da dose de radiação e quando e onde foi administrado
Efeitos em longo prazo do neuroblastoma e de seu tratamento
O próprio neuroblastoma e seu tratamento são capazes às vezes de resultar em efeitos duradouros.
Em circunstâncias muito raras e por motivos desconhecidos, em algumas crianças com neuroblastoma, o sistema imune do corpo ataca o tecido nervoso normal da criança. Isso pode levar a problemas como deficiências no aprendizado, atrasos no desenvolvimento muscular, problemas de fala e no comportamento. Crianças cujo tumor surja no pescoço ou no tórax e que tenham problemas com os olhos ou com torções musculares podem necessitar tratamento adicional com corticosteroides ou outros hormônios para suprimir seu sistema imune.
Graças aos grandes avanços terapêuticos, um número maior de crianças tratadas para câncer está sobrevivendo agora até a idade adulta. Os médicos aprenderam que o tratamento pode afetar a saúde das crianças mais tarde na vida, de modo que vigiar efeitos à saúde à medida que envelhecem tornou-se mais uma preocupação nos últimos anos.
Tratar câncer infantil requer uma abordagem muito especializada, assim como os cuidados e o acompanhamento após o tratamento. Quanto mais cedo quaisquer problemas possam ser reconhecidos, mais provavelmente poderão ser tratados eficazmente.
Sobreviventes de câncer infantil estão em risco, em certa medida, de diversos possíveis efeitos tardios ocasionados por seu tratamento contra o câncer. Este risco depende de alguns fatores, como o tipo de câncer, os tratamentos específicos recebidos para câncer, doses de tratamento contra o câncer e a idade em que receberam o tratamento contra o câncer. Os efeitos tardios do tratamento para o câncer podem incluir:
• Problemas cardíacos ou pulmonares (em decorrência de certos medicamentos quimioterápicos ou à radioterapia)
• Crescimento e desenvolvimento retardado ou diminuído (ósseo ou no geral)
• Alterações no desenvolvimento sexual e na capacidade de ter filhos
• Alterações na função intelectual com problemas no aprendizado
• Desenvolvimento de um segundo câncer mais tarde na vida
NOVIDADES
Quais são as novidades na pesquisa e no tratamento do neuroblastoma?
Pesquisas importantes sobre o neuroblastoma estão em andamento neste momento em muitos hospitais universitários, centros médicos e em outras instituições em todo o mundo. A cada ano, os cientistas descobrem mais sobre o que causa a doença e o modo como melhorar o tratamento.
Classificação de neuroblastomas
Os pesquisadores contam agora com testes laboratoriais melhores para investigar alterações nos genes de células do neuroblastoma. Foram feitos muitos progressos nos últimos anos em descobrir quais neuroblastomas mais provavelmente serão curados com tratamento padrão e quais necessitarão tratamento mais agressivo.
Por exemplo, usando testes laboratoriais mais modernos, pesquisadores descobriram que certas alterações no DNA no braço curto do cromossomo 6 (p622) são mais provavelmente vistas em neuroblastomas que crescem com mais agressividade.
Os médicos estão buscando agora usar esses achados para ajudar na escolha dos melhores tratamentos. Sistemas mais novos de estadiamento e de classificações de grupos de riscos, que tiram proveito de alguns destes achados, devem estar em uso dentro dos próximos anos.
Tratamento
As taxas de sobrevida de cânceres na infância melhoraram, pois os médicos descobriram maneiras para aperfeiçoar os tratamentos atuais. Os pesquisados prosseguem buscando melhores maneiras para tratar o neuroblastoma.
Quimioterapia
Os médicos seguem pesquisando as melhores combinações de medicamentos quimioterápicos para tratar o neuroblastoma.
Diversos medicamentos quimioterápicos que já estão sendo utilizados para tratar outros tipos de câncer, como topotecano, irinotecano e temozolomida, estão sendo estudados atualmente para o uso contra o neuroblastoma. Além disso, alguns medicamentos mais recentes que atuam em maneiras diferentes dos medicamentos quimioterápicos padrão estão sendo também estudados em outros países para o tratamento do neuroblastoma. Os exemplos incluem bortezomibe, nifurtimox e lestaurtinibe.
Outros estudos estão investigando se crianças com neuroblastoma de risco intermediário ou baixo podem ser tratadas com menos quimioterapia. A meta é ainda obter os mesmos bons resultados, mas com menos efeitos colaterais provocados pelo tratamento.
Transplantes de células-tronco
Os médicos estão tentando também melhorar as taxas de sucesso com quimioterapia em alta dose e transplantes de células-tronco, utilizando diferentes combinações de quimioterapia, radioterapia, retinoides e outros tratamentos. Alguns estudos clínicos estão investigando o uso de mais de um transplante de células-tronco no mesmo paciente (conhecido como transplante em tandem). Outros estão buscando ver se o uso de células-tronco de outra pessoa (um transplante alogênico) poderia ajudar algumas crianças com tumores difíceis de tratar.
Retinoides
Retinoides como o ácido 13-cis retinoico (isotretinoína) demonstram promessa em reduzir o risco de recorrência depois do tratamento. Retinoides mais novos, potencialmente mais eficazes, como fenretinida, estão sendo examinados agora em estudos clínicos.
Formas mais recentes de tratamento
O conhecimento sobre o que torna células de neuroblastoma diferentes de células normais pode levar a novas abordagens para tratar esta doença. Diversas formas de terapias mais novas, direcionadas mais especificamente contra células de neuroblastoma do que os tratamentos tradicionais, atualmente estão sendo investigadas em estudos clínicos.
Por exemplo, os médicos estão estudando agora medicamentos que visam especificamente o mecanismo de ação de células de neuroblastoma, tal como um medicamento que inibe a via do ALK ou a via aurora A. Um exemplo é o crizotinibe, um medicamento direcionado a células com alterações no gene ALK. Até 15% dos neuroblastomas apresentam alterações neste gene. Estudos que testam este medicamento estão sendo iniciados no momento.
O anticorpo monoclonal ch 14.18, cujo alvo é GD2 em células de neuroblastoma, é utilizado agora de rotina para crianças com neuroblastoma de alto risco, para ajudar que células do sistema imune encontrem e destruam as células cancerosas. Estudos clínicos estão em andamento para testar a efetividade de diversos outros anticorpos direcionados ao GD2. Um exemplo é o hu 14.18-IL-2, um anticorpo que está ligado à interleucina-2 (uma citocina que reforça o sistema imune). Resultados iniciais constataram que esta combinação anticorpo/citocina pode ajudar algumas crianças nas quais outros tratamentos não estão funcionando mais.
Diversas vacinas contra câncer estão também sendo estudadas para o uso contra o neuroblastoma. Para estas vacinas, células modificadas de neuroblastoma ou outras substâncias são injetadas no corpo para tentar fazer com que o próprio sistema imune da criança ataque as células cancerosas. Estes tratamentos estão ainda nos estágios mais precoces de estudos clínicos.
O QUE PERGUNTAR AO MÉDICO?
O que você deve perguntar ao médico de seu filho sobre o neuroblastoma?
É importante ter discussões abertas honestas com sua equipe de tratamento do câncer. Você deve sentir-se à vontade para fazer qualquer pergunta que tenha em mente, não importando o quanto insignificante possa parecer.
Entre as perguntas que você poderia querer fazer estão:
• Qual é o estágio (extensão) do neuroblastoma?
• Qual é o grupo de risco que o câncer do meu filho se encontra? O que isso significa no caso do meu filho?
• O que mais pode me informar sobre o câncer com base nos testes laboratoriais?
• Existem quaisquer outros testes que precisam ser feitos antes que discutamos o tratamento?
• Qual é sua experiência em tratar este tipo de câncer?
• Quais são os outros médicos que precisaremos consultar?
• Quais são nossas opções de tratamento?
• Um tipo de tratamento aumenta a chance de cura mais do que outro?
• Há outros estudos clínicos que deveríamos considerar?
• Qual tratamento você recomenda? Por quê?
• Quais são os possíveis efeitos colaterais do tratamento? O que pode ser feito a respeito?
• Qual será a duração do tratamento? O que envolverá? O que será realizado?
• Quanto tempo levará para que meu filho se recupere do tratamento?
• Qual são as probabilidades do câncer recorrer? O que faríamos se isso acontecer?
• Existem riscos a longo prazo ou complicações da doença ou do tratamento?
• O que devo fazer para ajudar meu filho a estar pronto para o tratamento?
• Que tipo de acompanhamento meu filho necessitará depois do tratamento?
• Existe um grupo de apoio para famílias que estão enfrentando neuroblastoma ou câncer na infância?
Junto com estas perguntas de amostra, certifique-se de anotar algumas próprias. Por exemplo, você poderia querer mais informações sobre períodos de tempo para recuperação de modo que possa planejar seus esquemas para escola e trabalho. Você pode querer perguntar também sobre obter uma segunda opinião. Mantenha em mente também que os médicos não são os únicos que podem fornecer-lhe informações. Outros profissionais de saúde como, por exemplo, enfermeiras e assistentes sociais, podem ter as respostas que você procura.
Como é feito o estadiamento do neuroblastoma?
Estadiamento é o processo de se descobrir o quanto um câncer se disseminou. A previsão (prognóstico) para pessoas com câncer depende, em grande medida, do estágio do câncer. O estágio de um câncer é um dos fatores mais importantes ao ser escolhido um tratamento.
O estágio do neuroblastoma tem como base resultados de exames físicos, exames de imagem e biópsias do tumor principal e de outros tecidos, os quais foram descritos na seção “Como o neuroblastoma é diagnosticado?”, bem como os resultados de cirurgia.
Para o neuroblastoma, diversos outros fatores afetam também o prognóstico, inclusive idade da criança e certos exames e tumor. Embora não sejam utilizados para determinar o estágio do câncer, estes fatores prognósticos são usados, juntamente com o estágio do câncer, para determinar em qual grupo de risco uma criança se enquadra. Estes fatores prognósticos e grupos de risco estão também descritos abaixo e na seção “Grupos de risco”.
Sistema Internacional de Estadiamento do Neuroblastoma
Um sistema de estadiamento é uma maneira padronizada para a equipe que trata o câncer descrever a sua extensão. A partir da metade da década de noventa, a maioria dos centros de câncer tem utilizado o Sistema Internacional de Estadiamento do Neuroblastoma (INSS) para estadiar neuroblastoma. Em forma simplificada, os estágios são:
Estágio 1: O câncer ainda está na área onde iniciou. Está localizado em um lado do corpo (direito ou esquerdo). Todo o tumor visível é totalmente removível por cirurgia (embora as margens do tumor, examinadas sob o microscópio depois da cirurgia, possam mostrar algumas células cancerosas). Linfonodos situados no interior do tumor podem conter células de neuroblastoma, mas os existentes fora do tumor estão livres do câncer.
Estágio 2A: O câncer ainda está na área onde iniciou e em um lado do corpo, mas nem todo o tumor visível pode ser removido por cirurgia. Linfonodos situados no interior do tumor podem conter células de neuroblastoma, mas os existentes fora do tumor estão livres do câncer.
Estágio 2B: O câncer está em um lado do corpo e pode ou não ser possível que seja totalmente removido por cirurgia. Linfonodos próximos, fora do tumor, contêm células de neuroblastoma, mas o câncer não se espalhou para linfonodos no outro lado do corpo ou para outro local.
Estágio 3: O câncer não se espalhou para partes distantes do corpo, mas uma das afirmações seguintes é verdadeira:
– O câncer não pode ser completamente removido por cirurgia e atravessou a linha mediana (definida como a coluna vertebral) para o outro lado do corpo. Pode ou não ter se espalhado para linfonodos próximos.
– O câncer ainda está na área onde se iniciou e está situado em um lado do corpo. Já se espalhou para linfonodos que são relativamente próximos, mas no outro lado do corpo.
– O câncer está no meio do corpo e crescendo em direção aos dois lados (seja diretamente ou por disseminação para linfonodos próximos) e não pode ser completamente removido por cirurgia.
Estágio 4: O câncer se disseminou para sítios distantes, tais como linfonodos distantes, osso, fígado, pele, medula óssea ou outros órgãos (mas a criança não atende aos critérios para o Estágio 4S).
Estágio 4S (denominado também neuroblastoma “especial”): A criança é mais nova do que 1 ano de idade. O câncer está em um lado do corpo. Pode ter se espalhado para linfonodos no mesmo lado do coro, mas não para nódulos no outro lado. O neuroblastoma se espalhou para o fígado, a pele e/ou a medula óssea. Contudo, no máximo 10% das células da medula podem ser cancerosas, e os exames de imagem, como exame com MIBG, não mostram disseminação para os ossos.
Recorrente: Embora não integre formalmente o sistema de estadiamento, esse termo é empregado para descrever o câncer que retornou (recorreu) depois de ter sido tratado. O câncer pode retornar na área onde primeiramente iniciou ou em outra parte do corpo.
Sistema Internacional de Estadiamento de Grupos de Risco para Neuroblastoma
Um sistema mais novo de estadiamento, conhecido como o Sistema Internacional de Estadiamento de Grupos de Risco para Neuroblastoma (INRGSS), não utiliza os resultados de cirurgia para ajudar a determinar o estágio. O sistema permite que o médico determine um estágio antes da cirurgia, com base nos resultados de exames físicos, exames de imagem e biópsias. O INRGSS está sendo estudado para ter a certeza de que é útil, de modo que o INSS ainda está sendo utilizado por ora. O sistema mais novo pode substituir o INSS no futuro próximo.
- O que é?
-
Neuroblastoma é uma forma de câncer que se inicia em certos tipos de células nervosas muito primitivas encontradas em embriões ou fetos (o termo neuro refere-se a nervos, enquanto blastoma diz respeito a um câncer que afeta células imaturas ou em desenvolvimento). Este tipo de câncer ocorre em lactentes e crianças na primeira infância. Raramente, é encontrado em crianças com mais de 10 anos de idade.
Para entender o neuroblastoma, é importante conhecer algo sobre a estrutura e o funcionamento normal do sistema nervoso simpático, lugar onde estes tumores se iniciam. A seguir, um pouco sobre o Sistema Nervoso Simpático.
Neuroblastoma e o Sistema Nervoso Simpático
O sistema nervoso é formado pelo cérebro, a medula espinhal e os nervos que deles se originam e atingem todas as áreas do corpo. O sistema nervoso é essencial para pensar, sentir e movimentar-se, entre outras coisas.
Parte do sistema nervoso controla também funções do corpo, das quais raramente estamos cientes, como frequência cardíaca, respiração, pressão arterial, digestão e outras funções. Esta parte do sistema nervoso é conhecida como sistema nervoso autônomo.
O sistema nervoso simpático faz parte do sistema nervoso autônomo. Ele inclui:
• Fibras nervosas que percorrem as laterais da medula espinhal.
• Agrupamentos de células nervosas, denominados gânglios, em certos pontos ao longo do trajeto das fibras nervosas.
• Células semelhantes às nervosas, encontradas na medula (centro) das glândulas adrenais. As adrenais são pequenas glândulas assentadas sobre a parte superior de cada rim. Estas glândulas produzem hormônios como a adrenalina (epinefrina).As principais células que compõem o sistema nervoso são denominadas células nervosas ou neurônios. Estas células se comunicam com outros tipos de células no corpo ao liberarem quantidades diminutas de substâncias químicas (hormônios). Isso é importante porque as células do neuroblastoma frequentemente liberam certos hormônios que podem causar sintomas (ver a seção, “Como o neuroblastoma é diagnosticado?”).
Voltando aos neuroblastomas, são cânceres que se desenvolvem a partir de células nervosas imaturas do sistema nervoso simpático (neuroblastos simpáticos), de modo que podem ser encontrados em qualquer local ao longo deste sistema.
Um pouco mais que um terço dos neuroblastomas se inicia nas glândulas adrenais. Por volta de um terço começa em gânglios de nervos simpáticos no abdômen. A maior parte do restante tem início em gânglios simpáticos próximos à coluna vertebral, no tórax ou na pelve.
Em casos raros, é possível que um neuroblastoma tenha se espalhado de modo tão vasto que, ao ser encontrado, os médicos são incapazes de dizer exatamente o local de sua origem.Existe um amplo espectro de comportamentos que os neuroblastomas podem adotar. Alguns são capazes de se proliferarem e disseminarem rapidamente, enquanto em outros o crescimento é lento. Às vezes, em crianças muito jovens, as células cancerosas morrem sem qualquer motivo ou o tumor desaparece por si próprio. Em outros casos, as células, algumas vezes, amadurecem sozinhas até células ganglionares normais e param de se dividir. Isso faz com que o tumor se torne um ganglioneuroma.
Outros Tumores
Nem todos os tumores do sistema nervoso autônomo na infância são malignos (cancerosos).
O ganglioneuroma é um tumor benigno (não cancerosos) formado por células ganglionares maduras e bainhas nervosas.O ganglioneuroblastoma é um tumor que apresenta componentes malignos e benignos. O tumor contém neuroblastos (células nervosas imaturas) que são capazes de proliferar e se espalhar anormalmente, semelhantemente ao neuroblastoma, bem como regiões de tecido mais maduro que são semelhantes ao ganglioneuroma.
Os ganglioneuromas são geralmente extraídos por cirurgia e observados cuidadosamente sob um microscópio para ter certeza de que não possuem áreas de células malignas (o que o tornaria um ganglioneuroblastoma). Se o diagnóstico final for ganglioneuroma, nenhum outro tratamento é necessário. Por outro lado, ganglioneuroblastomas são tratados do mesmo modo que neuroblastomas.
- Fatores de Risco
-
Sabemos o que causa o neuroblastoma?
As causas do neuroblastoma não são completamente conhecidas. Porém, pesquisadores descobriram importantes diferenças entre células de neuroblastoma e os neuroblastos normais (células nervosas primitivas) a partir dos quais estas se desenvolvem. Encontraram também diferenças entre neuroblastomas que possivelmente respondem ao tratamento e aqueles cujo prognóstico é desfavorável (previsão). Estas diferenças (conhecidas como marcadores prognósticos) são úteis na seleção do tratamento para alguns pacientes (ver a seção, “Como é feito o estadiamento do neuroblastoma?”).
Há muitos anos, os cientistas já sabem que as células nervosas e as células da medula (centro) da glândula adrenal se desenvolvem a partir de células no feto denominadas neuroblastos. Neuroblastomas se formam quando neuroblastos fetais normais falham em se tornar células nervosas maduras ou células da medula adrenal. Ao invés, continuam a proliferar e se dividir.
Os neuroblastos podem não estar completamente amadurecidos em bebês quando estes nascem. De fato, estudos mostraram que existem pequenos agrupamentos de neuroblastos nas glândulas adrenais de alguns lactentes com menos de 3 meses de idade. A maioria destes eventualmente amadurece e se transforma em células nervosas ou simplesmente desaparece e não forma neuroblastomas. Algumas vezes, os neuroblastos restantes em lactentes muito jovens continuam a crescer e então formam tumores e podem até mesmo se disseminar para outras partes do corpo. Porém, muitos destes tumores ainda amadurecerão eventualmente e se transformarão em tecido nervoso ou desaparecerão sozinhos.
No entanto, à medida que a criança envelhece, torna-se menos provável que estas células amadureçam e é mais possível que continuem a se proliferar, dando origem a um câncer. No momento em que os neuroblastomas estão suficientemente grandes para serem percebidos ou causarem sintomas, a maioria não consegue mais amadurecer por si mesmo e crescerá e se espalhará a menos que tratada.
A incapacidade para amadurecer e parar de crescer deve-se ao DNA anormal nos neuroblastos. O DNA é a substância química em cada uma de nossas células que constitui nossos genes – as instruções para o modo como nossas células funcionam. O DNA é encontrado no núcleo (centro de controle) de cada célula, em estruturas longas semelhantes a fios denominadas cromossomos. Nós geralmente nos parecemos com nossos pais porque eles são a origem de nosso DNA, porém, o DNA afeta mais do que como aparentamos. O DNA pode influenciar também nosso risco de desenvolver certas doenças, tal como alguns tipos de câncer.
Alguns genes contêm instruções para controlar quando nossas células crescem, dividem-se e morrem. Certos genes que aceleram a divisão celular são denominados oncogenes. Outros que retardam a divisão celular ou que fazem com que as células morram no momento certo são denominados genes supressores de tumor. Cânceres podem ser causados por alterações no DNA que ativam oncogenes ou que desativam genes supressores de tumor.
Na maioria dos casos, alguns dos cromossomos em células do neuroblastoma apresentam alterações que provavelmente afetam certos genes. Os cientistas ainda estão tentando determinar quais genes são afetados por estas alterações cromossômicas, bem como o modo que estas alterações poderiam afetar o crescimento de células do neuroblastoma.
Algumas pessoas que desenvolvem câncer apresentam mutações no DNA que herdaram de um dos pais e que aumentam seu risco para a doença. Em casos raros, o neuroblastoma parece ser devido a alterações em genes herdadas. Alterações herdadas no oncogene ALK parecem ser responsáveis pela maioria dos casos de neuroblastoma hereditário. Um número pequeno de neuroblastomas herdados é causado por alterações no PHOX2B, um gene que normalmente ajuda células nervosas a amadurecerem.
Ainda, a maior parte dos neuroblastomas não é causada por alterações herdadas no DNA. Estes são o resultado de alterações em genes adquiridas precocemente no desenvolvimento da criança. Estas alterações estão presentes somente nas células cancerosas da criança, de modo que não serão transmitidas para seus filhos. Os genes exatos afetados não são conhecidos na maioria dos casos.
Algumas alterações gênicas podem afetar a rapidez com a qual um neuroblastoma provavelmente crescerá. Por exemplo, células de neuroblastoma contêm às vezes cópias extras de um oncogene denominado MYCN, que é frequentemente um sinal de que o tumor crescerá rapidamente. Por outro lado, o gene NTRK1 (que produz a proteína TrkA) é muitas vezes superativo em células de neuroblastoma, o que significa um prognóstico favorável.
Pesquisadores descobriram algumas das alterações gênicas que podem levar ao neuroblastoma, mas ainda não está claro o que poderia causar estas alterações. Algumas alterações gênicas podem ser herdadas. Algumas podem ter causas externas que ainda não são conhecidas, mas outras podem ser apenas um evento aleatório que às vezes ocorre no interior de uma célula, sem que tenha uma causa externa. No momento, ainda não são conhecidas causas de neuroblastoma que sejam associadas ao estilo de vida ou ao ambiente, de modo que é importante lembrar que não há nada que estas crianças ou seus pais pudessem ter feito para impedir a ocorrência deste câncer.Quais são os fatores de risco para neuroblastoma?
Fator de risco é algo que afeta sua chance de adquirir uma doença, como o câncer. Diferentes tipos de câncer apresentam diferentes fatores de risco.
Fatores de risco associados ao estilo de vida, como dieta, peso corporal, atividade física e tabagismo desempenham um importante papel em muitos tipos de câncer no adulto. Porém, estes fatores geralmente levam muitos anos para influenciar o risco de câncer, e não se acredita que participem tanto em cânceres na infância, incluindo neuroblastomas.
Não se conhece fatores ambientais (como exposições durante a gestação da mãe ou na primeira infância) que aumentem a chance de se adquirir neuroblastoma.
Idade
O neuroblastoma é mais comum em crianças muito jovens, mas, mesmo nessa faixa etária, é ainda raro.
Hereditariedade
Em casos raros (em torno de 1% a 2% de todos os neuroblastomas), crianças podem herdar um risco aumentado de desenvolver neuroblastoma. No entanto, a grande maioria dos neuroblastomas não parece ser herdada.
Crianças com a forma familiar de neuroblastoma (aquelas com uma tendência herdada para desenvolver este câncer) geralmente vêm de famílias com um ou mais membros afetados que tiveram neuroblastoma quando lactentes. A idade média no diagnóstico de casos familiares é mais precoce do que a idade para casos esporádicos (não herdados).
Crianças com neuroblastoma familiar podem desenvolver 2 ou mais destes cânceres em diferentes órgãos (por exemplo, em ambas as glândulas adrenais ou em mais de um gânglio simpático). É importante distinguir neuroblastomas que se desenvolvem em diversos órgãos de neuroblastomas que tiveram início em um órgão e então se espalharam para outros (neuroblastomas metastáticos), pois, quando há o desenvolvimento de tumores em diversos locais, isto imediatamente sugere uma forma familiar. Metástases podem ocorrer tanto com a forma familiar quanto com a esporádica.
Grupos de Risco
Grupos de risco para o neuroblastoma
O Children’s Oncology Group (COG) faz uso dos principais fatores prognósticos discutidos na seção anterior, combinado com o estágio da doença, para formar 3 diferentes grupos de risco: baixo, intermediário e alto. Estes grupos de risco são utilizados para ajudar a predizer a probabilidade de uma criança poder ser curada. Por exemplo, uma criança no grupo de baixo risco pode frequentemente ser curada com tratamento simples, tal como apenas cirurgia. Com crianças nos grupos de risco mais alto, a chance de cura não é tão alta, de modo que tratamento mais intensivo é muitas vezes necessário.
Estes grupos de risco têm como base o conhecimento atual sobre características clínicas e biológicas do neuroblastoma e o modo como este é tratado. À medida que nova pesquisa forneça mais informações, estes grupos de riscos podem se alterar com o passar do tempo. Por exemplo, em recomendações recentes para o tratamento, o corte de idade para algumas dessas categorias foi revisado, de até 12 meses para até 18 meses (547 dias).
Baixo risco
• Todas as crianças que estão no Estágio 1
• Qualquer criança que esteja no Estágio 2A ou 2B e que tenha menos de 1 ano de idade
• Qualquer criança que esteja no Estágio 2A ou 2B, cujo câncer não tenha cópias extras do gene MYCN
Qualquer criança que esteja no Estágio 2A ou 2B, cujo câncer tenha cópias extras do gene MYCN, mas com histologia favorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer tenha histologia favorável, seja hiperdiploide (DNA em excesso) e sem cópias extras do gene MYCNRisco intermediário
• Qualquer criança que esteja no Estágio 3, abaixo de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN e tenha histologia favorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 4, abaixo de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer não tenha cópias extras do gene MYCN e apresente ploidia normal do DNA (número de cromossomos) e/ou histologia desfavorávelAlto risco
• Qualquer criança que esteja no Estágio 2A ou 2B, acima de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN e histologia desfavorável (aspecto sob o microscópio)
• Qualquer criança que esteja no Estágio 3, abaixo de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer não tenha cópias extras do gene MYCN, mas com histologia desfavorável
• Qualquer criança que esteja no Estágio 3, acima de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4, abaixo de 1 ano de idade, cujo câncer tenha cópias extras do gene MYCN
• Qualquer criança que esteja no Estágio 4 e seja acima de 1 ano de idade
• Qualquer criança que esteja no Estágio 4S (abaixo de 1 ano de idade), cujo câncer tenha cópias extras do gene MYCNClassificação recente de grupos de risco
Tal como acontece com o sistema de estadiamento descrito na seção anterior, um sistema mais novo de classificação de grupos de risco, a classificação Internacional de Grupos de Riscos para Neuroblastoma (INRG), está sendo atualmente estudada e poderá em breve substituir o sistema acima do COG. A classificação INRG divide as crianças em 4 grupos de risco, incluindo um grupo de risco muito baixo, e possui modificações baseadas em nosso entendimento recente sobre a histologia do tumor.
Taxas de sobrevida em 5 anos do neuroblastoma com base em grupos de risco
Taxas de sobrevida representam uma maneira para obter uma ideia geral da previsão para crianças com certo tipo e estágio de câncer. Alguns pais podem querer saber sobre a estatística para crianças em situações semelhantes, mas outros podem não achar que os números ajudem, ou podem mesmo nem querer sabê-los.
A taxa de sobrevida em 5 anos refere-se ao percentual de pacientes que vivem pelo menos 5 anos depois que seu câncer é diagnosticado. Evidentemente, muitas crianças vivem por mais tempo do que 5 anos (e muitas são curadas).
Para obter taxas de sobrevida em 5 anos, os médicos precisam verificar pessoas que foram tratadas há pelo menos 5 anos. Melhoras no tratamento desde então podem resultar em previsão mais favorável para os pacientes que estão sendo diagnosticados agora com neuroblastoma.
As taxas de sobrevida frequentemente baseiam-se em resultados anteriores de grandes números de pessoas que sofreram da doença, mas não podem predizer o que acontecerá em qualquer caso individual específico. O grupo de risco do câncer de uma pessoa é importante para estimar sua previsão. Porém, muitos outros fatores podem afetar a previsão de uma pessoa, tais como sua idade, a localização do tumor e até que ponto o câncer responde ao tratamento.
Sobrevida por grupo de risco
· Grupo de baixo risco: A taxa de sobrevida em 5 anos em crianças no grupo de baixo risco é em torno de 95%.
· Grupo de risco intermediário: Em crianças no grupo de risco intermediário, a taxa de sobrevida em cinco anos é em torno de 80% a 90%.
· Grupo de alto risco: A taxa de sobrevida em 5 anos em crianças no grupo de alto risco é em torno de 30% a 50%.
Histórico Médico e Exame Físico
Se seu filho apresenta sinais e sintomas que possam sugerir um neuroblastoma, o médico vai querer obter um histórico médico completo para se inteirar mais sobre os sintomas. Um exame físico pode fornecer informações sobre sinais de um neuroblastoma ou de outros problemas de saúde. Por exemplo, o médico pode constatar pressão arterial alta em uma criança ou ser capaz de ver ou perceber uma massa anormal no corpo.
Se os sintomas e/ou os resultados do exame físico sugerirem um neuroblastoma (ou outro tumor), outros testes provavelmente serão realizados. Estes podem incluir exames de sangue e de urina, exames por imagem e biópsias. Estes exames são importantes porque muitos dos sintomas e sinais do neuroblastoma podem ser causados também por outros tipos de câncer ou por doenças não cancerosas.
PREVENÇÃO
O neuroblastoma pode ser prevenido?
O risco de muitos cânceres em adultos pode ser reduzido com certas mudanças no estilo de vida (tal como manter o peso saudável ou deixar de fumar), mas, por enquanto, não há maneiras conhecidas para prevenir a maioria dos cânceres em crianças.
Os únicos fatores de risco conhecidos para o neuroblastoma (idade e hereditariedade) não podem ser alterados. No momento, não se conhecem causas associadas ao estilo de vida ou ambientais para neuroblastomas.
Alguns estudos sugerem que a administração materna de multivitamínicos ou ácido fólico no período pré-natal poderia reduzir o risco de neuroblastoma, mas são necessárias pesquisas adicionais para confirmar essa recomendação.
Se houver histórico de neuroblastoma em sua família, você poderá desejar conversar com um geneticista sobre os riscos de seus filhos desenvolverem a doença. É importante lembrar, no entanto, que o neuroblastoma familiar é muito raro.
- Sintomas
-
Sinais e sintomas
Os sinais e sintomas de neuroblastoma podem variar bastante, dependendo do tamanho e da localização do tumor original, da extensão da disseminação para outras partes do corpo e se as células tumorais secretam ou não hormônios.
Muitos dos sinais e sintomas abaixo são mais provavelmente causados por algo diferente de neuroblastoma. Ainda assim, se o seu filho tiver qualquer um destes sintomas, verifique com seu médico de modo que a causa possa ser avaliada e tratada, se necessário.Sinais ou sintomas causados pelo tumor primário
Um dos sinais mais comuns de um neuroblastoma é a presença de uma protuberância ou massa incomum. Estas são normalmente encontradas no abdômen da criança, causando seu inchaço. A criança pode não querer comer (o que pode levar à perda do peso). Se a criança tiver idade suficiente, ele ou ela pode queixar-se de se sentir cheio ou de ter desconforto ou dor. Mas, a própria protuberância não é em geral sensível ao toque. Massas podem ocorrer também em outros locais como o pescoço.
Algumas vezes, o inchaço provocado por um tumor no abdômen pode afetar partes do corpo que não contêm câncer, especialmente as pernas e, no sexo masculino, o escroto. Isso acontece quando um tumor pressiona ou invade e obstrui os vasos sanguíneos e linfáticos, impedindo os líquidos de circularem de volta para o coração.
Em alguns casos, a pressão de um tumor em crescimento pode afetar a bexiga ou os intestinos da criança, o que pode causar problemas com a micção, diarreia ou constipação.
Se estiver localizado no tórax, o tumor pode pressionar a veia cava superior (a grande veia no tórax que faz o retorno do sangue da cabeça e pescoço para o coração). Isso pode causar inchaço na face, no pescoço, nos braços e na região superior do tórax (às vezes acompanhado por coloração vermelho-azulada da pele). Além disso, pode causar cefaleias, tonturas e uma alteração no nível da consciência se afetar o cérebro. O tumor pode pressionar também a garganta ou a traqueia, o que pode tornar difícil para a criança respirar ou deglutir.
Neuroblastomas que pressionam certos nervos no tórax ou no pescoço podem algumas vezes provocar outros sintomas, como queda palpebral e pupila pequena (a área preta no centro do olho). A pressão sobre outros nervos próximos à coluna vertebral pode afetar a capacidade da criança de sentir ou movimentar os braços ou as pernas.Sinais ou sintomas causados pela disseminação do tumor
Cerca de dois terços dos casos de neuroblastomas já se disseminaram para outras partes do corpo no momento em que são descobertos.
O neuroblastoma frequentemente se dissemina para os ossos. Uma criança capaz de falar pode queixar-se de dor nos ossos. A dor pode ser tão grande que a criança manca ou se recusa a andar. Caso se dissemine para a coluna, os tumores podem pressionar a medula espinhal e provocar fraqueza, dormência ou paralisia nos braços ou nas pernas. A disseminação para os ossos em torno dos olhos pode levar ao aparecimento de hematoma ao redor dos olhos ou fazer com que um globo ocular se torne ligeiramente proeminente.
A presença de caroços azuis ou roxos que se assemelham a pequenas frutas silvestres (mirtilos) pode ser sinal de disseminação para a pele.
Se o câncer espalhar-se para a medula óssea (a parte interna de certos ossos que produzem células do sangue), a criança pode não ter número suficiente de células vermelhas, brancas ou plaquetas no sangue. Esses déficits de células sanguíneas podem resultar em cansaço, irritabilidade, fraqueza, infecções frequentes e sangramento excessivo de pequenos cortes ou arranhões.
Raramente, grandes tumores podem começar a se romper, levando a uma perda de fatores de coagulação no sangue. O resultado pode ser alto risco de sangramento sério, o que é conhecido como coagulopatia consumptiva e pode ser de risco à vida.
Uma forma especial do neuroblastoma de ampla disseminação (conhecida como estágio 4S) ocorre somente durante os primeiros meses de vida. Nesta forma especial, o neuroblastoma se dissemina para o fígado, para a pele e/ou para a medula óssea (em quantidades pequenas). O fígado pode tornar-se muito grande. Apesar do fato do câncer já estar disseminado quando descoberto, o neuroblastoma em estágio 4S é muito tratável (frequentemente diminuindo ou desaparecendo sozinho), e quase todas as crianças com esta forma de neuroblastoma podem ser curadas.
Sinais ou sintomas causados por hormônios provenientes do tumor
O neuroblastoma é um dos poucos tipos de câncer em crianças que libera hormônios que podem causar problemas em tecidos e órgãos distantes, embora o câncer não tenha se disseminado para estes tecidos ou órgãos. Estes problemas são denominados síndromes paraneoplásicas.
Os sintomas das síndromes paraneoplásicas podem incluir:
• Diarreia constante
• Febre
• Pressão arterial alta (causando irritabilidade)
• Frequência cardíaca acelerada
• Avermelhamento (rubor) da pele
• SudoreseUm sintoma incomum é denominado síndrome da opsoclonia-mioclonia-ataxia ou dos “olhos e pés dançantes”. Nesta situação, a criança apresenta movimentos oculares irregulares, rápidos (opsoclonia), espasmos musculares semelhantes a torções (mioclonia) e aparenta estar sem coordenação ao ficar em pé ou andar (ataxia). Pode apresentar também dificuldade em falar. Por motivos desconhecidos, tumores de neuroblastoma que podem causar esta síndrome tendem a ser de menor risco à vida do que outras formas da doença.
- Diagnóstico
-
Como o neuroblastoma é diagnosticado?
Neuroblastomas são em geral descobertos como resultado de sinais ou sintomas que uma criança está apresentando. Se houver suspeita de um tumor, serão necessários testes para confirmar este diagnóstico.
Diagnóstico Precoce
O neuroblastoma pode ser descoberto precocemente?
Pesquisadores têm estudado se a triagem de lactentes para neuroblastoma pode encontrar estes tumores mais precocemente e levar a melhores resultados do tratamento. A triagem é um teste para uma doença, tal como câncer, em pessoas sem sintomas. Uma maneira de triar para neuroblastoma é testar a urina da criança para certas substâncias produzidas por tumores do tipo neuroblastoma (Para maiores informações sobre este teste de urina, ver a seção “Como o neuroblastoma é diagnosticado?”).
Os estudos não concluíram que o rastreamento de neuroblastoma seja útil. O teste em lactentes quando tinham 6 meses de idade não encontrou um número maior de tumores do que o que teria sido normalmente diagnosticado. Porém, a maioria destes tumores pertencia a um tipo que provavelmente desapareceria ou amadureceria em um tumor benigno por si só e que provavelmente nunca causaria quaisquer problemas. A triagem não reduziu o número de casos encontrados em estágios avançados ou salvou vidas.
Além disso, somente a metade das crianças identificadas por testes de triagem como possivelmente tendo neuroblastoma realmente apresenta um tumor que causaria problemas sérios. Esses resultados “falso-positivos” podem assustar desnecessariamente os pais e levar a testes e cirurgias que não seriam precisos em crianças cujos tumores desapareceriam ou amadureceriam por conta própria se deixados sozinhos.
Por esses motivos, a maioria dos especialistas não recomenda a triagem para neuroblastoma em lactentes que não apresentem risco aumentado da doença.
Em situações raras, o neuroblastoma é encontrado antes do nascimento durante uma ultrassonografia, um teste que emprega ondas sonoras para criar uma imagem dos órgãos internos de um feto. Ultrassonografias são geralmente realizadas para estimar a idade de um feto, predizer a data do nascimento e procurar certos defeitos de nascimento comuns. Melhorias na tecnologia do ultrassom ou outros métodos podem levar a testes pré-natais (antes do nascimento) mais precisos para esta doença.
O neuroblastoma é às vezes encontrado acidentalmente em crianças na primeira infância sem quaisquer sintomas durante testes efetuados para descobrir outras doenças da infância. Estas crianças terão geralmente um bom resultado e algumas podem nem mesmo necessitar tratamento.
Contudo, na maioria dos casos, o neuroblastoma é detectado pela primeira vez quando causa certos sintomas que revelam que a criança está doente.
Quais são as principais estatísticas sobre neuroblastoma?
O neuroblastoma é de longe o câncer mais comum em lactentes (abaixo de 1 ano de idade). É responsável por aproximadamente 7% de todos os cânceres infantis. A idade média no momento do diagnóstico é em torno de 1 a 2 anos. Em casos raros, o neuroblastoma é detectado por ultrassom, antes mesmo do nascimento. Quase 90% dos casos são diagnosticados até os 5 anos. O neuroblastoma é extremamente raro em pessoas acima de 10 anos de idade. Em cerca de 2 em 3 casos, a doença já se espalhou (metastizou) para outras partes do corpo quando é diagnosticada.
EXAMES
Exames de Sangue e Urina
Testes de catecolaminas no sangue e na urina
O neuroblastoma pode ser frequentemente constatado pela detecção de catecolaminas no sangue ou na urina. As células nervosas simpáticas normalmente liberam hormônios denominados catecolaminas, como epinefrina (adrenalina) e norepinefrina. Eventualmente o corpo as decompõe em metabólitos (pedaços menores), que então são passados para fora do corpo na urina.Na maioria dos casos, as células do neuroblastoma produzem catecolaminas suficientes para serem detectadas por exames de sangue ou urina. Os 2 metabólitos de catecolaminas mais frequentemente medidos são:
• Ácido homovanílico (HVA)
• Ácido vanilmandélico (VMA)Outros exames laboratoriais
O médico de seu filho provavelmente pedirá também outros exames de sangue para verificar contagens de células do sangue, a função hepática e renal e o balanço de sais (eletrólitos) no corpo. Uma análise da urina poderá também ser efetuada para verificar a função renal.Exames por Imagem
Os exames por imagem empregam raios-x, campos magnéticos, ondas sonoras ou substâncias radioativas para criar imagens do interior do corpo. Os exames por imagem podem ser realizados por alguns motivos, incluindo:
• Ajudar a descobrir se uma área suspeita poderia ser cancerosa
• Saber o quanto o câncer possa ter se disseminado
• Ajudar a determinar se o tratamento foi eficaz
A maioria dos pacientes com câncer ou que possam apresentar câncer será submetida a um ou mais destes exames. Pacientes com neuroblastoma são em geral muito jovens, de modo que pode ser difícil realizar alguns destes exames. Pais e equipes médicas precisam ser muito pacientes.Radiografias
O médico pode pedir uma radiografia torácica ou de outra parte do corpo como exame inicial se uma criança estiver apresentando sintomas, mas sem que esteja claro o que poderia os estar causando. No entanto, as imagens podem não ser suficientemente detalhadas para localizar tumores.Se o neuroblastoma já tiver sido diagnosticado, radiografias podem ser úteis para examinar se o câncer se espalhou para os ossos. Uma radiografia da cabeça poderá ser efetuada para investigar se o câncer se disseminou para os ossos cranianos. Uma cintilografia com MIBG (metaiodobenzilguanidina) ou cintilografia óssea (descrito abaixo) é geralmente melhor para examinar os ossos no resto do corpo, mas radiografias podem ser utilizadas em lactentes, quando estes exames não forem possíveis. Uma radiografia torácica padrão pode ser realizada, se médicos suspeitarem que o tumor tenha invadido os pulmões, mas uma tomografia computadorizada (TC) ou imagem por ressonância magnética (IRM) podem mostrar a área mais detalhadamente.
Exame de tomografia computadorizada (TC ou CAT)
Os exames por TC representam frequentemente o primeiro teste utilizado para buscar a presença de neuroblastoma no abdômen, na pelve e no tórax.O exame por TC é um teste com raios-x que produz imagens detalhadas em corte transversal de partes do corpo. Em vez de obter uma única imagem, como uma radiografia regular, o aparelho de TC pode captar muitas imagens à medida que gira em torno de seu/sua filho/filha enquanto ele ou ela estão deitados em uma mesa. Um computador então combina e transforma estas imagens em outras representando fatias da parte do corpo em estudo. Diferentemente de uma radiografia regular, o exame por TC cria imagens detalhadas dos tecidos moles no corpo.
Seu filho pode ter que beber uma solução de contraste e/ou nele ser introduzido um tubo IV (intravenoso) através do qual uma tinta corante é injetada. Isso ajuda a melhorar o contorno das estruturas no corpo. O contraste pode provocar algum rubor (sensação de calor, especialmente na face). Algumas pessoas são alérgicas e apresentam urticária. Raramente, reações mais sérias, como dificuldade de respirar ou pressão arterial baixa, podem ocorrer. Certifique-se de informar ao médico se seu filho sofre de quaisquer alergias ou se já apresentou uma reação a qualquer material de contraste utilizado para radiografias.
Os exames por TC podem demorar mais do que as radiografias regulares, mas não tanto como exames de Ressonância Magnética. Seu filho precisará permanecer sem se mexer em uma mesa, enquanto estes são realizados. Durante o exame, a mesa desliza para dentro e para fora do aparelho, uma máquina em forma de anel que envolve completamente a mesa. Algumas pessoas se sentem um pouco confinadas pelo anel no qual devem permanecer enquanto as imagens estão sendo capturadas. Em alguns casos, seu filho poderá ser sedado (receber medicamento que o torna sonolento), antes do exame, para diminuir a movimentação e ajudar a ter certeza de que as imagens saíram boas.
A TC espiral (conhecida também como TC helicoidal) é utilizada agora em muitos centros médicos. Este tipo de TC emprega uma máquina mais rápida que reduz a dose de radiação e rende imagens mais detalhadas.
Biópsia com agulha guiada por TC
Os exames por TC podem ser utilizados também para guiar com precisão uma agulha de biópsia até um tumor. Para esse procedimento, o paciente permanece na mesa de exame de TC, enquanto o radiologista introduz uma agulha de biópsia através da pele e em direção à massa. Os exames por TC são repetidos até que a agulha esteja no interior da massa. Uma amostra de biópsia por agulha fina ou amostra de biópsia por agulha de calibre maior é então removida e examinada sob um microscópio. Em crianças, este procedimento é sempre efetuado com anestesia geral (em que a criança está adormecida).Exame de imagem por ressonância magnética (IRM)
Exames de IRM fornecem imagens detalhadas de tecidos moles no corpo. Mas este tipo de exame emprega ondas de rádio e magnetos fortes, em vez de raios-x, de modo que não há radiação envolvida. A energia emitida pelas ondas de rádio é absorvida pelo corpo e então liberada em um padrão formado pelo tipo de tecido do corpo e por certas doenças. Um computador traduz o padrão em uma imagem muito detalhada de partes do corpo. Um material de contraste, denominado gadolínio, pode ser injetado em uma veia antes do exame para visualizar melhor os detalhes.Os exames de IRM são muito úteis para examinar o cérebro e a medula espinhal. Uma IRM pode ser ligeiramente melhor do que a TC para se avaliar a extensão do neuroblastoma, especialmente em torno da coluna vertebral, mas pode ser mais difícil para a criança.
Os exames de IRM demoram mais do que os da TC, muitas vezes durante até uma hora. Na maioria das máquinas de IRM, seu filho terá que permanecer no interior de um tubo estreito, que produz uma sensação de confinamento e pode ser estressante. Máquinas de IRM mais novas e mais abertas podem representar uma opção em alguns casos, mas ainda exigem que a criança permaneça sem se mexer por longos períodos de tempo. A máquina de IRM produz também um zumbido alto e ruídos tipo estalidos que podem ser perturbadores. Crianças mais jovens frequentemente são medicadas para ajudá-las a se manterem calmas ou mesmo dormirem durante o exame.
Ultrassom
A ultrassonografia emprega ecos de ondas sonoras para produzir imagens de órgãos ou massas internas. Um instrumento semelhante a um pequeno microfone, denominado transdutor, emite ondas de som e captura os ecos à medida que estes rebatem vindos de tecidos do corpo. Os ecos são convertidos por um computador em uma imagem em branco e preto sobre uma tela de computador.O ultrassom é um exame bastante rápido e fácil que não envolve radiação, sendo este o motivo pelo qual é frequentemente um dos primeiros exames efetuados na suspeita de uma massa interna. No exame de ultrassom, a criança simplesmente deita-se sobre uma mesa (ou os pais seguram a criança), e um técnico move o transdutor sobre pele ao longo da parte do corpo em exame. Em geral, a pele é lubrificada com um gel antes.
Às vezes, um ultrassom é utilizado para descobrir massas no abdômen (Não é utilizado para massas no tórax porque as costelas bloqueiam as ondas sonoras). Esse exame também é capaz de detectar se os rins se tornaram inchados porque o fluxo de saída de urina foi bloqueado por linfonodos aumentados ou por uma massa. O ultrassom pode ser utilizado também para guiar a penetração de agulha de biópsia em um tumor suspeito para coletar uma amostra para testes. É especialmente útil para verificar se os tumores no abdômen estão encolhendo.
Cintilografia com MIBG
Este exame emprega uma forma da substância química metaiodobenzilguanidina (MIBG) que contém uma pequena quantidade de iodo radioativo. A MIBG é semelhante à norepinefrina, um hormônio produzido por células nervosas simpáticas. É injetada em uma veia e percorre a corrente sanguínea e, na maioria dos pacientes, se fixará a células de neuroblastoma em qualquer local no corpo. Diversas horas ou dias mais tarde, o corpo é examinado com uma câmera especial para examinar áreas que capturaram a radioatividade. Isso ajuda aos médicos a dizerem onde o neuroblastoma se encontra e se este já se disseminou para os ossos e/ou outras partes do corpo.Este exame é preferido por muitos médicos como teste padrão em crianças com neuroblastoma. Pode ser repetido após o tratamento para conferir se este foi eficaz. Além disso, é bom saber se o tumor capta a MIBG porque, em alguns casos, essa molécula radioativa pode ser utilizada (em doses mais altas) para tratar o neuroblastoma (ver a seção “Radioterapia”).
Exame de tomografia por emissão de pósitrons (PET)
Em exame PET, uma substância radioativa (geralmente um tipo de açúcar relacionado à glicose, conhecido como FDG) é injetada no corpo. A quantidade de radioatividade utilizada é muito baixa. Como as células cancerosas estão crescendo muito rápido, elas absorvem grandes quantidades de açúcar radioativo. Uma câmera especial pode então criar uma imagem de áreas de radioatividade no corpo. A imagem não é finamente detalhada como em um exame de TC ou IRM, mas ainda pode fornecer informações úteis sobre o corpo inteiro.
Algumas máquinas mais modernas são capazes de realizar exame PET e de TC ao mesmo tempo (exame PET/TC). Isso permite que o médico compare áreas de radioatividade mais alta no PET com o aspecto mais detalhado daquela área na TC.Cintilografia óssea
Um exame ósseo pode ajudar a mostrar se um câncer já possui metástases (disseminou) nos ossos, e pode fornecer uma imagem de todo o esqueleto de uma só vez. O neuroblastoma muitas vezes provoca dano ósseo, o qual uma cintilografia óssea é capaz de encontrar. Este teste era realizado de rotina, mas em alguns centros foi substituído pelo uso de exames com MIBG ou PET.Neste teste, uma pequena quantidade de material radioativo de baixo nível (tecnécio 99) é injetada em uma veia. A substância se acumula em áreas de osso danificado por todo o esqueleto no decorrer de umas duas horas. Seu filho, então, fica deitado sobre uma mesa por cerca de 30 minutos enquanto uma câmara especial detecta a radioatividade e cria uma imagem do esqueleto. Crianças mais jovens podem receber um medicamento que as ajuda a se manterem calmas ou mesmo dormirem durante o teste.
Áreas de alterações ósseas ativas atraem a radioatividade e aparecem como “locais quentes” no esqueleto. Estas áreas podem sugerir a presença de câncer, mas outras doenças ósseas podem causar também o mesmo padrão. Para distinguir entre essas condições, outros exames de imagem, como radiografias planas ou exames de IRM, ou mesmo uma biópsia óssea poderia ser necessária.
Biópsias
Sinais e sintomas, testes laboratoriais e exames de imagem podem sugerir fortemente um neuroblastoma, mas uma biópsia (retirada de parte do tumor para visualização sob um microscópio e outros testes laboratoriais) é a única maneira para se ter certeza.
Durante uma biópsia, o médico retira uma amostra da massa tumoral. Em adultos, as biópsias são às vezes efetuadas com anestésico local (medicamento que adormece a área), mas em crianças, são mais frequentemente realizadas enquanto a criança está sob o efeito de anestesia geral (dormindo). Existem 2 principais tipos de biópsias:
• Biópsia incisional (aberta): Este tipo de biópsia é realizado cortando e retirando um pedaço do tumor através de uma abertura na pele.
• Biópsia com agulha (fechada): Para este tipo de biópsia, uma agulha oca é posicionada através da pele e para dentro do tumor. Se o tumor for profundo dentro do corpo, exames de TC ou por ultrassom podem ser utilizados para guiar a penetração da agulha no tumor.
As amostras da biópsia são então visualizadas sob um microscópio por um patologista.Alguns casos de neuroblastoma são facilmente reconhecidos quando examinados por médicos com experiência em testar amostras de tumores infantis. Porém, em alguns casos, pode ser difícil a diferenciação entre outros tipos de câncer na infância.
Nessas situações, testes especiais, como imunohistoquímica, precisam ser realizados. Para este teste, uma parte da amostra é tratada com proteínas especiais (anticorpos) que se fixam a substâncias em células de neuroblastoma, mas não de outros cânceres. Substâncias químicas (corantes) são então adicionadas de modo que células contendo estas substâncias mudem de cor e possam ser facilmente vistas sob um microscópio. Isso permite que o patologista saiba que o tumor é um neuroblastoma.
Outros tipos de testes laboratoriais podem ser realizados também em amostras de neuroblastoma para ajudar a determinar a velocidade com a qual o tumor provavelmente crescerá. Alguns destes estão descritos na seção, “Como é feito o estadiamento do neuroblastoma?”.
Aspiração e biópsia de medula óssea
O neuroblastoma muitas vezes se dissemina para a medula óssea (as partes internas esponjosas de certos ossos). Se os níveis sanguíneos ou urinários de catecolaminas estiverem aumentados, então o achado de células cancerosas em uma amostra de medula óssea é suficiente para diagnosticar neuroblastoma (sem obter uma biópsia do tumor principal). Se o neuroblastoma já tiver sido diagnosticado por uma biópsia efetuada em outro local no corpo, o teste na medula óssea é realizado para ajudar a determinar a extensão da doença.Aspiração e biópsia da medula óssea são realizados geralmente ao mesmo tempo. Na maioria dos casos, as amostras são coletadas da parte posterior de ambos os ossos pélvicos (do quadril).
Para uma aspiração de medula óssea, a criança deita-se sobre uma mesa (sobre o lado ou o abdômen). Depois da limpeza da pele que recobre o quadril, o médico adormece a área e a superfície com anestésico local, o que pode provocar uma picada ou sensação de ardor de curta duração. Mesmo com o anestésico local, a maioria dos pacientes ainda sente alguma dor momentânea quando a medula é retirada. Na maioria dos casos, a criança recebe também outros medicamentos para reduzir a dor ou mesmo para dormir durante o procedimento. Uma agulha oca e fina é então inserida dentro do osso e uma seringa é usada para sugar uma pequena quantidade se medula óssea líquida;
Uma biópsia da medula óssea é geralmente realizada logo depois da aspiração. Um pequeno pedaço de osso e de medula é retirado com uma agulha ligeiramente mais larga, que é torcida enquanto empurrada para penetrar no osso. A biópsia pode causar também alguma rápida dor. Uma vez realizada a biópsia, é aplicada pressão ao local para ajudar a parar qualquer sangramento.
Amostras da medula óssea são enviadas para um laboratório de patologia, onde serão examinadas e testadas quanto à presença de células cancerosas.
MARCADORES DE PROGNÓSTICO
Marcadores prognósticos são características específicas que ajudam a predizer se a previsão de cura da criança é melhor ou pior do que seria prevista apenas pelo estágio. Os marcadores abaixo são empregados para determinar o prognóstico de uma criança.
Histologia do tumor
A histologia do tumor é baseada em como as células do neuroblastoma se parecem sob o microscópico. Tumores que contenham um número maior de células e tecidos com aparência normais tendem a ter melhores prognósticos e são considerados como tendo histologia favorável. Tumores cujas células e tecidos aparentem mais anormais sob um microscópico tendem a ter prognóstico mais desfavorável e são identificados como portadores de histologia desfavorável.
Idade
Crianças mais jovens (abaixo de 12-18 meses) são mais prováveis de serem curadas do que crianças de mais idade.
Ploidia do DNA
A quantidade de DNA em cada célula, conhecida como ploidia, pode ser medida por técnicas laboratoriais especiais, como citometria de fluxo e citometria de imagem. Células de neuroblastoma com aproximadamente a mesma quantidade de DNA que células normais são classificadas como diploides. Células com quantidades aumentadas de DNA são denominadas hiperdiploides.
Em lactentes, células hiperdiploides tendem a ser associadas com estágios mais precoces da doença, respondem melhor à quimioterapia e geralmente predizem um prognóstico (resultado) mais favorável do que células diploides.
Amplificações do gene MYCN
MYCN é um oncogene, um gene que é importante para regulação do crescimento celular. Alterações destes genes podem fazer com as células cresçam e se dividam muito rapidamente, tal como ocorre com células cancerosas.
Pesquisadores descobriram que neuroblastomas com cópias demais (amplificação) do oncogene MYCN tendem a crescer mais rapidamente e são menos propensos ao amadurecimento. O prognóstico de crianças cujos neuroblastomas apresentam esta característica tende a ser pior do que o de outras crianças com neuroblastoma.
Outros marcadores
Estes marcadores não são utilizados para ajudar a determinar grupos de risco neste momento (ver abaixo), mas ainda são importantes e podem influenciar a decisão médica sobre o modo de tratamento de uma criança com neuroblastoma.
Citogenética: Neste teste laboratorial, o número de cromossomos em cada célula é contado sob um microscópio, e as anormalidades cromossômicas são descritas. Células normais possuem 46 cromossomos (2 conjuntos de 23), os quais são formados por DNA e proteína. Neuroblastomas com números normais de cromossomos tendem a crescer e se espalhar mais rapidamente do que aqueles com cromossomos extras.
Células que têm certas partes dos cromossomos 1 ou 11 faltando (conhecidas como deleções 1p ou deleções 11q), também podem predizer um prognóstico menos favorável. Acredita-se que estas partes de cromossomos, que estão ausentes em muitos pacientes com neuroblastoma, possam conter importantes genes supressores de tumor, porém mais estudos são necessários para confirmar esse dado.
Ter uma parte extra do cromossomo 17 (ganho 17q) também está vinculado a um pior prognóstico. Isso provavelmente significa que existe um oncogene nesta parte do cromossomo 17.
Compreender a importância de deleções/ganhos em cromossomos é uma área ativa da pesquisa sobre neuroblastomas.
Receptores de neurotrofinas (fator de crescimento neural): Estas substâncias estão presentes sobre a superfície de células nervosas normais e em algumas células de neuroblastoma. Elas normalmente permitem que as células reconheçam neurotrofinas – substâncias químicas semelhantes a hormônios que ajudam as células normais a amadurecerem.
Neuroblastomas que contenham mais de certos receptores de neurotrofinas, especialmente o receptor de crescimento neural denominado TrkA, podem ter melhor prognóstico.
Marcadores séricos: Níveis séricos (do sangue) de certas substâncias podem ser utilizados para ajudar a predizer o prognóstico.
Células de neuroblastoma liberam ferritina, uma substância química que integra de modo importante o metabolismo normal do ferro no corpo, no sangue. Pacientes com altos níveis de ferritina tendem a ter pior prognóstico.
Enolase neuronal específica (NSE) e desidrogenase láctica (LDH) são produzidas por diversos tipos de células normais, bem como por células do neuroblastoma. Níveis elevados de NSE e LDH no sangue são muitas vezes associados com pior previsão em crianças com neuroblastoma.
Uma substância na superfície de muitas células nervosas, conhecida como gangliosídeo GD2, está frequentemente aumentada no sangue de pacientes com neuroblastoma. Embora a utilidade de GD2 para predizer prognósticos seja desconhecida, este pode vir a ser mais útil em tratar o neuroblastoma (ver a seção, “Quais são as novidades na pesquisa e no tratamento do neuroblastoma?”).
- Tratamento
-
Como o neuroblastoma é tratado?
Estas informações representam as opiniões dos médicos e enfermeiros que atuam no Conselho Editorial do Banco de Dados de Informação sobre Câncer da American Cancer Society. Estas opiniões estão fundamentadas na interpretação que fazem de estudos publicados em periódicos médicos, bem como em sua própria experiência profissional.
As informações sobre o tratamento neste documento não se destinam a ser orientação médica que substitua a especialização e o juízo de sua equipe para o tratamento de câncer. A intenção pretendida é ajudar você e a sua família na tomada de decisões esclarecidas, junto com seu médico.Seu médico pode ter motivos para sugerir um plano de tratamento diferente destas opções terapêuticas gerais. Não hesite em lhe fazer perguntas sobre suas opções de tratamento.
Tratar neuroblastoma é complexo e muitas vezes requer o conhecimento específico de diferentes médicos, enfermeiros e de outros profissionais de saúde. Oncologistas pediátricos, cirurgiões, radio-oncologistas e enfermeiros com especialização em oncologia se reunirão para planejar o tratamento mais eficaz.A abordagem para o tratamento de neuroblastoma depende do estágio do câncer, da idade da criança e de outros fatores, como os marcadores prognósticos citados previamente. Os tipos de tratamento utilizados podem incluir:
• Cirurgia
• Quimioterapia
• Terapia com retinoides
• Radioterapia
• Quimioterapia/radioterapia em alta dose e transplante de células-tronco
• ImunoterapiaEm muitos casos, mais de um tipo de tratamento é necessário.
As poucas seções seguintes descrevem os tipos de tratamento utilizados para neuroblastomas. A esta se segue uma discussão sobre quando estes tratamentos são utilizados em diferentes situações.
Biópsia cirúrgica (aberta)
Antes que o tratamento se inicie, os médicos podem efetuar uma biópsia cirúrgica para retirar amostras do tumor a serem examinadas sob um microscópico e para outros testes laboratoriais. Se o tumor estiver situado no abdômen, o cirurgião poderá efetuar a biópsia com o auxílio de um laparoscópio. Este instrumento é um tubo fino e longo com uma câmara de vídeo diminuta na extremidade. É inserido no abdômen através de uma pequena incisão para permitir ao cirurgião visualizar o interior. O cirurgião faz então uma segunda pequena incisão para atingir o interior do abdômen com instrumentos finos e longos e retirar um pequeno pedaço de tumor.
Cirurgia
A cirurgia pode ser utilizada tanto para diagnosticar como para tratar o neuroblastoma. Para tumores menores que não se disseminaram, a cirurgia é frequentemente o único tratamento que é necessário.
Cirurgia como tratamento
Depois que o neuroblastoma é diagnosticado, a cirurgia é muitas vezes utilizada para tentar remover tanto tumor quanto possível. Em alguns casos, a cirurgia consegue retirar o tumor inteiro e levar à cura.
Durante a operação, o cirurgião cuidadosamente procura por sinais de disseminação do tumor para outros órgãos. Linfonodos próximos (pequenas coleções de células do sistema imune para as quais com frequência o tumor primeiro se espalha) são retirados e examinados sob um microscópico para detectar células cancerosas.
Se possível, o cirurgião removerá o tumor inteiro. Isso é menos provável ser possível se o tumor estiver próximo de estruturas vitais ou envolvido em torno de grandes vasos sanguíneos. Mesmo se o tumor não puder ser completamente extraído, o tratamento com quimioterapia (e às vezes radioterapia), depois da retirada da maior parte do câncer, pode resultar em cura. Algumas vezes, a cirurgia é repetida depois de outros tratamentos (quimioterapia e/ou radioterapia) para verificar os resultados da terapia e para retirar qualquer câncer restante se possível. Se o tumor for muito grande, quimioterapia pode ser empregada antes da cirurgia. Com isso, o tumor pode retrair-se e facilitar a sua remoção completa.
Possíveis riscos e efeitos colaterais da cirurgia
Tal como acontece com todas as formas de tratamento, a cirurgia acarreta alguns riscos de complicações. Estas dependem da localização e da extensão da operação e da saúde prévia da criança. Complicações sérias, embora raras, podem incluir problemas com a anestesia, sangramento excessivo, infecções na ferida e dano a vasos sanguíneos, rins, outros órgãos ou a nervos. A maioria das crianças sentirá alguma dor por um tempo após a operação, mas isso pode em geral ser rapidamente ajudado com medicamentos se necessários.
Imunoterapia
Anticorpos monoclonais são versões produzidas pelo homem de proteínas do sistema imune, cuja produção pode ser direcionada para atacar um alvo muito específico. Essas moléculas podem ser injetadas no sangue para buscar e atacar células cancerosas.
Um anticorpo monoclonal, denominado ch.14.18, foi desenvolvido para atacar o gangliosídeo GD2, uma substância encontrada na superfície de muitas células de neuroblastoma. Este anticorpo é administrado muitas vezes junto com citocinas (hormônios do sistema imune), como GM-CSF e interleucina-2 (IL-2). Essa combinação pode ajudar o sistema imune de seu filho a reconhecer e destruir células do neuroblastoma.
Este anticorpo faz parte agora do tratamento de rotina para muitas crianças com neuroblastoma de alto risco, frequentemente depois de um transplante de células-tronco.
Possíveis efeitos colaterais
Os efeitos colaterais de ch.14.18 podem incluir dor neuropática, extravasamento de líquido no corpo (que pode leva abaixar a pressão arterial, acelerar a frequência cardíaca, dificultar a respiração e provocar inchaço) e reações alérgicas.
Quimioterapia
A quimioterapia emprega medicamentos contra câncer, geralmente administrados na veia (intravenoso). Os medicamentos penetram na corrente sanguínea e circulam por todo o corpo para atingir e destruir as células de câncer. Isso torna a quimioterapia útil para tratar neuroblastoma que tenha se disseminado para os linfonodos, a medula óssea, o fígado, os pulmões ou outros órgãos.
Algumas crianças com neuroblastoma são tratadas com quimioterapia, administrada antes da cirurgia (quimioterapia neoadjuvante) ou depois da cirurgia (quimioterapia adjuvante). Em outros casos, especialmente quando o câncer já se espalhou demais para ser completamente removido por cirurgia, a quimioterapia é o principal tratamento.
A maioria das crianças com neuroblastoma necessitará se submeter à quimioterapia. Na maior parte dos casos, diversos medicamentos são fornecidos. Os principais medicamentos utilizados para tratar crianças com neuroblastoma incluem:
• Ciclofosfamida ou ifosfamida
• Cisplatina ou carboplatina
• Vincristina
• Doxorrubicina (Adriamicina)
• Etoposídeo
• TopotecanoA combinação mais comum de medicamentos para tratar neuroblastoma consiste em carboplatina (ou cisplatina), ciclofosfamida, doxorrubicina e etoposídeo, mas outros podem ser utilizados. Para crianças no grupo de alto risco, combinações maiores de medicamentos são utilizadas, e suas doses são mais altas, e que podem ser seguidas por transplante de células-tronco (este procedimento está descrito mais adiante).
Os médicos administram a quimioterapia em ciclos, o que consiste em tratamento em uns poucos dias consecutivos, seguido por um período de tempo sem tratamento para permitir que o corpo se recupere. Os ciclos são tipicamente repetidos a cada 3 ou 4 semanas. A duração total do tratamento depende do grupo de risco ao qual a criança pertence – grupos de risco mais alto requerem em geral tratamento mais longo.
Possíveis efeitos colaterais da quimioterapia
Medicamentos quimioterápicos atuam atacando células em rápida divisão, sendo este o motivo porque atuam contra células cancerosas. Porém, outras células no corpo, como aquelas presentes na medula óssea, no revestimento da boca e dos intestinos e os folículos pilosos, também se dividem rapidamente. Estas células provavelmente serão também afetadas pela quimioterapia, o que leva a efeitos colaterais.
Crianças parecem ter vantagem sobre adultos no que diz respeito à quimioterapia. Os efeitos colaterais que sofrem tendem a ser menos graves e sua recuperação, mais rápida. Um benefício resultante é que os médicos podem administrar doses altas de quimioterapia, necessárias para eliminar o tumor.
Os efeitos colaterais da quimioterapia dependem do tipo e da dose de medicamentos e da duração de tempo na qual são tomados. Efeitos colaterais gerais de medicamentos quimioterápicos podem incluir:
• Queda de cabelo
• Feridas na boca
• Perda de apetite
• Náusea e vômitos
• Diarreia
• Maior chance de sofrer infecções (que se deve a baixas contagens de leucócitos)
• Facilidade em se machucar e sangrar
• Fadiga (que se deve a baixas contagens de hemácias)A maioria destes efeitos colaterais é de curta duração e tende a desaparecer depois que o tratamento é finalizado. Com frequência, existem maneiras para diminuir estes efeitos colaterais. Por exemplo, podem ser fornecidos medicamentos que ajudem a prevenir ou a reduzir a náusea e os vômitos. Certifique-se de discutir quaisquer dúvidas que tenha sobre efeitos colaterais com a equipe de tratamento do câncer.
Junto com os efeitos listados acima, alguns outros são específicos de certos medicamentos:
Ciclofosfamida e ifosfamida podem provocar lesões na bexiga. Essa ocorrência pode ser evitada ou minimizada administrando estes medicamentos com bastante líquido e incluindo um medicamento denominado mesna, que ajuda a proteger a bexiga. Estes medicamentos são capazes também de danificar os ovários ou os testículos e podem afetar a fertilidade (a capacidade de procriar).Doxorrubicina pode causar lesão ao coração. Os médicos tentam reduzir esse risco tanto quanto possível ao não administrarem mais do que as doses recomendadas de doxorrubicina e verificando o coração com um exame denominado ecocardiograma (um ultrassom do coração) durante o tratamento. Este medicamento pode provocar também lesão na pele se extravasar da veia durante a administração.
Cisplatina e carboplatina podem afetar os rins. Fornecer bastante líquido pode ajudar a reduzir esse risco. Estes medicamentos podem afetar também a audição em alguns casos. Esse problema pode ser verificado pelo médico de seu filho com testes de audição (audiogramas) durante ou depois do tratamento.
Vincristina pode provocar lesões nos nervos. Alguns pacientes podem sentir formigamento e dormência, especialmente nas mãos e nos pés.
Em alguns casos, a quimioterapia pode ter também efeitos colaterais em prazo mais longo. Por exemplo, alguns medicamentos utilizados para tratar neuroblastoma podem aumentar o risco do desenvolvimento mais tardio de leucemia mieloide aguda (LMA), um tipo câncer do sangue. Embora seja sério, este risco não é comum, e a importância da quimioterapia no tratamento do neuroblastoma supera de longe este risco. Para mais informações sobre os possíveis efeitos do tratamento em longo prazo, ver a seção “O que acontece depois do tratamento para o neuroblastoma?”
Quimioterapia/Radioterapia
Quimioterapia/radioterapia em altas doses e transplante de células-tronco para neuroblastoma
Este tipo de tratamento é frequentemente utilizado em crianças com neuroblastoma de alto risco, que provavelmente não serão curadas com outros tratamentos. Este tratamento envolve administrar altas doses de quimioterapia (mais altas do que poderiam ser fornecidas com segurança de outra forma) e/ou de radioterapia (irradiação de corpo inteiro ou MIBG em alta dose) e, em seguida, repor as células da medula óssea do corpo, que foram mortas pelo tratamento. No passado, este tipo de tratamento era comumente designado transplante de medula óssea.
A medula óssea é a parte interna esponjosa de alguns ossos, onde novas células vermelhas, brancas e plaquetas são formados. As células vermelhas transportam oxigênio para todas as partes do corpo. As células brancas fazem parte do sistema imune, que combate as infecções. As plaquetas são necessárias para interromper o sangramento causado por cortes e arranhões.
A quimioterapia e alguns tipos de radiação podem afetar células-tronco formadoras de sangue na medula óssea (Estas são as células que produzem os diferentes tipos de células sanguíneas). Embora possam ser mais eficazes em tratar tumores, os tratamentos mais intensos não podem ser fornecidos, pois poderiam causar dano grave à medula óssea, levando a déficits de células sanguíneas que acarretam risco à vida.
Os médicos tentam contornar este problema, administrando à criança uma infusão de células-tronco formadoras de sangue depois do tratamento. Este procedimento é conhecido como transplante de células-tronco do sangue periférico (PBSCT).
O que o procedimento envolve
A primeira etapa em um PBSCT é coletar, ou “colher”, as células-tronco produtoras de sangue da própria criança para utilizar mais tarde. No passado, as células-tronco eram frequentemente coletadas da medula óssea da criança, o que exigia perfurar pequenos orifícios em certos ossos. Contudo, os médicos descobriram que células-tronco podem ser coletadas da corrente sanguínea durante um procedimento conhecido como aférese. O procedimento é semelhante a doar sangue, mas em vez do sangue ir para uma bolsa coletora, via para uma máquina especial que filtra e retira as células-tronco e devolve as outras partes do sangue de volta para o corpo da pessoa. Esse processo pode ser repetido durante alguns dias. As células-tronco são então congeladas até o transplante.
Depois das células-tronco terem sido coletadas, a criança recebe quimioterapia em alta dose. Isso destrói as células cancerosas no corpo, mas também as células normais na medula óssea. Quando o tratamento é concluído, as células-tronco do paciente são descongeladas e devolvidas para o corpo em um processo semelhante a uma transfusão normal de sangue. As células-tronco viajam através da corrente sanguínea e se alojam na medula óssea. Durante as 3 ou 4 semanas seguintes, as células-tronco começam a produzir novas células sanguíneas sadias na medula óssea.
Até que isso ocorra, a criança está em alto risco de infecção por apresentar baixa contagem de leucócitos, bem como de sangramento por baixa contagem de plaquetas. Medidas de proteção são adotadas, para evitar a ocorrência de infecções, como filtros de ar especiais no quarto de hospital e fazer com que os visitantes vistam roupas protetoras. Transfusões de sangue e de plaquetas e tratamento com antibióticos IV podem ser utilizados também para ajudar a prevenir ou tratar infecções ou problemas de sangramento.
Os pacientes geralmente permanecem no hospital em isolamento visando proteção (vigilância contra a exposição a germes), até que parte de sua contagem de células brancas (conhecida como a contagem absoluta de neutrófilos ou CAN) se eleve para acima de 500. A alta do hospital pode ser permitida quando a contagem absoluta de neutrófilos estiver próxima de 1.000. A criança é então acompanhada em uma clínica ambulatorial quase todos os dias por muitas semanas. As contagens de plaquetas muitas vezes demoram mais para retornarem a um nível seguro, portanto, as transfusões de plaquetas podem ser administradas no acompanhamento ambulatorial.
O transplante de células-tronco é um tratamento complexo. Se o médico considerar que seu filho possa se beneficiar de um transplante, o melhor lugar a ser realizado é em um centro de câncer reconhecido nacionalmente, onde a equipe possui experiência em realizar o procedimento e controlar o período de recuperação.
Possíveis efeitos colaterais
Possíveis complicações e efeitos colaterais precoces podem ser sérios e são basicamente os mesmos que os causados por quimioterapia (ver a seção “Quimioterapia” deste documento) ou radioterapia em alta dose. Os efeitos colaterais devem-se ao dano à medula óssea e a outros tecidos do corpo que se dividem rapidamente. Estes efeitos podem incluir baixas contagens de células sanguíneas (acompanhadas por cansaço e risco aumentado de infecção e sangramento), náusea, vômitos, perda de apetite, feridas na boca e queda de cabelos, entre outros.
Um dos efeitos imediatos mais comuns e sérios é maior risco de infecção. Antibióticos são frequentemente administrados para tentar prevenir essa ocorrência. Outros efeitos colaterais, como baixa contagem de hemácias e de plaquetas, podem exigir transfusões de derivados do sangue ou outros tratamentos.
Algumas complicações e efeitos colaterais podem persistir por longo tempo ou podem não ocorrer até anos depois do transplante. Por exemplo, o tratamento pode afetar o desenvolvimento ósseo, a fertilidade ou níveis hormonais, e pode aumentar o risco de desenvolver outro câncer mais tarde na vida. Certifique-se de conversar com o médico de seu filho antes do transplante para informar-se sobre possíveis efeitos tardios que seu filho pode apresentar.
Radioterapia
A radioterapia emprega raios ou partículas de alta energia para eliminar as células cancerosas. A radiação é, às vezes, uma parte necessária do tratamento, mas em virtude dos possíveis efeitos colaterais tardios em crianças, é evitada quando possível. Dois tipos de radioterapia podem ser utilizados para tratar crianças com neuroblastoma.
– Radioterapia por feixe externo
Este tipo de radioterapia focaliza a radiação sobre o câncer a partir de uma fonte fora do corpo. Existem diversas situações nas quais este tipo de radioterapia poderia ser utilizado:
• Para destruir células do neuroblastoma que permanecem depois da cirurgia e quimioterapia
• Para tentar reduzir o tamanho do tumor antes da cirurgia, tornando mais fácil sua extração no procedimento cirúrgico
• Para tratar tumores maiores que estejam causando problemas sérios (como dificuldade em respirar) e que não respondem rapidamente à quimioterapia
• Como parte do esquema terapêutico (junto com quimioterapia em alta dose) antes de um transplante de células-tronco em crianças com neuroblastoma de alto risco
• Para ajudar a aliviar a dor causada por neuroblastoma avançadoA radiação é direcionada tipicamente ao próprio tumor, mas em alguns caso pode também visar outras partes do corpo para reduzir o risco de disseminação do câncer. Quando administrada por todo o corpo, a radiação é conhecida como irradiação de corpo inteiro (ICI).
Antes que o tratamento inicie, a equipe da radiação obtém medidas cuidadosas com auxílio de exames de imagem, tais como exames de IRM, para determinar os ângulos corretos para direcionar os feixes de radiação e a dose apropriada de radiação.
A radioterapia é muito semelhante a submeter-se a uma radiografia, mas a dose de radiação é muito mais alta. Para cada sessão, seu filho deita-se sobre uma mesa especial enquanto uma máquina administra a radiação a partir de um ângulo preciso. O tratamento não é doloroso.
A duração real do tratamento é de somente alguns minutos, mas o tempo para preparação – posicionar corretamente seu filho para o tratamento – geralmente dura mais. Crianças pequenas podem receber medicamentos que as façam dormir de modo que não se movam durante o tratamento. O número de sessões de radioterapia dependerá da situação.
Possíveis efeitos colaterais: Os efeitos colaterais da radioterapia dependem da dose e do alvo ao qual a radiação é direcionada.Efeitos colaterais em curto prazo da radioterapia externa podem incluir reações cutâneas leves, náusea, diarreia ou cansaço. Com frequência, estes efeitos desaparecem em pouco tempo. Converse com o médico de seu filho sobre os possíveis efeitos colaterais, pois existem maneiras para aliviar alguns destes. A radiação pode também fazer com que os efeitos colaterais da quimioterapia piorem.
A radioterapia pode interferir com o crescimento de tecidos sadios do corpo, inclusive dos ossos, e pode aumentar o risco de desenvolver outros cânceres mais tarde. A fim de diminuir o risco de efeitos sérios tardios provocados pela radiação, os médicos tentam usar a dose mais baixa de radioterapia que seja ainda eficaz.
– Radioterapia com MIBG
Como descrito na seção “Como o neuroblastoma é diagnosticado?”, MIBG é uma substância química semelhante à norepinefrina, a qual é produzida por células nervosas simpáticas. Uma forma levemente radioativa de MIBG é às vezes injetada na corrente sanguínea como parte de um teste de imagem para identificar células de neuroblastoma no corpo.
Uma forma mais altamente radioativa de MIBG é utilizada também para tratar alguns pacientes com neuroblastoma avançado, muitas vezes junto com outros tratamentos. Uma vez injetado na corrente sanguínea, o MIBG vai para os sítios de tumores em qualquer local no corpo, onde libera sua radiação. A criança necessitará permanecer em uma sala especial por alguns dias depois da injeção, até que a maior parte da radiação tenha deixado o corpo.
Possíveis efeitos colaterais: A terapia com MIBG pode causar às vezes náusea e vômitos. Além disso, pode reduzir a contagem de células do sangue por seus efeitos sobre a medula óssea. Em casos raros, pode elevar a pressão arterial por um curto período de tempo. Por conter iodo, o MIBG pode se acumular na glândula tireoide no pescoço, capaz de resultar às vezes em níveis baixos do hormônio da tireoide no corpo.Terapia com retinoides para neuroblastoma
Retinoides são substâncias químicas que são relacionadas com a vitamina A. São conhecidos como agentes de diferenciação por acreditar-se que ajudem algumas células cancerosas a amadurecerem (diferenciarem-se) em células normais.
Em crianças com neuroblastoma de alto risco, o tratamento com um retinoide denominado ácido 13-cis retinoico (isotretinoína) reduz o risco de recorrência após quimioterapia em alta dose e transplante de células-tronco. A maioria dos médicos recomenda 6 meses de ácido 13-cis retinoico (tomado em forma de cápsula) uma vez concluído o transplante.
Pesquisadores estão atualmente tentando desenvolver retinoides mais eficazes e definir a função exata dessa abordagem no tratamento do neuroblastoma.
Possíveis efeitos colaterais
O efeito colateral mais comum do ácido 13-cis retinoico é o ressecamento e fissuramento dos lábios. Pele e olhos ressecados são possíveis também, como o são sangramentos nasais e alterações nas unhas.
Tratamento por Grupo
Tratamento de neuroblastoma por grupo de risco
O tratamento para neuroblastoma baseia-se em grande medida no grupo ao qual uma criança se enquadre.
Baixo risco
Crianças em baixo risco frequentemente requerem somente cirurgia como o único tratamento. Mesmo em casos em que alguma parte do neuroblastoma é deixada atrás depois da cirurgia, a criança pode ser vigiada cuidadosamente sem tratamento adicional porque o tumor restante muitas amadurecerá ou desaparecerá por sua própria conta.
A quimioterapia é tipicamente administrada depois da cirurgia se muito do tumor não puder ser removido ou se este apresentar algumas características desfavoráveis. Um esquema quimioterápico comum é uma combinação de carboplatina, ciclofosfamida, doxorrubicina e etoposídeo. Porém, outras combinações poderão ser utilizadas.
Para aquelas poucas crianças com sintomas provocados por um tumor que não pode ser tratado de modo seguro imediatamente com cirurgia, um ciclo curto de quimioterapia poderia ser administrado. Por exemplo, se o tumor estiver pressionando a medula espinhal ou afetando a respiração, a quimioterapia pode ser utilizada para encolher o tumor e controlar os sintomas. A radioterapia pode ser necessária se a quimioterapia não retrair o tumor com a velocidade necessária.
Lactentes com a doença no estágio 4S e sem sintomas podem muitas vezes ser vigiados cuidadosamente sem tratamento, uma vez que estes cânceres tipicamente amadurecem ou desaparecem sozinhos. Se o tumor fizer com que o fígado aumente de volume, o que pode acarretar risco à vida para lactantes muito jovens, quimioterapia menos intensa pode ser utilizada para encolher o tumor. A radioterapia pode ser utilizada se a quimioterapia não retrair de imediato o fígado.
Risco intermediário
A cirurgia é uma parte importante do tratamento para crianças em risco intermediário, mas, raramente é suficiente sozinha. Tipicamente, são administrados de 4 a 8 ciclos (em torno de 12 a 24 semanas) de quimioterapia às crianças antes ou depois da cirurgia. Os medicamentos quimioterápicos utilizados são normalmente os mesmos que para a doença de baixo risco, embora as doses possam ser mais altas. A radioterapia pode ser empregada se a quimioterapia não surtir efeito.
Se quimioterapia for utilizada antes da cirurgia, uma “cirurgia de revisão” poderá ser realizada para examinar se há qualquer resto do câncer e, se presente, retirá-lo se possível. Esse procedimento pode ser seguido por radioterapia, se necessário.
Alto risco
Crianças em alto risco requerem tratamento mais agressivo, o que frequentemente inclui uma combinação de quimioterapia, cirurgia e radiação. O tratamento é muitas vezes dividido em 3 fases.
Indução: A meta desta fase é fazer com que o câncer entre em remissão, destruindo ou retirando tanto do tumor quanto possível. O tratamento em geral se inicia com quimioterapia, empregando mais medicamentos e a doses mais altas do que é utilizado em outros grupos de risco. A cirurgia pode ser realizada em seguida para tentar retirar quaisquer tumores que sejam ainda visíveis.
Consolidação: Nesta fase, o tratamento é mais intensivo para tentar se livrar de quaisquer células cancerosas que restem no corpo. Quimioterapia em alta dose é administrada (muitas vezes junto com radioterapia), seguido por transplante de células-tronco.
Manutenção: Esta fase de tratamento é fornecida para tentar reduzir a probabilidade de que o câncer retorne. O medicamento retinoide, ácido 13-cis retinoico (isotretinoína) é frequentemente administrado por 6 meses, depois que os outros tratamentos tiverem concluído. Adicionalmente, imunoterapia com o anticorpo monoclonal ch14.18, junto com citocinas ativadoras do sistema imune (GM-CSF e IL-2) são com frequência administrados também.
Terapia Complementar
Terapias complementares e alternativas para neuroblastoma
Quando seu filho tem câncer, você provavelmente ouvirá muitas maneiras para tratar seu câncer ou para aliviar sintomas que seu médico não tenha citado. Todos, de amigos e família a grupos na Internet e sites na Rede, podem oferecer ideias para o quê poderia ajudá-lo. Esses métodos podem incluir vitaminas, fitoterápicos e dietas especiais, ou outros como acupuntura ou massagem, para citar alguns. Consulte sempre o médico responsável pelo tratamento antes de qualquer ação.
O que são exatamente terapias complementares e alternativas?
Nem todos usam estes termos da mesma maneira, e são utilizados para se referirem a muitos diferentes métodos, de modo que podem provocar confusão. Utilizamos complementar para nos referirmos a tratamentos que são utilizados juntos com seu tratamento médico regular. Tratamentos alternativos são utilizados em vez de um tratamento médico do doutor.
Métodos complementares: A maioria dos métodos de tratamento complementar não é oferecida como uma cura para o câncer. São empregados, principalmente, para ajudar a pessoa com câncer a se sentir melhor. Alguns dos métodos que são utilizados junto com o tratamento regular são: arteterapia e terapia com brincadeiras para reduzir o estresse; acupuntura para ajudar a aliviar a dor; ou chá de hortelã para aliviar a náusea. Alguns métodos complementares são conhecidos por ajudar, enquanto outros não foram testados. Alguns foram comprovados não ser úteis, e uns poucos demonstraram mesmo serem nocivos.
Tratamentos alternativos: Tratamentos alternativos podem ser oferecidos como curas para o câncer. A segurança e a eficácia destes tratamentos não foram comprovadas em estudos clínicos. Alguns destes métodos podem representar um perigo, ou terem efeitos de risco à vida. Mas o maior perigo na maioria dos casos é que seu filho pode perder a oportunidade de ser ajudado pelo tratamento médico padrão. Atrasos ou interrupções em tratamento médicos podem permitir mais tempo ao câncer para crescer e tornar menos provável que o tratamento ajude.
Descobrindo mais
É fácil ver o motivo porque pais com filhos portadores de câncer consideram métodos alternativos. Você quer fazer tudo que pode para ajudar a combater o câncer, e a ideia de um tratamento sem ou com poucos efeitos colaterais parece ser fantástica. Às vezes, tratamentos médicos como a quimioterapia podem ser difíceis de fazer, ou podem demorar muito para funcionar. Mas, a verdade é que a maioria destes tratamentos alternativos não foi testada e comprovou funcionar no tratamento de câncer.
Ao considerar as opções de seu filho, abaixo, são apresentados 3 importantes passos que você pode tomar:
• Procure por “sinais de alerta” que sugiram fraude. O método promete curar todos ou quase todos os cânceres? Disseram-lhe para não usar tratamentos médicos regulares? O tratamento é “secreto” e somente pode ser administrado por certos profissionais ou em outro país?
• Converse com o médico ou o enfermeiro de seu filho sobre qualquer método que você esteja considerando.A escolha é sua
A decisão sobre como tratar seu filho é sempre sua. Se você quiser usar um tratamento fora do padrão, aprenda tudo que possa sobre o método e converse com o médico de seu filho a respeito. Com boas informações e o suporte da equipe de tratamento de saúde, você pode ser capaz de usar com segurança os métodos que possam ajudar ao mesmo tempo em que evitar aqueles que poderiam ser prejudiciais.
NEUROBLASTOMA RECORRENTE
Neuroblastoma recorrente – E se o neuroblastoma voltar?
Infelizmente, às vezes, o neuroblastoma pode retornar após a terapia inicial. Isso é conhecido como recorrência ou recidiva. O tratamento nesse ponto dependerá de muitos fatores, inclusive o grupo de risco inicial, o local onde o câncer recorre e quais tratamentos foram utilizados.
Para neuroblastomas de risco intermediário ou baixo cuja recorrência seja na mesma área em que iniciaram, pode ser eficaz cirurgia associada ou não com quimioterapia.
Para cânceres de risco mais alto ou aqueles que recorrem em partes distantes do corpo, o tratamento é geralmente mais intenso, e poderá incluir uma combinação de quimioterapia, cirurgia e radioterapia (como radioterapia com MIBG). A quimioterapia poderia incluir medicamentos que não foram utilizados durante o tratamento inicial. Em alguns casos de recidiva, tratamento intensivo com quimioterapia/radioterapia em alta dose, seguido por transplante de células-tronco, pode ser utilizado. Considerando que estes cânceres são de difícil tratamento, testes clínicos de tratamentos experimentais, como anticorpos monoclonais ou novos medicamentos anticâncer, podem ser outra opção razoável (Ver a seção, “Quais são as novidades na pesquisa e no tratamento do neuroblastoma?”).
CUIDADOS PÓS TRATAMENTO
O que acontece após o tratamento para o neuroblastoma?
Muitas crianças com neuroblastoma têm uma boa probabilidade de sobrevida duradoura depois do tratamento.
Após o tratamento para o neuroblastoma, as principais preocupações para a maioria das famílias são os efeitos imediatos e tardios do tumor e de seu tratamento, e preocupações sobre a possível recorrência do tumor.
É certamente compreensível querer colocar para trás o tumor e seu tratamento e retornar a uma vida que não gire em torno de câncer. Mas, é importante perceber que os cuidados de acompanhamento representam uma parte central do processo que oferece a seu filho a melhor oportunidade para recuperação e sobrevida longa.
Exames de acompanhamento
Após o tratamento, o médico provavelmente pedirá testes de acompanhamento, os quais poderão incluir testes laboratoriais e testes de imagem (exames com MIBG, exames de PET, ultrassom, exames de TC e/ou exames de IRM) para verificar se há qualquer tumor restante. Os testes realizados dependerão do grupo de risco, do tamanho e da localização do tumor e de outros fatores.
Tendo em vista que há uma probabilidade de que o câncer possa retornar após o tratamento inicial, é muito importante manter todos os compromissos de acompanhamento e relatar imediatamente quaisquer novos sintomas ao médico de seu filho. A equipe do tratamento de saúde discutirá com você um cronograma de acompanhamento, inclusive quais testes devem ser realizados e qual com frequência. Visitas ao médico, testes laboratoriais e exames de imagem para averiguar sinais de recorrência são efetuados mais frequentemente no início. Se nada anormal é encontrado, o tempo entre os testes pode ser ampliado.
Um benefício do atendimento de acompanhamento é que este lhe oferece a oportunidade para discutir quaisquer perguntas e preocupações que surjam durante e depois da recuperação de seu filho. Por exemplo, quase todo tratamento contra o câncer pode ter efeitos colaterais. Alguns podem durar de poucas semanas a muitos meses, mas outros podem ser permanentes. É importante relatar imediatamente quaisquer novos sintomas ao médico de modo que a causa possa ser determinada e tratada, se necessário.
É importante também manter o plano de saúde. Apesar de ninguém querer pensar a esse respeito, a volta do câncer é sempre uma possibilidade. Se acontecer, a última coisa que você desejaria é ter que se preocupar com o pagamento pelo tratamento.
Manter bons registros médicos
Por mais que você possa querer esquecer a experiência uma vez que o tratamento tenha sido concluído, é também muito importante manter bons registros do atendimento médico de seu filho durante esse período. Isso pode ser muito útil para seu filho e seus médicos mais tarde quando adulto. Há certas informações que você deve assegurar que os médicos de seu filho possuam.
Estas são:
• Uma cópia do(s) laudo(s) de patologia de quaisquer biópsias ou cirurgias
• Se houve uma cirurgia, uma cópia do(s) laudo(s) da operação
• Caso seu filho tenha sido hospitalizado, cópias dos resumos de alta que os médicos preparam quando os pacientes são enviados para casa
• Caso seu filho tenha recebido quimioterapia ou outros medicamentos para o câncer, uma lista dos medicamentos, de suas doses e quando foram administrados
• Se houve radiação, um resumo do tipo e da dose de radiação e quando e onde foi administradoEfeitos em longo prazo do neuroblastoma e de seu tratamento
O próprio neuroblastoma e seu tratamento são capazes às vezes de resultar em efeitos duradouros.
Em circunstâncias muito raras e por motivos desconhecidos, em algumas crianças com neuroblastoma, o sistema imune do corpo ataca o tecido nervoso normal da criança. Isso pode levar a problemas como deficiências no aprendizado, atrasos no desenvolvimento muscular, problemas de fala e no comportamento. Crianças cujo tumor surja no pescoço ou no tórax e que tenham problemas com os olhos ou com torções musculares podem necessitar tratamento adicional com corticosteroides ou outros hormônios para suprimir seu sistema imune.
Graças aos grandes avanços terapêuticos, um número maior de crianças tratadas para câncer está sobrevivendo agora até a idade adulta. Os médicos aprenderam que o tratamento pode afetar a saúde das crianças mais tarde na vida, de modo que vigiar efeitos à saúde à medida que envelhecem tornou-se mais uma preocupação nos últimos anos.
Tratar câncer infantil requer uma abordagem muito especializada, assim como os cuidados e o acompanhamento após o tratamento. Quanto mais cedo quaisquer problemas possam ser reconhecidos, mais provavelmente poderão ser tratados eficazmente.
Sobreviventes de câncer infantil estão em risco, em certa medida, de diversos possíveis efeitos tardios ocasionados por seu tratamento contra o câncer. Este risco depende de alguns fatores, como o tipo de câncer, os tratamentos específicos recebidos para câncer, doses de tratamento contra o câncer e a idade em que receberam o tratamento contra o câncer. Os efeitos tardios do tratamento para o câncer podem incluir:
• Problemas cardíacos ou pulmonares (em decorrência de certos medicamentos quimioterápicos ou à radioterapia)
• Crescimento e desenvolvimento retardado ou diminuído (ósseo ou no geral)
• Alterações no desenvolvimento sexual e na capacidade de ter filhos
• Alterações na função intelectual com problemas no aprendizado
• Desenvolvimento de um segundo câncer mais tarde na vidaNOVIDADES
Quais são as novidades na pesquisa e no tratamento do neuroblastoma?
Pesquisas importantes sobre o neuroblastoma estão em andamento neste momento em muitos hospitais universitários, centros médicos e em outras instituições em todo o mundo. A cada ano, os cientistas descobrem mais sobre o que causa a doença e o modo como melhorar o tratamento.
Classificação de neuroblastomas
Os pesquisadores contam agora com testes laboratoriais melhores para investigar alterações nos genes de células do neuroblastoma. Foram feitos muitos progressos nos últimos anos em descobrir quais neuroblastomas mais provavelmente serão curados com tratamento padrão e quais necessitarão tratamento mais agressivo.
Por exemplo, usando testes laboratoriais mais modernos, pesquisadores descobriram que certas alterações no DNA no braço curto do cromossomo 6 (p622) são mais provavelmente vistas em neuroblastomas que crescem com mais agressividade.
Os médicos estão buscando agora usar esses achados para ajudar na escolha dos melhores tratamentos. Sistemas mais novos de estadiamento e de classificações de grupos de riscos, que tiram proveito de alguns destes achados, devem estar em uso dentro dos próximos anos.
Tratamento
As taxas de sobrevida de cânceres na infância melhoraram, pois os médicos descobriram maneiras para aperfeiçoar os tratamentos atuais. Os pesquisados prosseguem buscando melhores maneiras para tratar o neuroblastoma.
Quimioterapia
Os médicos seguem pesquisando as melhores combinações de medicamentos quimioterápicos para tratar o neuroblastoma.
Diversos medicamentos quimioterápicos que já estão sendo utilizados para tratar outros tipos de câncer, como topotecano, irinotecano e temozolomida, estão sendo estudados atualmente para o uso contra o neuroblastoma. Além disso, alguns medicamentos mais recentes que atuam em maneiras diferentes dos medicamentos quimioterápicos padrão estão sendo também estudados em outros países para o tratamento do neuroblastoma. Os exemplos incluem bortezomibe, nifurtimox e lestaurtinibe.
Outros estudos estão investigando se crianças com neuroblastoma de risco intermediário ou baixo podem ser tratadas com menos quimioterapia. A meta é ainda obter os mesmos bons resultados, mas com menos efeitos colaterais provocados pelo tratamento.
Transplantes de células-tronco
Os médicos estão tentando também melhorar as taxas de sucesso com quimioterapia em alta dose e transplantes de células-tronco, utilizando diferentes combinações de quimioterapia, radioterapia, retinoides e outros tratamentos. Alguns estudos clínicos estão investigando o uso de mais de um transplante de células-tronco no mesmo paciente (conhecido como transplante em tandem). Outros estão buscando ver se o uso de células-tronco de outra pessoa (um transplante alogênico) poderia ajudar algumas crianças com tumores difíceis de tratar.
Retinoides
Retinoides como o ácido 13-cis retinoico (isotretinoína) demonstram promessa em reduzir o risco de recorrência depois do tratamento. Retinoides mais novos, potencialmente mais eficazes, como fenretinida, estão sendo examinados agora em estudos clínicos.
Formas mais recentes de tratamento
O conhecimento sobre o que torna células de neuroblastoma diferentes de células normais pode levar a novas abordagens para tratar esta doença. Diversas formas de terapias mais novas, direcionadas mais especificamente contra células de neuroblastoma do que os tratamentos tradicionais, atualmente estão sendo investigadas em estudos clínicos.
Por exemplo, os médicos estão estudando agora medicamentos que visam especificamente o mecanismo de ação de células de neuroblastoma, tal como um medicamento que inibe a via do ALK ou a via aurora A. Um exemplo é o crizotinibe, um medicamento direcionado a células com alterações no gene ALK. Até 15% dos neuroblastomas apresentam alterações neste gene. Estudos que testam este medicamento estão sendo iniciados no momento.
O anticorpo monoclonal ch 14.18, cujo alvo é GD2 em células de neuroblastoma, é utilizado agora de rotina para crianças com neuroblastoma de alto risco, para ajudar que células do sistema imune encontrem e destruam as células cancerosas. Estudos clínicos estão em andamento para testar a efetividade de diversos outros anticorpos direcionados ao GD2. Um exemplo é o hu 14.18-IL-2, um anticorpo que está ligado à interleucina-2 (uma citocina que reforça o sistema imune). Resultados iniciais constataram que esta combinação anticorpo/citocina pode ajudar algumas crianças nas quais outros tratamentos não estão funcionando mais.
Diversas vacinas contra câncer estão também sendo estudadas para o uso contra o neuroblastoma. Para estas vacinas, células modificadas de neuroblastoma ou outras substâncias são injetadas no corpo para tentar fazer com que o próprio sistema imune da criança ataque as células cancerosas. Estes tratamentos estão ainda nos estágios mais precoces de estudos clínicos.
O QUE PERGUNTAR AO MÉDICO?
O que você deve perguntar ao médico de seu filho sobre o neuroblastoma?
É importante ter discussões abertas honestas com sua equipe de tratamento do câncer. Você deve sentir-se à vontade para fazer qualquer pergunta que tenha em mente, não importando o quanto insignificante possa parecer.
Entre as perguntas que você poderia querer fazer estão:
• Qual é o estágio (extensão) do neuroblastoma?
• Qual é o grupo de risco que o câncer do meu filho se encontra? O que isso significa no caso do meu filho?
• O que mais pode me informar sobre o câncer com base nos testes laboratoriais?
• Existem quaisquer outros testes que precisam ser feitos antes que discutamos o tratamento?
• Qual é sua experiência em tratar este tipo de câncer?
• Quais são os outros médicos que precisaremos consultar?
• Quais são nossas opções de tratamento?
• Um tipo de tratamento aumenta a chance de cura mais do que outro?
• Há outros estudos clínicos que deveríamos considerar?
• Qual tratamento você recomenda? Por quê?
• Quais são os possíveis efeitos colaterais do tratamento? O que pode ser feito a respeito?
• Qual será a duração do tratamento? O que envolverá? O que será realizado?
• Quanto tempo levará para que meu filho se recupere do tratamento?
• Qual são as probabilidades do câncer recorrer? O que faríamos se isso acontecer?
• Existem riscos a longo prazo ou complicações da doença ou do tratamento?
• O que devo fazer para ajudar meu filho a estar pronto para o tratamento?
• Que tipo de acompanhamento meu filho necessitará depois do tratamento?
• Existe um grupo de apoio para famílias que estão enfrentando neuroblastoma ou câncer na infância?Junto com estas perguntas de amostra, certifique-se de anotar algumas próprias. Por exemplo, você poderia querer mais informações sobre períodos de tempo para recuperação de modo que possa planejar seus esquemas para escola e trabalho. Você pode querer perguntar também sobre obter uma segunda opinião. Mantenha em mente também que os médicos não são os únicos que podem fornecer-lhe informações. Outros profissionais de saúde como, por exemplo, enfermeiras e assistentes sociais, podem ter as respostas que você procura.
- Estadiamento
-
Como é feito o estadiamento do neuroblastoma?
Estadiamento é o processo de se descobrir o quanto um câncer se disseminou. A previsão (prognóstico) para pessoas com câncer depende, em grande medida, do estágio do câncer. O estágio de um câncer é um dos fatores mais importantes ao ser escolhido um tratamento.
O estágio do neuroblastoma tem como base resultados de exames físicos, exames de imagem e biópsias do tumor principal e de outros tecidos, os quais foram descritos na seção “Como o neuroblastoma é diagnosticado?”, bem como os resultados de cirurgia.Para o neuroblastoma, diversos outros fatores afetam também o prognóstico, inclusive idade da criança e certos exames e tumor. Embora não sejam utilizados para determinar o estágio do câncer, estes fatores prognósticos são usados, juntamente com o estágio do câncer, para determinar em qual grupo de risco uma criança se enquadra. Estes fatores prognósticos e grupos de risco estão também descritos abaixo e na seção “Grupos de risco”.
Sistema Internacional de Estadiamento do Neuroblastoma
Um sistema de estadiamento é uma maneira padronizada para a equipe que trata o câncer descrever a sua extensão. A partir da metade da década de noventa, a maioria dos centros de câncer tem utilizado o Sistema Internacional de Estadiamento do Neuroblastoma (INSS) para estadiar neuroblastoma. Em forma simplificada, os estágios são:
Estágio 1: O câncer ainda está na área onde iniciou. Está localizado em um lado do corpo (direito ou esquerdo). Todo o tumor visível é totalmente removível por cirurgia (embora as margens do tumor, examinadas sob o microscópio depois da cirurgia, possam mostrar algumas células cancerosas). Linfonodos situados no interior do tumor podem conter células de neuroblastoma, mas os existentes fora do tumor estão livres do câncer.
Estágio 2A: O câncer ainda está na área onde iniciou e em um lado do corpo, mas nem todo o tumor visível pode ser removido por cirurgia. Linfonodos situados no interior do tumor podem conter células de neuroblastoma, mas os existentes fora do tumor estão livres do câncer.
Estágio 2B: O câncer está em um lado do corpo e pode ou não ser possível que seja totalmente removido por cirurgia. Linfonodos próximos, fora do tumor, contêm células de neuroblastoma, mas o câncer não se espalhou para linfonodos no outro lado do corpo ou para outro local.
Estágio 3: O câncer não se espalhou para partes distantes do corpo, mas uma das afirmações seguintes é verdadeira:
– O câncer não pode ser completamente removido por cirurgia e atravessou a linha mediana (definida como a coluna vertebral) para o outro lado do corpo. Pode ou não ter se espalhado para linfonodos próximos.
– O câncer ainda está na área onde se iniciou e está situado em um lado do corpo. Já se espalhou para linfonodos que são relativamente próximos, mas no outro lado do corpo.
– O câncer está no meio do corpo e crescendo em direção aos dois lados (seja diretamente ou por disseminação para linfonodos próximos) e não pode ser completamente removido por cirurgia.Estágio 4: O câncer se disseminou para sítios distantes, tais como linfonodos distantes, osso, fígado, pele, medula óssea ou outros órgãos (mas a criança não atende aos critérios para o Estágio 4S).
Estágio 4S (denominado também neuroblastoma “especial”): A criança é mais nova do que 1 ano de idade. O câncer está em um lado do corpo. Pode ter se espalhado para linfonodos no mesmo lado do coro, mas não para nódulos no outro lado. O neuroblastoma se espalhou para o fígado, a pele e/ou a medula óssea. Contudo, no máximo 10% das células da medula podem ser cancerosas, e os exames de imagem, como exame com MIBG, não mostram disseminação para os ossos.
Recorrente: Embora não integre formalmente o sistema de estadiamento, esse termo é empregado para descrever o câncer que retornou (recorreu) depois de ter sido tratado. O câncer pode retornar na área onde primeiramente iniciou ou em outra parte do corpo.Sistema Internacional de Estadiamento de Grupos de Risco para Neuroblastoma
Um sistema mais novo de estadiamento, conhecido como o Sistema Internacional de Estadiamento de Grupos de Risco para Neuroblastoma (INRGSS), não utiliza os resultados de cirurgia para ajudar a determinar o estágio. O sistema permite que o médico determine um estágio antes da cirurgia, com base nos resultados de exames físicos, exames de imagem e biópsias. O INRGSS está sendo estudado para ter a certeza de que é útil, de modo que o INSS ainda está sendo utilizado por ora. O sistema mais novo pode substituir o INSS no futuro próximo.